艾曲泊帕联合重组人血小板生成素在免疫性血小板减少症患儿中的应用
方华,何璐伟,汪运鹏,张蕾,李红
原发免疫性血小板减少症(immune thrombocytopenia,ITP),是一种由免疫介导的血小板破坏增加或巨核细胞成熟障碍以单纯血小板减少为主要特征的获得性自身免疫性出血性疾病,是临床最常见出血性疾病之一[1]。由于儿童免疫系统尚未发育完善,为ITP 的高发人群。当发生ITP后,患儿常出现皮肤、黏膜或内脏的广泛出血,甚至出现危及生命的颅内出血,使患儿生命安全受到极大威胁[2-4]。目前,临床上ITP 以糖皮质激素和静注人免疫球蛋白为经典的一线治疗方案,也可以联合重组人血小板生成素(recombinant human thrombopoietin,rhTPO)治疗,但经典一线治疗方案联合rhTPO 治疗后,仍有很多患儿未达到理想治疗目标而发展为慢性ITP[4-5]。艾曲泊帕是一种促血小板生成素受体激动剂,对TPO 受体的释放具有促进作用,可加快血小板生成,其在成人ITP 治疗方面取得了较好的治疗效果[6],因此推断其在儿童ITP 治疗方面也有一定疗效。而艾曲泊帕联合rhTPO 对儿童ITP 治疗的临床疗效是否优于单药rhTPO 鲜有报道。基于此,本研究通过观察艾曲泊帕联合rhTPO 与单用rhTPO 对ITP 患儿的临床指标,以期探索其在ITP 患儿中的应用。现报道如下。
1 资料与方法
1.1 一般资料
收集2019 年7 月~2022 年7 月在某院治疗的ITP 患儿92 例作为研究对象。采用随机数字表法分为观察组和对照组,每组46 例。对照组:男性27 例,女性19 例;年龄4~15 岁,平均年龄(9.74±2.35)岁;体重21~48kg,平均体重(34.31±4.72)kg。观察组:男性26 例,女性20 例;年龄4~15 岁,平均年龄(9.83±2.37)岁;体重20~48kg,平均体重(34.68±4.75)kg。两组患儿一般资料比较无统计学差异(P>0.05),具有可比性。本研究通过该院伦理委员会批准(伦理批号:hnxy20190163)。本研究患儿家属知情并签署知情同意书。
纳入标准:①符合儿童ITP 诊断标准者[7]。②血小板计数不超过20×109/L 者。③依从性良好者。
排除标准:①存在先天性心脏病者。②伴有其他血液系统疾病者。③存在甲状腺疾病等导致血小板降低者。④存在脾肿大者。
1.2 治疗方法
所有患儿均给予抗感染、止血、保护胃黏膜等基础治疗。对照组:皮下注射重组人血小板生成素注射液(沈阳三生制药有限责任公司,国药准字S20050048,规格15 000U/1ml)300U/(kg·d),qd,2 周为1 个疗程,血小板计数达到100×109/L 停止给药。观察组:皮下注射rhTPO 联合口服给予艾曲泊帕乙醇胺片[Novartis Pharma Schweiz AG,国药准字H20170387,规格25mg(按C25H22N4O4计)]治疗,艾曲泊帕起始剂量:25mg/d,qd,餐前1h 口服,治疗1 周后调整药物用量不低于75mg/d;rhTPO 用药方式同对照组,2 周为1 个疗程,血小板计数升至100×109/L 停止给药。
1.3 观察指标
(1)血小板计数:分别在治疗前、治疗后1、2周和4 周采集两组患儿静脉血5ml,Sorvall LYNX 4000 高速离心机(赛默飞世尔科技公司)3000r/min(4 ℃)离心15 min。分离后采用Sysmex XE-2100 全自动血细胞分析仪(日本希森美康株式会社)检测血小板计数。
(2)免疫球蛋白水平:在治疗前后抽取患儿肘静脉血5ml,离心分离血清。取上清液,采用SpectraMax iD3 多功能酶标仪(美谷分子仪器有限公司)检测免疫球蛋白水平,即血清免疫球蛋白(immunoglobulin,Ig)A、IgG 和IgM。试剂盒由上海威奥生物科技有限公司提供。
(3)炎症因子水平:在治疗前后抽取患儿肘静脉血5ml,离心分离血清。取上清液,采用化学发光法检测肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素4(interleukin,IL-4)和干扰素-γ(interferon-γ,INF-γ)水平。试剂盒由上海威奥生物科技有限公司提供。
(4)临床疗效情况:参照《儿童原发性免疫性血小板减少症诊疗规范》(2019 年版)[8]评估。①显效:血小板计数≥100×109/L,且无出血。②有效:血小板计数(30~100)×109/L,且比基础血小板计数增加2 倍,且无出血。③无效:治疗后患儿血小板计数变化不明显或有出血。临床总有效率(%)=显效率+有效率。
(5)不良反应发生情况:对所有患儿治疗期间发生恶心、发热、头晕、白细胞减少等不良反应进行记录。
1.4 统计学方法
采用SPSS 20.0 软件进行数据统计学分析。计量资料以±s表示,采用t检验行组间比较,重复测量数据用重复测量方差分析。计数资料以n(%)表示,采用χ2检验行组间比较。P<0.05 为具有统计学差异。
2 结果
2.1 治疗前后两组患儿血小板计数比较
治疗前,两组患儿血小板计数比较无统计学差异(P>0.05)。治疗后1、2 周和4 周,两组患儿血小板水平较治疗前均升高(P<0.05),且观察组高于对照组(P<0.05)(表1)。
表1 治疗前后两组患儿血小板计数比较 n=46,±s,×109/L
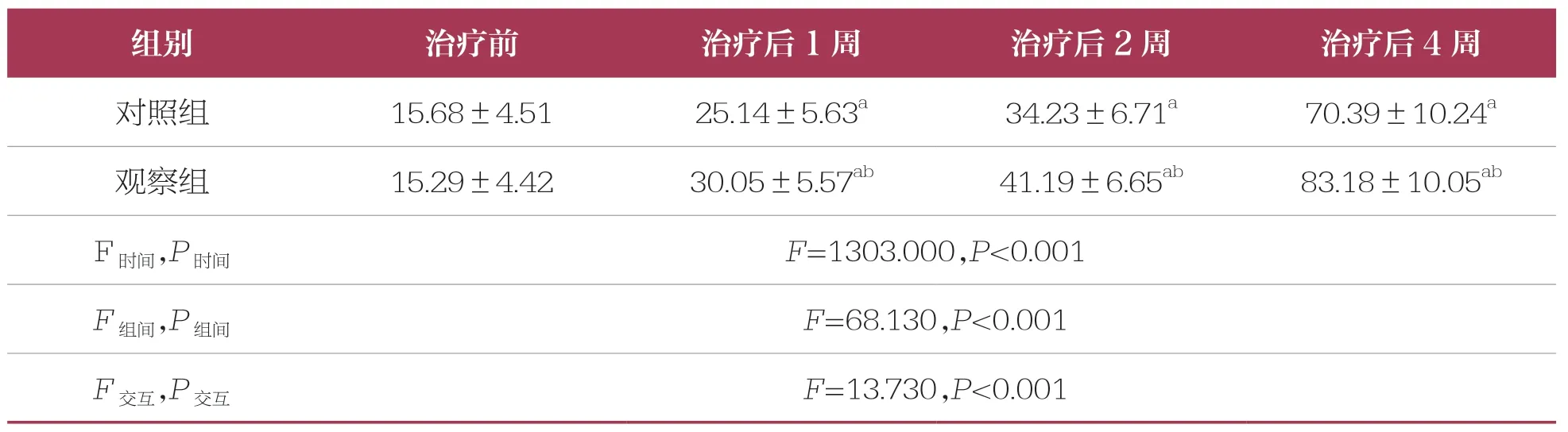
表1 治疗前后两组患儿血小板计数比较 n=46,±s,×109/L
与同组治疗前比较,a:P﹤0.05;与对照组比较,b:P﹤0.05。下同
组别治疗前治疗后1 周治疗后2 周治疗后4 周对照组15.68±4.5125.14±5.63a34.23±6.71a70.39±10.24a观察组15.29±4.4230.05±5.57ab41.19±6.65ab83.18±10.05ab F时间,P 时间F=1303.000,P<0.001 F 组间,P 组间F=68.130,P<0.001 F 交互,P 交互F=13.730,P<0.001
2.2 治疗前后两组患儿免疫球蛋白水平比较
治疗前,两组患儿免疫球蛋白水平比较无统计学差异(P>0.05)。治疗后,两组患儿免疫球蛋白水平均升高(P<0.05),且观察组高于对照组(P<0.05)(表2)。
表2 治疗前后两组患儿免疫球蛋白水平比较 n=46,±s,g/L
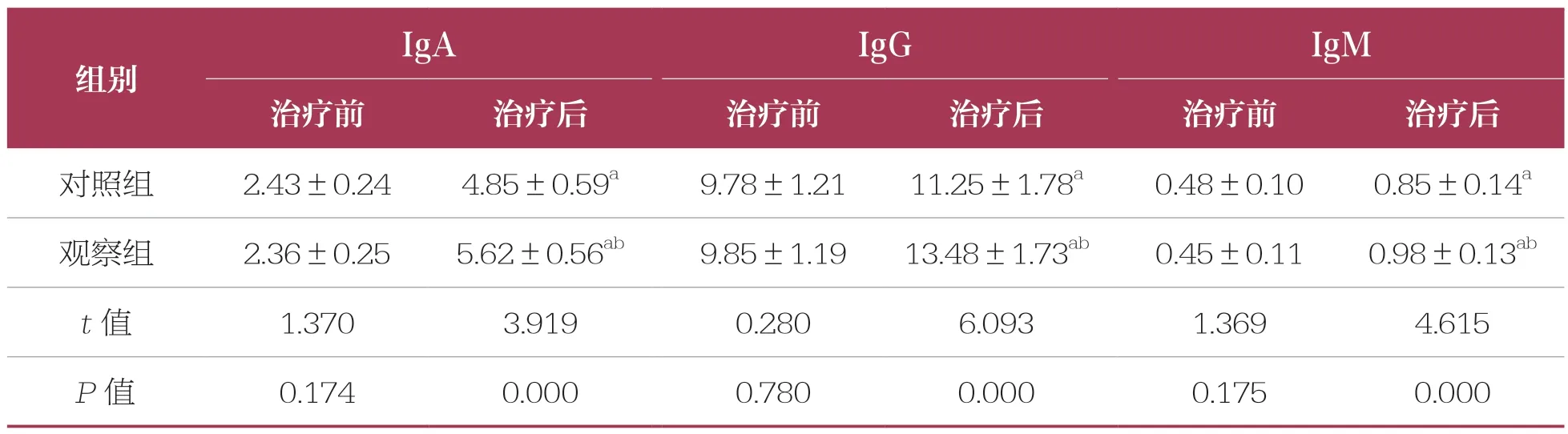
表2 治疗前后两组患儿免疫球蛋白水平比较 n=46,±s,g/L
IgAIgGIgM治疗前治疗后治疗前治疗后治疗前治疗后对照组2.43±0.244.85±0.59a9.78±1.2111.25±1.78a0.48±0.100.85±0.14a观察组2.36±0.255.62±0.56ab9.85±1.1913.48±1.73ab0.45±0.110.98±0.13ab t 值1.3703.9190.2806.0931.3694.615 P 值0.1740.0000.7800.0000.1750.000组别
2.3 治疗前后两组患儿炎症因子水平比较
治疗前,两组患儿炎症因子水平比较无统计学差异(P>0.05)。治疗后,两组患儿TNF-α和INF-γ水平均降低(P<0.05),且观察组低于对照组(P<0.05);IL-4 水平升高(P<0.05),且观察组高于对照组(P<0.05)(表3)。
表3 治疗前后两组患儿炎症因子水平比较 n=46,±s,ng/L

表3 治疗前后两组患儿炎症因子水平比较 n=46,±s,ng/L
TNF-αIL-4INF-γ治疗前治疗后治疗前治疗后治疗前治疗后对照组86.65±12.65 23.41±5.59a0.69±0.110.97±0.16a7.62±1.666.45±1.53a观察组87.39±13.58 18.57±4.73ab0.67±0.121.16±0.15ab7.74±1.585.68±1.44ab t 值0.2704.4830.8335.8760.3552.486 P 值0.7870.0000.4090.0000.7230.015组别
2.4 临床疗效比较
观察组患儿临床治疗总有效率(95.65%)高于对照组(80.43%,P<0.05)(表4)。
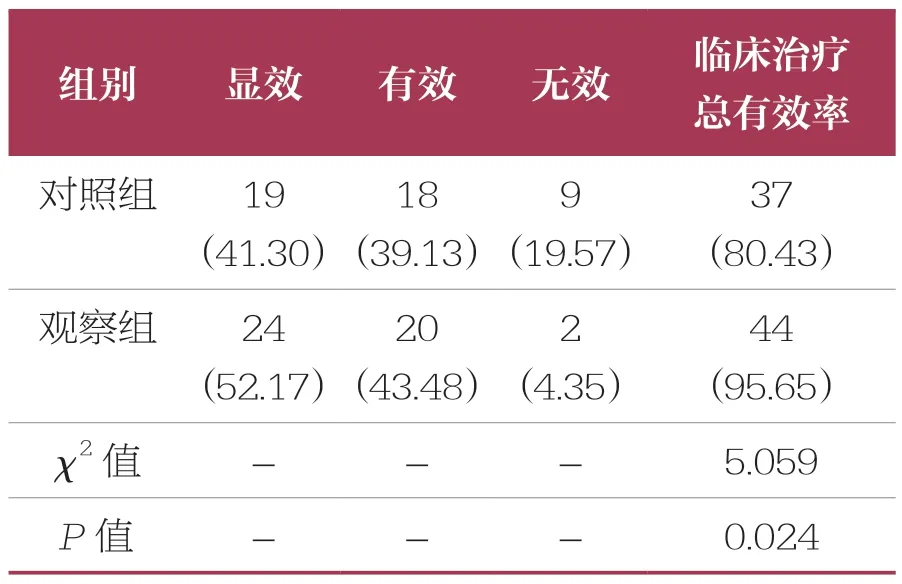
表4 两组患儿临床疗效比较 n=46,n(%)
2.5 不良反应发生情况比较
观察组不良反应总发生率(8.70%)低于对照组(13.04%,P>0.05)(表5)。
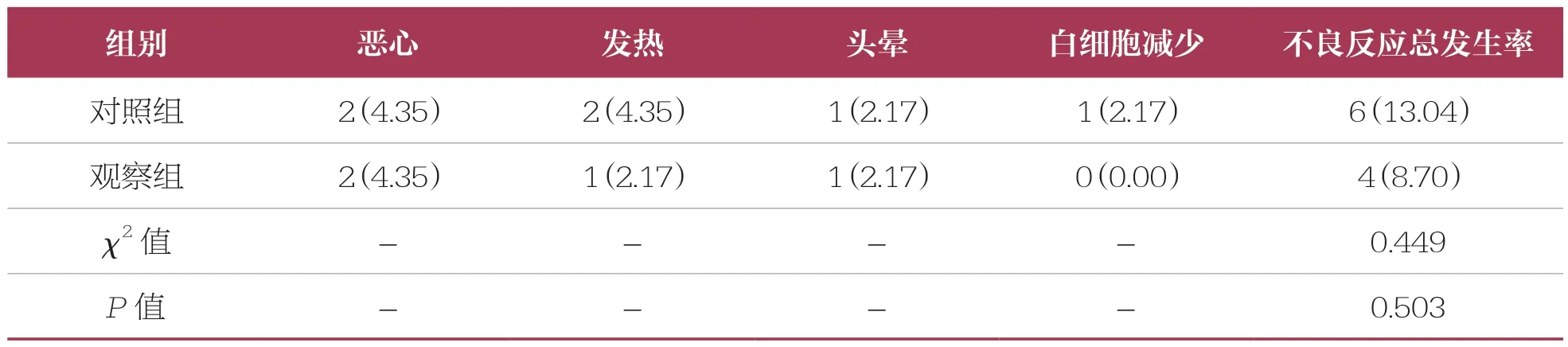
表5 两组患儿不良反应发生情况比较 n=46,n(%)
3 讨论
ITP 是临床常见的血小板减少类疾病,常由免疫功能异常导致血小板被过度破坏或巨核细胞产生的血小板减少而引起[9-10]。目前,临床上治疗ITP 主要目标为提升患儿血小板计数,并使其维持在正常水平,降低内出血发生率[11]。ITP 的临床常见药物有免疫球蛋白抑制剂、rhTPO 和糖皮质激素等,虽然相关药物可有效提高人体内血小板计数,但是容易产生耐药性,且伴随如胃黏膜损伤等并发症[12-13],因此亟需寻找一种新型治疗方法。
艾曲泊帕作为一种新型血小板受体激动剂,其在促进血小板生长方面效果较好,可作用于血小板生成素受体,促进巨核细胞增生,提高巨核细胞的产板能力[14]。而rhTPO 具有刺激巨核细胞生成的作用[15],在促进血小板生成方面两者具有协同作用。本研究结果显示,艾曲泊帕联合rhTPO 较单用rhTPO 治疗ITP 患儿的血小板计数升高。治疗后观察组1、2 周和4 周的血小板计数均高于对照组,且观察组患儿临床治疗总有效率高于对照组,这与杨冉等[16]的研究结果相符。同时,齐彦等[17]对血液肿瘤化疗所致ITP 成人患者进行观察,所有患者经常规治疗后,分别给予单用rhTPO 和rhTPO联合艾曲泊帕治疗,结果显示与单用rhTPO 治疗相比,rhTPO 联合艾曲泊帕治疗后患者血小板计数升高幅度更大,表明联合治疗可以提高成人ITP 患者血小板计数,进一步确认了rhTPO 联合艾曲泊帕对ITP 患儿血小板的改善效果更显著。IgA、IgG 和IgM 为人体免疫球蛋白,其水平变化可反映人体免疫功能的变化[18]。本研究结果显示,艾曲泊帕联合rhTPO 治疗后,患儿免疫球蛋白水平提高,这与李金铭等[19]的研究结果相符,表明两药联用可有效调节ITP 患儿的免疫功能水平。
相关研究提示[20],ITP 的发展与Th1/Th2 细胞比例失衡和病毒感染关系密切。INF-γ与Th1 细胞相关,IL-4 与Th2 细胞相关,而病毒感染机体后单核巨噬细胞可分泌TNF-α等大量炎症因子[20]。本研究结果显示,治疗后观察组TNF-α和INF-γ水平均较对照组更低,IL-4 较对照组更高,这与苏杰等[21]的研究结果相符。表明艾曲泊帕与rhTPO治疗可调节患儿Th1/Th2 细胞比例失衡状态,并通过减少炎症因子释放来有效调节机体免疫状态。刘丹等[22]的研究发现ITP 患儿在治疗期间可出现恶心、发热、头晕和白细胞减少等不良反应;刘苏等[23]对艾曲泊帕治疗儿童造血干细胞移植后血小板减少症的疗效与安全性进行分析,结果显示患儿均无艾曲泊帕相关药品不良反应。本研究结果显示,观察组不良反应总发生率(8.70%)低于对照组(13.04%),无统计学差异,提示对于ITP 患儿治疗两药联用不会增加额外的不良反应,治疗安全性较高。但本研究也存在一定的局限和不足,如研究样本量较少,未来还需通过大样本研究来证实。
综上所述,与单用rhTPO 相比,艾曲泊帕联合rhTPO 治疗可进一步提升ITP 患儿临床疗效,提高血小板计数,降低出血风险,并可改善免疫功能和炎症因子水平,且治疗安全性较高。

