气管内超声引导纵隔肿瘤激光多点消融操作流程
刘丹,万南生,王杰,李广生,谢巍,田羽,冯靖
纵隔肿物是一组具有异质性组织类型的疾病,其中良性病变包括结核、结节病、淋巴结炎症、先天性/后天性囊肿等疾病所致纵隔病变,恶性病变包括原发及转移性纵隔肿瘤。转移性纵隔肿瘤往往早于原发肿瘤被发现,纵隔淋巴结转移是较为常见的纵隔病变[1]。随着恶性肿瘤快速生长,其对邻近的主肺动脉、肺部、心脏等重要器官产生压迫及侵袭,可引起上腔静脉压迫综合征,出现呼吸困难、咯血等临床表现,从而危及生命。及时制定适当的治疗策略应对纵膈肿瘤至关重要。对于无法耐受全身化疗,或肿瘤多线治疗后复发的患者,局部治疗尤为重要。然而,由于纵隔解剖位置原因,放射治疗对其邻近的大血管、支气管树、心脏、食管等重要脏器可能产生不可挽救的不良影响。对复发的转移性纵隔肿瘤患者,尤其是对7 组淋巴结再照射时,需格外警惕气道坏死及气管食管瘘的发生[2-3]。如何权衡有效性及不良反应是纵隔肿瘤局部治疗的难点。相比传统纵隔肿物治疗,气管内超声(endobronchial ultrasound,EBUS)引导激光多点消融治疗纵隔肿瘤具有适应人群广、直接作用靶病灶、术后并发症少等优势。笔者通过总结本中心介入操作经验,阐述EBUS 引导纵隔肿瘤激光多点消融的操作流程。
1 消融范围
本中心采用激光光纤(麦帝施CFE0.6-SMA)进行该项手术。该光纤单点-5 瓦-60 秒(1 p-5 W-60 s)的确切消融范围(白化范围)约20 mm×12 mm。该光纤趋于向前发射能量,见图1。1 p-5 W-60 s时向前确切消融范围约15 mm,向后确切消融范围约5 mm,此外围还有约2 mm的不确定消融区,也应有一定的消融效果。

Fig.1 The EBUS field of view showing ablation fiber tends to emit energy forward图1 EBUS视野可见消融光纤趋于向前发射能量
2 消融时间
消融时间一般5 W-60 s~90 s,单点消融时间在90 s以上时,消融中心可出现较明显的焦化空洞,形成EBUS 超声盲区,可能影响消融过程中对能量分布范围的监测视野,见图2。

Fig.2 An obvious coking cavity appeared in the ablation center,forming a blind spot in the EBUS ultrasound field of view图2 消融中心出现较明显焦化空洞,形成EBUS超声视野盲区
3 消融前准备
3.1 避开大血管 术前应利用CT 三维影像充分规划,术中应仔细研判超声影像,综合分析后于术中设计消融点的三维分布,不建议确切消融范围包含病灶边缘或大血管,见图3。大血管管壁为坚韧结缔组织,只要不是激光直接烧灼,包在确切消融范围内一般也不会发生严重损伤,但大血管管壁本身不易被肿瘤侵犯破坏,我中心尚无充分证据表明确切消融范围包含血管可进一步获益。

Fig.3 The EBUS field of view showed that the fiber endpoint was close to the blood vessel图3 EBUS视野可见光纤端点紧邻血管
3.2 EBUS引导下的纵隔切开术 当术中设计消融点≥3 个时,消融前建议预先进行EBUS 引导下的纵隔切开术(endobronchial ultrasound guided mediastinotomy,EBUS cut),目的在于消融术中减压和术后短期引流,也可根据病灶具体情况,随时配合进行切开手术。另外,纵隔肿瘤激光消融手术往往桥接在EBUS引导纵隔切开取病理标本之后,借助快速现场评价(rapid on site evaluation,ROSE)[4]明确诊断的同时,桥接在同一次手术中开展激光消融治疗。EBUS引导纵隔切开的具体手术流程参考文献[5]。
3.3 EBUS引导的通道减压沸腾式水隔离术 如纵隔消融术中所需消融范围距离血管近,为解决消融损伤,建议消融前行EBUS 引导的通道减压沸腾式水隔离术,即先用EBUS 针在病灶边缘(尤其是靠近血管部分),少量注水。这样即使消融距离接近血管,水沸腾推开血管,也能保证病灶消融而血管不受伤。如进行此项技术,需预先做EBUS cut 建立通道,以达到消融术中因水沸腾压力过高而减压的目的。
3.4 肺内恶性病灶经皮消融术桥接纵隔肿瘤消融术 纵隔肿瘤消融术桥接在肺内恶性病灶经皮消融术之后,这样可以将肺内恶性病灶和潜在的纵隔转移病灶(同侧肺门局属淋巴结)同时灭活,争取达到根治,取得更好的效果。对于肺内恶性病灶,可采用全麻肌松硬镜低压高频条件下封堵海绵填塞辅助的经皮诊疗,使肺内恶性病灶经皮消融和纵隔转移病灶消融同台完成。全麻肌松硬镜低压高频条件下封堵海绵填塞辅助的经皮诊疗的优势在于:(1)封堵海绵填塞联合封堵球囊预置可有效预防治疗大出血。(2)填塞范围内气体压力低,无冲击气流扰动,极少发生气胸或空气栓塞。(3)因患者处于全麻肌松状态,可以用通气机来门控呼吸,控制呼吸动度,以增加穿刺的精确性。(4)患者能够耐受长时间操作且几乎处于绝对静止状态,非常利于精细操作,允许术者操纵手术器械不断精准调整接近目标位置。(5)可以桥接同侧肺门局属淋巴结沸腾式水隔离激光消融术。
4 术中操作
4.1 确定消融点 术前CT 与术中EBUS 的联合规划,加之术中EBUS 对能量分布与新增高回声区域的监测,可保证最适消融范围和足够的覆盖率,见图4。为提高新增高回声区域病灶的覆盖率,不同消融点消融范围的重合可以接受,但过度重合可导致过分焦化,并可增加液化感染的风险。故应充分权衡后确定消融点,并于消融过程中适当调整消融点和消融时间。

Fig.4 EBUS monitoring of energy distribution and new hyperechoic areas during ablation图4 消融术中EBUS对能量分布与新增高回声区域的监测
4.2 烧入 消融光纤应以“重新烧入”的方式在EBUS引导下进入纵隔并抵达预设消融点,不要经由EBUS 引导纵隔切开的切口或者之前的“烧入”路径抵达消融点,以免光纤边缘“漏气”。漏气可造成消融点过分焦化、燃烧、光纤损伤以及光纤进入点周围区域被沿着光纤“反流”的热量所灼伤。激光光纤“烧入”黏膜进入纵隔时,建议能量选择7.5~10 W。
4.3 光纤定位 激光光纤有时EBUS 可视性较差,可轻踩踏板短暂激发,根据EBUS 多普勒能量发射位置或小的高回声位置找到光纤及其端点。
4.4 控制EBUS视野 光纤端点“烧入”进入纵隔并抵达消融点后,往往位于EBUS 视野的左侧边缘,此时如果激发,消融范围部分位于EBUS 视野之外,无法实时监控。应向前推动镜身,调整EBUS 视野,使光纤端点位于EBUS 视野正中,使全部消融能量分布均处于EBUS实时监控中,见图5。

Fig.5 Adjusted the lens body and EBUS field of view so that the fiber endpoint was in the middle of the EBUS field of view图5 调整镜身与EBUS视野,使光纤端点位于EBUS视野中部
4.5 消融效果评价 有条件时可使用超声造影(contrast-enhanced ultrasonography,CEUS)评价消融效果,即消融术前和术毕分别于静脉注射超声对比剂,利用对比剂可以使向后散射回声增强的原理,评价术前、术毕组织灌注和微循环的情况。一部分病灶术毕时造影强化较治疗前明显减弱或消失,提示相应部位组织灌注和微循环阻断,消融效果满意。消融术中以覆盖率实时预估消融效果。术中以EBUS多普勒严密观察能量分布与新增高回声区域,实时预估消融效果。EBUS 新增高回声区域大致代表组织内水分的沸腾区域,与白化范围(确切消融范围)高度吻合。新增高回声区域覆盖病灶的覆盖率>80%,提示消融效果好,见图6。
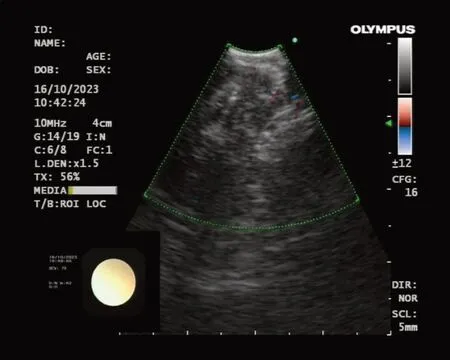
Fig.6 After multi-point laser ablation,two new hyperechoic ablation centers could be seen in the EBUS field of view图6 EBUS视野内可见两个新增高回声消融中心
5 术后维护
5.1 用药及联合治疗 术后可常规应用抗生素3~7 d,术后当日有低热,可能为坏死物吸收导致。如果需要消融的纵隔肿瘤过大(多于5个消融点)或者区域较多(多于2 组淋巴结),可根据实际情况分期进行手术,每期建议间隔1周以上。根据实际病情,纵隔肿瘤激光消融治疗可单独进行,也可与全身治疗联合或序贯进行。
5.2 并发症处理 纵隔肿瘤激光多点消融最严重的并发症是纵隔感染。该并发症发生率较低,需要局部介入与全身用药综合治疗,必要时可进行外科手术干预。消融治疗团队应掌握EBUS 引导纵隔切开[5]、EBUS 引导纵隔建隧[6]、EBUS 引导纵隔锚定置管引流[5]等技术,以应对术后可能发生的严重并发症如纵隔脓肿。
综上所述,由于纵隔解剖结构的复杂性,纵隔肿瘤的治疗给临床医生带来挑战。通过EBUS 引导纵隔建隧、EBUS 引导纵隔切开等技术取得代表性病灶,经ROSE 确认为纵隔恶性肿瘤者,桥接EBUS 引导纵隔肿瘤激光多点消融术,可以达到治疗纵隔肿瘤目的。本文介绍了纵隔肿瘤治疗的创新术式,以期造福更多临床患者。

