高糖诱导HT-22小鼠海马神经元代谢记忆细胞模型的构建及影响
段云峰,许永劼,杨婷婷,黄昶煜东,朱丽英,李兴,潘卫△
糖尿病脑病(diabetes encephalopathy,DE)是糖尿病的严重慢性并发症之一,认知功能受损是其主要表现。糖尿病并发症和控制试验(diabetes complications and control trial,DCCT)表明,糖尿病早期的高血糖对患者并发症的发生与进展具有持久的影响,高血糖对患者的持久损害未能随控制血糖而改善,学者将此现象称为“代谢记忆”[1-2]。研究发现,降糖治疗的糖尿病患者依旧存在认知功能的衰退,可能与“代谢记忆”有关[3-5],然而目前关于DE患者代谢记忆的研究少见。高血糖通过调节表观遗传修饰来影响基因表达,持续的表观遗传的改变可能导致代谢记忆的发生[6]。同时已有研究证实海马神经元凋亡引起的DE 受组蛋白乙酰化修饰的调控[7-8],该过程可通过组蛋白乙酰转移酶(histone acetyltransferases,HAT)和组蛋白去乙酰化酶(histone deacetylases,HDAC)动态调节。课题组前期也发现高糖通过抑制海马神经元组蛋白乙酰化修饰导致凋亡增加[9-10]。然而,组蛋白乙酰化修饰异常的不可逆转是否为海马神经元“代谢记忆”产生的关键目前尚不清楚。本研究旨在构建海马神经元“代谢记忆”细胞模型,探究“代谢记忆”产生机制,为后续研究DE的发病机制提供应用模型。
1 材料与方法
1.1 试剂与仪器 小鼠海马神经元HT-22细胞购自上海中乔新舟生物科技有限公司;兔源β-肌动蛋白(β-actin)多克隆抗体、兔源HDAC4多克隆抗体、鼠源B淋巴细胞瘤-2(Bcl-2)单克隆抗体、鼠源Bcl-2相关X蛋白(Bax)单克隆抗体和鼠源胱天蛋白酶3(Caspase-3)多克隆抗体均购于武汉三鹰生物技术有限公司;辣根过氧化物酶(HRP)标记羊抗兔二抗及羊抗鼠二抗购于南京巴傲得生物科技有限公司;膜联蛋白Ⅴ-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)细胞凋亡检测试剂盒购于江苏凯基生物技术股份有限公司;增强化学发光(ECL)试剂盒购自大连美仑生物技术有限公司;HAT和HDAC酶联免疫吸附试验(ELISA)试剂盒购自上海酶联生物技术有限公司;CCK-8检测试剂盒购自日本同仁化学研究所;乳酸脱氢酶(lacate dehydrogenase,LDH)活性检测试剂盒、二喹啉甲酸(BCA)试剂盒和RIPA 高效裂解液购自北京索莱宝科技有限公司;流式细胞仪购于美国贝克曼库尔特有限公司;倒置显微镜购于日本Nikon公司;蛋白免疫印迹电泳仪、IMARK型酶标仪、ECL曝光仪购于美国Bio-Rad公司。
1.2 实验方法
1.2.1 细胞培养与处理 将HT-22细胞分为以下各组:常糖组(NG 4、6、8 组,25 mmol/L 葡萄糖分别培养4、6、8 d),高糖组(HG 4、6、8 组,55 mmol/L 葡萄糖培养4、6、8 d),代谢记忆组(HG2NG2、HG2NG4、HG2NG6、HG4NG2、HG4NG4 组,即55 mmol/L 葡萄糖培养2 d 转25 mmol/L 葡萄糖培养2、4 或6 d,55 mmol/L葡萄糖培养4 d转25 mmol/L葡萄糖培养2 d或4 d),每24 h更换1次培养基。
1.2.2 CCK-8 法测定细胞活力 将HT-22 细胞以1×105/mL的密度接种在96孔板中,置于37 ℃、5%CO2的培养箱中培养24 h,待细胞贴壁后根据1.2.1所述进行分组处理,每组设置5个复孔。每孔加入100µL细胞悬液。待作用时间到达后,弃去原培养基,加入细胞活性检测试剂(10µL CCK-8 检测试剂,90µL 培养基),避光置于37 ℃、5%CO2的培养箱中孵育2.5 h 后用酶标仪在450 nm 波长处测定各组光密度(OD)值。按照以下公式计算细胞存活率:(实验组OD均值-空白组OD均值)/(对照组OD均值-空白组OD均值)×100%。
1.2.3 LDH 释放量检测 将细胞以1×105/mL 的密度均匀接种于96孔板中,按照1.2.1所述进行分组。每组细胞设置5个复孔,在37 ℃、5%CO2培养箱中进行培养,待相应作用时间到达后,取每孔细胞上清液20 µL 置于96 孔板中,严格按照LDH 试剂盒说明书操作进行,使用酶标仪于450 nm 波长处读取各组细胞OD值。
1.2.4 光学显微镜观察各组细胞形态差异 将细胞分为5组:NG4 组、NG8 组、HG4 组、HG4NG4 组和HG8 组。各组细胞按相应条件达预定处理时间后,分别从CO2培养箱中取出,于倒置相差显微镜下观察细胞生长状态、数量及形态,并拍摄记录。
1.2.5 流式细胞术检测细胞凋亡 流式细胞仪检测海马神经元的凋亡情况,将海马神经元接种到96孔板中,按1.2.4分组。待细胞培养到相应时间后用0.125%胰酶进行消化,收集细胞。然后加入500µL结合缓冲液重悬细胞,在细胞悬液中分别加入5 µL Annexin V-FITC 和PI,并在室温避光5~10 min后用流式细胞仪检测细胞凋亡率。每组重复3次。
1.2.6 ELISA 法检测HAT 和HDAC 活性 将HT-22 细胞以1 000个/孔的密度接种于96孔板中,按1.2.4分组。培养48 h后,收集细胞上清液进行ELISA 检测。孵育和洗涤后,每孔加入100µL 显色试剂,避光孵育15 min。然后,在每孔中加入50µL 终止液。最后用酶标仪在450 nm 波长下测定每个孔的OD值。
1.2.7 Western blot 检测蛋白表达水平 将细胞按1.2.4 分组,使用含有蛋白酶抑制剂的RIPA 裂解试剂来裂解5 组细胞。采用BCA蛋白质定量试剂盒测量蛋白质浓度,通过10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离待测蛋白质,并电转移至聚偏二氟乙烯膜。室温下用5%牛血清白蛋白密封膜2 h,随后将膜分别放入β-actin(1∶5 000)、Caspase-3(1∶2 000)、Bcl-2(1∶1 000)、Bax(1∶1 000)和HDAC4(1∶1 000)一抗中,并在摇床上4 ℃孵育过夜。TBST 洗膜3 次后,用HRP标记的羊抗兔IgG 二抗(1∶5 000)或羊抗鼠IgG 二抗(1∶2 000)室温孵育2 h。使用ECL 试剂盒对各组组的蛋白条带进行曝光显影。最后使用软件Image J 1.6.0对灰度值进行分析和比较,每种蛋白至少重复3次。
1.3 统计学方法 采用SPSS 21.0 和GraphPad Prism 9.0 软件进行数据分析,计量资料以表示,每个实验重复3次。2组间比较采用t检验,多组比较采用单因素方差分析,组间多重比较采用Tukey检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同高糖作用时间对细胞存活率的影响 相同干预时间下,HG4、6、8 组细胞存活率均较NG 组下降(P<0.05);干预4、6 d 时,HG2NG2、HG2NG4、HG4NG2组细胞相较于相同作用时间的HG4、6组存活率均升高(P<0.05);与HG8 组相比,HG4NG4 组细胞存活率差异无统计学意义,可能存在代谢记忆,为理想的高糖“代谢记忆”细胞模型,见图1。

Fig.1 Comparison of cell survival rates between three groups图1 各组细胞存活率的比较
2.2 不同高糖作用时间对细胞LDH 释放量的影响 常糖组(取NG 4、6、8 组平均值)、HG4 组、HG6组、HG8 组、HG2NG2 组、HG2NG4 组、HG2NG6 组、HG4NG2组、HG4NG4组LDH释放量(OD值)分别为0.321±0.007、 0.350±0.005、 0.373±0.005、 0.380±0.004、 0.331±0.005、 0.323±0.007、 0.321±0.003、0.362±0.005和0.380±0.005,LDH释放量变化与细胞存活率一致;相同干预时间下,HG4、6、8 组LDH 释放量较NG 组均增加(P<0.01);干预4、6 d 时,HG2NG2、HG2NG4、HG4NG2 组细胞相较于相同作用时间的HG4、6 组LDH 释放量降低(P<0.05);与HG8组相比,HG4NG4组释放量差异无统计学意义。
2.3 各组细胞显微镜下形态变化 通过对各组细胞显微镜下的形态学观察,发现NG4、NG8组细胞交织成致密网状,生长状态良好,细胞呈梭形,突触结构明显。而HG4、HG8组细胞生长受抑制,突触结构消失,胞体呈圆形。HG4NG4 组即使在转换为25 mmol/L葡萄糖培养后的细胞数量虽有增多,但细胞形态依旧未能恢复,见图2。
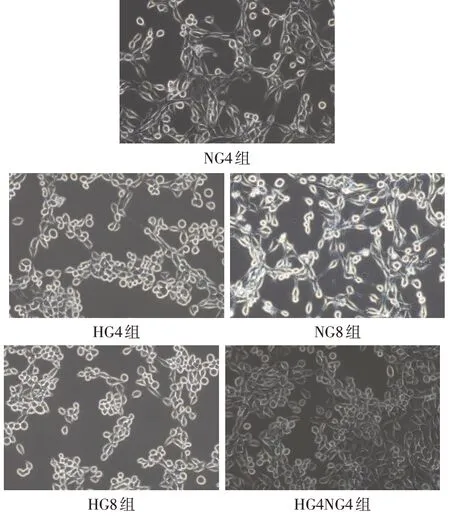
Fig.2 Morphological changes of cells in each group under optical microscope(×200)图2 光学显微镜下各组细胞形态变化(×200)
2.4 各组细胞凋亡情况比较 NG4组、HG4组、NG8组、HG4NG4 组、HG8 组凋亡率(%)分别为2.43±0.20、24.23±0.9、7.83±0.25、24.90±1.20、27.73±0.93(n=3,F=611.061,P<0.01)。分别与NG4、NG8 组相比,HG4、HG8组细胞凋亡率增加(P<0.05);与NG8组相比,HG4NG4 组细胞凋亡率显著增加(P<0.05)。见图3。

Fig.3 Flow cytometry of each group图3 各组细胞流式图
2.5 各组HAT 和HDAC 水平比较 分别与NG4、NG8组相比,HG4、HG8组HAT和HDAC水平均增高(P<0.05);与NG8 组相比,HG4NG4 组HAT 和HDAC水平增高(P<0.05);与HG8组相比,HG4NG4组细胞HAT、HDAC水平差异无统计学意义,见表1。
Tab.1 Comparison of HAT and HDAC activities of HT-22 cells between five groups表1 各组间HT-22细胞HAT及HDAC活性比较(n=3,OD450,)

Tab.1 Comparison of HAT and HDAC activities of HT-22 cells between five groups表1 各组间HT-22细胞HAT及HDAC活性比较(n=3,OD450,)
**P<0.01;a与NG4组比较,b与NG8组比较,P<0.05。
组别NG4组NG8组HG4组HG8组HG4NG4组F HAT 0.61±0.03 0.62±0.02 0.80±0.01a 0.87±0.06b 0.87±0.02b 72.467**HDAC 0.61±0.02 0.61±0.03 0.82±0.01a 1.05±0.05b 1.00±0.07b 123.289**
2.6 各组HDAC4、Bax、Bcl-2和Caspase-3蛋白表达水平比较 分别与NG4、NG8 组相比,HG4 组、HG8组的HDAC4、Bax和Caspase-3蛋白表达增加,Bcl-2表达水平降低(P<0.01);与NG8 组相比,HG4NG4组HDAC4、Bax和Caspase-3蛋白表达增加,Bcl-2表达水平降低(P<0.01),而HG4NG4组各蛋白与HG8组比较差异无统计学意义,见表2、图4。
Tab.2 Expression of HDAC4 and apoptosis related proteins in each group of cells表2 各组细胞HDAC4及凋亡相关蛋白表达情况(n=3,)

Tab.2 Expression of HDAC4 and apoptosis related proteins in each group of cells表2 各组细胞HDAC4及凋亡相关蛋白表达情况(n=3,)
**P<0.01;a与NG4组比较,b与NG8组比较,P<0.05。
组别NG4组NG8组HG4组HG8组HG4NG4组F HDAC4 0.37±0.01 0.36±0.01 0.54±0.06a 0.77±0.03b 0.77±0.02b 113.820**Bax 0.29±0.01 0.28±0.01 0.53±0.02a 0.60±0.01b 0.61±0.02b 427.796**Bcl-2 0.78±0.02 0.76±0.02 0.66±0.03a 0.47±0.01b 0.49±0.02b 127.964**Caspase-3 0.28±0.01 0.26±0.01 0.63±0.01a 0.74±0.01b 0.75±0.03b 464.712**

Fig.4 HDAC4,Bax,Bcl-2 and Caspase-3 protein expression图4 HDAC4、Bax、Bcl-2和Caspase-3蛋白表达情况
3 讨论
DE 可直接影响患者的认知功能[11]。然而,DE的发病机制十分复杂,至今尚未阐明。临床上糖尿病患者大多血糖控制良好,但仍有不少患者出现认知功能障碍,DE的发生发展是否存在高血糖的代谢记忆效应值得探究。基于“代谢记忆”效应探究糖尿病不同并发症发病机制的细胞模型已得到广泛研究,如血管平滑肌细胞代谢记忆模型[12]、视网膜内皮细胞代谢记忆模型[13]等。海马体作为大脑中学习和记忆的关键区域,对葡萄糖稳态的变化较为敏感[14],因此本研究选用海马神经元作为对象。研究表明,DE 与海马神经元凋亡密切相关[15]。HT-22 细胞系作为小鼠海马神经元永生化细胞系,目前广泛应用于阿尔茨海默病以及DE等神经退行性疾病的研究,课题组前期研究发现相较于原代海马神经元,HT-22小鼠海马神经元受高糖及脂质体转染影响小,细胞抗性强,有利于后续利用高糖对其进行不同时间干预[16],因此本模型构建选用HT-22 细胞系。本研究参考Yao等[17]构建内皮细胞“代谢记忆”模型的构建方法分别以高糖4 d 干预细胞之后再予以正糖培养4 d,由于高糖对细胞有损伤,因此本研究将各组细胞最长处理时间定为8 d。通过CCK-8及LDH释放实验发现,相同的干预时间下,只有HG4NG4组与HG8 组相比存活率和LDH 释放量均无差异,表明HG4NG4 组更加符合文献报道的“代谢记忆”现象,因此本研究以HG4NG4 组用于构建神经元“代谢记忆”模型来进行后续实验。本研究通过对各组细胞凋亡水平进行检测发现,与NG4 组相比,HG4 组细胞促凋亡蛋白Bax和Caspase-3表达增加,而抗凋亡相关蛋白Bcl-2 表达降低,流式细胞术的结果也表明该组细胞凋亡率增加。与NG8 组相比,HG4NG4组细胞的促凋亡蛋白Bax和Caspase-3表达增加,而抗凋亡相关蛋白Bcl-2 表达降低;与HG8 组相比,HG4NG4 差异无统计学意义,提示高糖对HG4NG4组HT-22 小鼠海马神经元的损伤存在“记忆”现象,这与任伟伟等[18]在人牙周膜细胞所观察的现象一致,该研究发现与全程高糖培养的牙周膜细胞相比,先经高糖培养再以正糖培养的细胞凋亡仍有增强。
组蛋白乙酰化修饰可调控凋亡相关基因表达,组蛋白乙酰化作为一种可逆的蛋白质翻译后修饰过程,受HAT 以及HDAC 动态调节,并在真核细胞的染色质调控与基因表达中起重要作用[19]。课题组前期对HT-22 小鼠海马神经元的研究发现,高糖可通过上调其HAT 与HDAC 活性加剧细胞凋亡的发生,而何首乌提取物大黄素通过抑制HAT 与HDAC 的活性减少神经元细胞凋亡[20]。在本研究构建的HG4NG4 组神经元“代谢记忆”模型中,细胞凋亡并未因葡萄糖浓度的逆转而改善,同时其HAT 与HDAC活性高于常糖组;相较于HG8组,HG4NG4组HAT、HDAC 水平无显著差异。Zheng 等[21]研究发现,沉默信息调节因子2 相关酶1(sirtuin 1,SIRT1)在高糖诱导的“代谢记忆”内皮细胞中表达降低活性减弱,而过表达的SIRT1终止了内皮细胞的“代谢记忆”现象产生。Zhong 等[22]研究发现,在代谢记忆视网膜内皮细胞中,HDAC1、HDAC2、HDAC8 活性的增高未随高糖环境改善而改变,HDAC 持续增强所致的组蛋白H3 整体乙酰化水平降低的不可逆转是糖尿病视网膜“代谢记忆”现象产生的重要原因。课题组前期研究发现高糖通过上调海马神经元中HDAC4 的表达导致凋亡增加[9],在本研究中相较于NG4组,HG4组HDAC4表达显著升高。而与HG8组相比,HG4NG4 组细胞HDAC4 表达无差异,未因高糖环境改善而逆转,同样存在“记忆”现象。曾有学者提出“巴克假说”,即母体表观遗传学变化,并将这种改变传递给胎儿[23]。该现象与高糖损伤所致的“代谢记忆”相似,可见表观遗传学调控在其中起关键作用。也有研究表明,高脂饮食可致瘦素基因高度甲基化,使得该基因表达下调,这种甲基化的异常在其后代可持续存在,并且即使后代恢复正常饮食,该状况依旧不能逆转[24]。结合本研究结果,笔者推测构建神经元模型中HAT、HDAC 活性的持续改变是代谢记忆效应产生的关键“开关”。Zhao 等[25]通过构建人视网膜内皮细胞代谢记忆模型发现,高糖对SIRT1 的抑制在恢复到正常糖浓度后持续存在,SIRT1 是该细胞代谢记忆的效应因子,同时激活SIRT1的表达可阻止“记忆”现象的产生。笔者推测神经元模型的“代谢记忆”效应与组蛋白乙酰化修饰密切相关,可能受HDAC4 的调控。然而,本研究尚未阐明组蛋白乙酰化修饰调控“代谢记忆”发生的具体分子机制,围绕HDAC4的持续高表达并寻找其下游同样存在“记忆”效应的乙酰化位点,这将是本研究围绕此体外“代谢记忆”模型继续深入研究的重点。
阻止“代谢记忆”的发生是预防糖尿病并发症的重要策略[26],DE 起病隐匿,因此单纯控制血糖并不能减少糖尿病脑病的发展。由于本研究构建的海马神经元“代谢记忆”模型与HAT、HDAC 活性增高有关,因此针对海马神经元HAT 与HDAC 的干预可作为预防“代谢记忆”产生的有效措施。目前,已有针对HAT、DNA甲基转移酶的抑制剂作为表观遗传药物应用于肿瘤的治疗[27]。有研究报道CBP/P300 乙酰转移酶激活剂CSP-TTK21 的治疗恢复了阿尔茨海默病(AD)小鼠海马fos基因启动子处的H2B乙酰化水平,上调了突触可塑性相关基因表达,改善AD小鼠认知功能障碍[28]。泛组蛋白去乙酰化酶抑制剂可通过抑制鱼藤酮诱导的HT-22神经元的HDAC活性升高来缓解炎症与氧化应激[29]。结合本研究发现HAT、HDAC 的持续激活以及HDAC4 表达增高,再选用相应的“阻断剂”并联合控糖治疗或许能够终止代谢记忆的发生,这也将是本研究后续研究重点。
综上所述,HT-22细胞经高糖培养4 d后转常糖培养基培养4 d为理想的“代谢记忆”神经元模型,高糖对其损伤存在“记忆”效应;神经元“代谢记忆”的发生可能由高糖引起的组蛋白乙酰化修饰异常所致。

