濒危植物黑牡丹KASP鉴定方法的建立
吴晶 刘晓宇 伏建国 郭静 杨晓军 李洋 梁超 李井干


摘要 为了建立濒危植物黑牡丹的KASP鉴定方法,选取6种13份岩牡丹属植物样品为材料,根据磷酸烯醇式丙酮酸羧化酶(PEPC)基因上的单核苷酸多态性(SNP)位点,设计黑牡丹特异性KASP引物,用于PCR扩增。结果表明,通过PEPC序列的SNP位点所设计的KASP引物可以在黑牡丹与其近似种之间形成明显的基因分型,能够将其与同属近缘种及其他仙人掌科物种准确地区分开来,可用于黑牡丹的真假鉴定及进出境口岸濒危物种的查验鉴定。
关键词 KASP;黑牡丹;鉴定方法
中图分类号 Q943.2 文献标识码 A 文章编号 0517-6611(2024)01-0098-03
doi:10.3969/j.issn.0517-6611.2024.01.020
开放科学(资源服务)标识码(OSID):
Establishment of KASP Identification Method for Endangered Plant of Ariocarpus kotschoubeyanus
WU Jing,LIU Xiao-yu,FU Jian-guo et al
(Animal,Plant and Food Inspection and Quarantine Center of Nanjing Customs,Nanjing,Jiangsu 210019)
Abstract In order to establish a KASP identification method for the endangered plant Ariocarpus kotschoubeyanus,13 samples of 6 species of Ariocarpus kotschoubeyanus were selected as materials.According to the single nucleotide polymorphism (SNP) site on the phosphoenolpyruvate carboxylase (PEPC) gene,a specific KASP primer was designed for PCR amplification of Ariocarpus kotschoubeyanus.The test results show that,KASP primer designed by SNP site of PEPC sequence can form obvious genotyping between Ariocarpus kotschoubeyanus and its similar species,can accurately distinguish it from its relatives and other cactus species,and can be used for identification of true and false Ariocarpus kotschoubeyanus and identification of endangered species at entry and exit ports.
Key words KASP;Ariocarpus kotschoubeyanus;Identification method
基金項目 南京海关科研项目(2022KJ19) 。
作者简介 吴晶(1981—),女,云南昆明人,高级农艺师,硕士,从事进境物种、杂草鉴定研究。*通信作者,农艺师,硕士,从事进境物种、杂草鉴定研究。
收稿日期 2023-01-04
黑牡丹(Ariocarpus kotschoubeyanus)是仙人掌科岩牡丹属一种多肉植物,形态独特,自然古朴,形似岩石而又有生命,且花色鲜艳,是多肉植物中的经典种类,不少植物爱好者将其视为收藏级品种[1]。岩牡丹属植物主要分布于墨西哥、美国,近年来,由于自然气候的变化、非法采集和贸易、生长缓慢等原因,黑牡丹野生种群数量越来越少,在世界自然保护联盟(IUCN)濒危物种红色名录中被评为“濒危”级别,被列入《濒危野生动植物种国际贸易公约》(ITES)附录I[2]。物种的濒危及灭绝有多方面因素,非法过度采集及贸易就是其中之一,海关各口岸每年都会查获大量非法入境的黑牡丹植株和种子。因此,加强口岸物种资源查验工作可以在一定程度上打击濒危物种的非法贸易,对于黑牡丹的保护具有重要意义。物种的准确鉴定是口岸查验工作的关键,由于黑牡丹与同属其他种类形态相似,特别是幼株和种子在形态上相似度极高,难以区分,因此需要建立准确、快速的分子鉴定方法,为黑牡丹的鉴定提供技术支撑。
竞争性等位基因特异性PCR(kompetitive allele-specific PCR,KASP)技术是一种基于SNP(单核苷酸多态性single nucleotide polymorphism)的高通量基因分型技术。利用独特的等位基因特异性PCR原理,采用双色荧光检测1个SNP位点的2种基因型,可对基因组DNA样品中的目标SNP进行精准的双等位基因分型检测[3],目前该技术已经应用于辅助育种、品种检测和物种鉴定等领域。钟婷婷等[4]对甘蓝型油菜抗根肿病和感病植株进行基因分型,基于SNP位点开发的KASP标记可以准确高效地应用于油菜抗根肿病材料的分子标记辅助选择育种。王富强等[5]利用KASP标记,构建了不同葡萄种类的SNP指纹图谱,验证了KASP技术在我国葡萄品种鉴定的可行性。
KASP技术的关键是在目标物种及其近似种中找到稳定且特异的SNP位点[6]。磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase,PEPC)是一种细胞质酶,是C4代谢和景天酸(CAM)代谢植物光合作用的关键酶,其主要功能是在Mg2+或Mn2+的辅助下,催化磷酸烯醇式丙酮酸(PEP)和HCO3-生成草酰乙酸(OAA)和无机盐酸盐(Pi)的不可逆反应[7]。磷酸烯醇式丙酮酸羧化酶广泛分布于古菌、细菌、蓝藻、绿藻、原生动物和植物中,在动物和真菌中不存在[8]。每个家族可包含1至多个基因成员,它们的序列在不同植物之间存在着一定的保守性[9]。笔者基于岩牡丹属PEPC序列,将KASP基因分型技术成功运用于岩牡丹属物种鉴定中,建立了黑牡丹与同属近似种类的分子鉴定方法。
1 材料与方法
1.1 试验材料
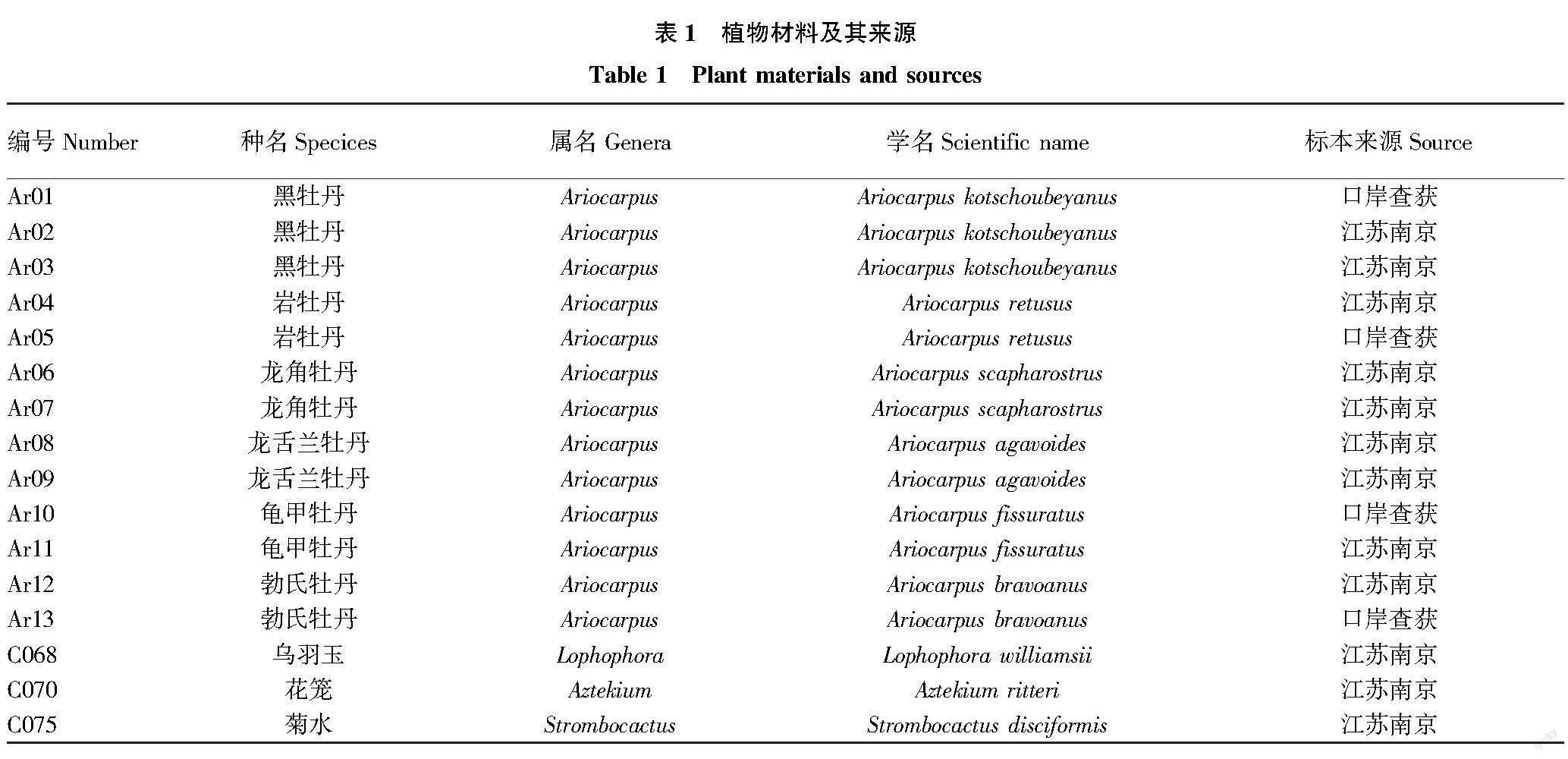
收集13份岩牡丹属及3份仙人掌科共16份试验材料。试验材料来自江苏南京(南京中山植物园)和海关口岸查获,均由相关专家鉴定,采集新鲜植物组织进行试验。样品信息见表1。
1.2 基因组DNA提取
先将供试样品进行表面消毒,用液氮将植物叶片研磨成粉,参照DNeasy Plant Mini Kit试剂盒说明书上的步骤方法,提取试验样品基因组DNA。提取基因组DNA置于4 ℃保存备用。
1.3 引物与探针设计
通过转录组测序数据分析筛选,克隆得到长度为679~1 079 bp的岩牡丹属PEPC序列。使用BioEdit软件比对6种岩牡丹属植物PEPC序列,发现黑牡丹与其他岩牡丹属植物相比较,存在稳定的SNP位点。根据黑牡丹特有SNP位点,按照LGC KASPgenotyping试剂盒的使用说明,结合引物设计软件Primer 5设计了特异性的黑牡丹KASP反应引物。PCC-A-kot-f1-1、PCC-A-kot-f1-2、PCC-A-kot-r1的序列分别为GGATTTCTCTTGAGCTGTGAC、GGATTTCTCTTGAGCTGTGAT和ACCCTATTACCTGACACCAT,扩增产物为61 bp。在2条正向引物序列的5′端加上FAM(5′GAAGGTGACCAAGTTCATGCT 3′)或HEX(5′GAAGGTCGGAGTCAACGGATT 3′) 荧光基团的接头序列。
1.4 反应体系与反应条件
将引物PCC-A-fis-f1-1、PCC-A-fis-f1-2、PCC-A-fis-r1浓度分别调整为36、36、90 μmol/L,并按体积比1∶1∶1配制成引物混合液。反应体系:取DNA(调整浓度为5 ng/μL) 5.00 μL,KASP master mix 5.00 μL,Primer mix 0.14 μL,使用PCR反应板进行KASP,每次反应2次重复;将5.00 μL模板DNA替换成5.00 μL 滅菌双蒸水作为阴性对照(NTC),操作步骤和反应条件与其他样品一致。反应条件参照KASP试剂盒说明书进行设置,简述如下:94 ℃预变性15 min;第1步扩增反应:94 ℃变性20 s,61~55 ℃梯度退火并延伸60 s(每个循环降低0.6 ℃),10个循环;第2步扩增反应:94 ℃变性20 s,55 ℃退火并延伸60 s,26个循环。
1.5 特异性测试
以16份供试样品的DNA为模板,利用引物混合液与所述试剂配置成反应液。按编号装入 96 孔PCR 板中,用于扩增检测在7500Fast上进行KASP反应,按照设定反应条件进行扩增,观察反应体系的特异性。
2 结果与分析
2.1 序列扩增和SNP位点标记
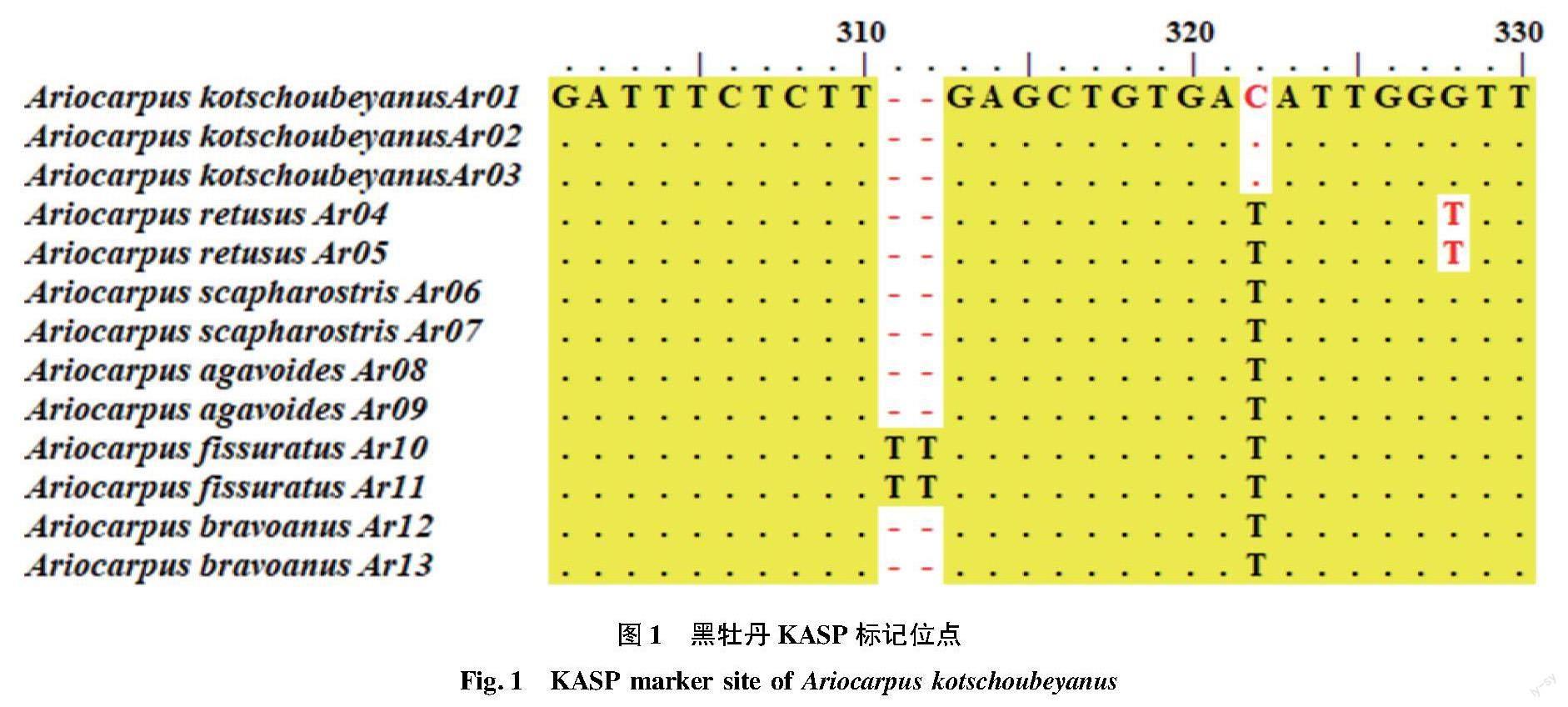
通用BioEdit软件比对分析岩牡丹属PEPC序列发现,3份黑牡丹样本在322 bp位点为胞嘧啶(C),其余岩牡丹属样本对应位点为胸腺嘧啶(T),具体信息见图1。
2.2 PEPC序列 黑牡丹PEPC序列长度为679 bp。序列中画横线的部分是引物区,红色标记的是黑牡丹的SNP位点,该试验以该SNP位点设计了黑牡丹KASP检测方法的特异性引物。
1 TGGATACTGA AACACTATCG ACTGCGACAA ATTTCATTTT GTTAATGGTC GAGAGAATTT
61 AAAGGAAGAT TTTCACATAT TGATAAGCTA AATCCCCTTT TTTCCATATC TGATGCGGTT
121 TTACATCAGA CCATAGATAG TATTTGACAG CTACGAAACT AATGGCTCAG TAATTTGTAT
181 TGGAACTGAA CAAGTGGGAC TCGTGTTTGG GGCGGGTCAG TTGCATTCAA ATTGAAGCCC
241 TCCACCAAGC TCATGAAGAA AATGAAGTGT GAGTCTTGTT GGTTGGGTTG GGTCAACTGG
301 ATTTCTCTTG AGCTGTGACA TTGGGTTTGG TTAAAGTATA TGGTGTCAGG TAATAGGGTA
361 CAATTTAGTC TTGCCAAACC AACCCACATT CTATTTCCTT CCAAGAATAA TTCAAATCAT
421 GAAATATCTC TACTACCTGC CCGAGTTCTA CAAAGTACAA ACCAAGTCCG ACTGACCTAA
481 ATTTCCATTG TATTTTTGCA GGTCGTCGGG CACAAGGAGC TGCTTGAAGG AGATCCTTAC
541 ATGAAACAGA GGCTCCATAT TCGAGATCCA TACCTTACAA TCCTTAATGT CTTCCAAGCA
601 AATACTCTCA AGCGTATTCG TGAGCCAAAC TTCCACGTAA CACAGAACCC ACGATCATCC
661 GAGGAAATAG CGGAATCCA
2.3 黑牡丹KASP特异性检测
应用设计的特异性引物,对16份样品DNA进行KASP反应,KASP分型结果见图2。结果显示,出现在X轴附近的红色圆点是黑牡丹的基因型,Y轴附近的绿色圆点是同属近缘种及花笼、菊水的基因型,坐标轴附近的蓝色圆点是乌羽玉的基因型,黑色标记是阴性对照。通过PEPC序列的SNP位点所设计的KASP引物可以形成明显的基因分型,准确鉴定黑牡丹,将其与同属近缘种及其他仙人掌科物种进行区分。
3 讨论
当前,SNP分子标记方法作为国际植物新品种权保护联盟(UPOV)BMT分子测试指南中构建DNA 指纹数据库和国内《植物品种鉴定DNA 指纹方法总则》(NY/T 2594—2016)中推荐的标记方法[10]。竞争性等位基因特异性PCR(KASP)技术是由英国LGC公司开发的新一代高通量自动化SNP检测技术,现已成为国际上SNP分型以及插入缺失变异检测的主要方法之一[11]。KASP技术只需合成2个带有不同颜色的荧光基团和双链通用的探针,不需要针对每个SNP位点分别设计荧光探针,具有高通量、准确、省时、便捷的特点,实现了更加灵活的检测,已成功应用于超过100余个物种的基因分型、遗传多样性分析、指纹图谱构建等方面[12]。
目前岩牡丹属的鉴定主要集中在形态学上,少有对岩牡丹属分子鉴定的研究。该研究将PEPC基因应用于植物物种资源鉴定,结果表明,设计的PEPC引物在岩牡丹属中具有100%的扩增效率和测序成功率,表现了良好的通用性。相比绿体序列matK[13]和psbA-trnH[14],PEPC序列具有更多的变异位点,更加适用于SNP分子标记方法和基因分型技术。该研究选择岩牡丹属PEPC序列上的SNP位点,基于KASP基因分型技术建立了黑牡丹的分子鉴定方法。该方法对濒危物种岩牡丹属黑牡丹的分型检测既准确又可靠,对其他种类的鉴定具有极高的参考价值。同时,相对于DNA条形码技术,KASP技术不需要DNA测序,大大缩短了检测周期,在物种鉴定上有很好的应用潜力,为海关口岸查验工作提供技术手段,也为濒危野生动植物保护提供技术支撑。
参考文献
[1]
VOVIDES A P,LUNA V,MEDINA G.Relación de algunas plantas y hongos mexicanos raros,amenazados o en peligro de extinción y sugerencias para su conservación[J].Acta botanica mexicana,1997(39):1-42.
[2]兑宝峰.黑牡丹与姬牡丹[J].园林,2004(9):36.
[3]BROCCANELLO C,CHIODI C,FUNK A,et al.Comparison of three PCR-based assays for SNP genotyping in plants[J].Plant methods,2018,14:1-8.
[4]钟婷婷,郭诗芬,卢文斌,等.甘蓝型油菜抗根肿病KASP标记开发和利用[J].华北农学报,2021,36(4):184-190.
[5]王富强,张建,温常龙,等.基于KASP 标记的葡萄品种鉴定[J].中国农业科学,2021,54(13):2830-2846.
[6]HU W,ZHOU T H,WANG P F,et al.Development of whole-genome agarose-resolvable LInDel markers in rice[J].Rice,2020,13(1):1-11.
[7]IZUI K,MATSUMURA H,FURUMOTO T,et al.Phosphoenolpyruvate carboxylase:A new era of structural biology[J].Annual review of plant biology,2004,55:69-84.
[8]O′LEARY B,PARK J,PLAXTON W C.The remarkable diversity of plant PEPC(phosphoenolpyruvate carboxylase):Recent insights into the physiological functions and post-translational controls of non-photosynthetic PEPCs[J].The biochemical journal,2011,436(1):15-34.
[9]WANG X Y,GOWIK U,TANG H B,et al.Comparative genomic analysis of C4 photosynthetic pathway evolution in grasses[J].Genome biology,2009,10(6):1-18.
[10]WEI Z Y,LI H H,LI J,et al.Accurate identification of varieties by nucleotide polymorphisms and estab-lishment of scannable variety IDs for soybean germplasm[J].Acta agronomica sinica,2018,44(3):315-323.
[11]SEMAGN K,BABU R,HEARNE S,et al.Single nucleotide polymorphism genotyping using Kompetitive Allele Specific PCR(KASP):Overview of the technology and its application in crop improvement[J].Molecular breeding,2014,33(1):1-14.
[12]王富強,樊秀彩,张颖,等.SNP分子标记在作物品种鉴定中的应用和展望[J].植物遗传资源学报,2020,21(5):1308-1320.
[13] CUNOUD P,SAVOLAINEN V,CHATROU L W,et al.Molecular phylogenetics of Caryophyllales based on nuclear 18S rDNA and plastid rbcL,atpB,and matK DNA sequences[J].American journal of botany,2002,89(1):132-144.
[14]HAMILTON M B.Four primer pairs for the amplification of chloroplast intergenic regions with intraspecific variation[J].Molecular ecology,1999,8(3):521-523.

