含有5-氟尿嘧啶的多金属氧酸盐的合成及抗癌活性
杜少辉,刘海彬,王雨晴,王喜乐,吴庆银,李增强
(1. 辽宁科技学院生物医药与化学工程学院,辽宁 本溪 117004;2. 浙江大学化学系,浙江 杭州 310027;3. 沈阳药科大学生命科学与生物制药学院,辽宁 沈阳 110016)
氟尿嘧啶(5-Fu)作为首选抗代谢药物,对多种肿瘤有较好的疗效。 但由于代谢显著及亲脂性低,5-Fu 的生物利用率低,且其治疗剂量与中毒剂量接近,在低浓度时达不到有效抗肿瘤的作用,而高浓度时又会增加诸多不良反应, 使临床应用受到一定限制[1-3]。为了克服临床应用存在的副作用,近年来,人们从多方面修饰5-Fu,取得了一定成果[4-7]。 多金属氧酸盐的极性、氧化还原电势、表面电荷分布、形状及酸度等一系列理化性质是其具有药学活性的基础,在抗病毒、抗肿瘤等方面引起人们的广泛重视[8-9]。文章以具有抗癌活性的5-氟尿嘧啶作为有机分子给体,借助分子自组装,合成了两种新的Keggin 型多金属氧酸盐——硅钨酸5-氟尿嘧啶盐(FSiW)和锗钨酸5-氟尿嘧啶盐(FGeW),并通过体外实验测定了该化合物的抗癌活性, 发现5-Fu 与杂多酸反应合成的FSiW 和FGeW 具有较高的抗癌活性。
1 实验部分
1.1 试剂与仪器
WQF-510 傅立叶变换红外光谱仪;Bruker avance 500 MHz 核磁共振仪;TU-1901 双光束紫外可见分光光度计;日本精工株式会社6300 型热重分析仪;日本理学公司D/max RB 型X 射线衍射仪。所有试剂均为分析纯。
1.2 杂多酸5-氟尿嘧啶盐的合成
锗钨酸的合成: 称取1.0 g 二氧化锗和0.84 g氢氧化钠,将二氧化锗加至氢氧化钠溶液中,搅拌生成锗酸钠。 称取33.7 g 钨酸钠,加入适量水溶解后倒入锗酸钠溶液中,80 ℃下调节溶液pH 值到0.5,反应1 h。 加入15 mL 乙醚,并逐滴加入浓盐酸(约5 mL)萃取三次,合并有机相,在40 ℃水浴上蒸醚,自然干燥得到乳白色固体粉末即为锗钨酸。
杂多酸5-氟尿嘧啶盐的合成: 取一定量的5-氟尿嘧啶,用1 mol/L HCl 溶解。 将等摩尔比的杂多酸溶于适量水中,向其中加入质子化的5-氟尿嘧啶溶液,于70 ℃下搅拌4 h,室温下放置1 天,黄色晶体析出, 分别得到C4H4FN2O2H3SiW12O40·5H2O(FSiW)和C4H4FN2O2H3GeW12O40·8H2O (FGeW)。
1.3 药液配制
化合物FSiW、FGeW 和5-Fu 用无血清的培养液配制成浓度为81 μM、27 μM、9 μM、3 μM、1 μM、0.33 μM、0.11 μM、0.035 μM、0.012 μM、0.004 μM的10 种药液(相邻浓度比均为3∶1)。
1.4 细胞、细胞培养及操作过程
实验所用细胞为人胃腺癌细胞 (SGC-7901)和人肝癌细胞(HepG2)。将对数生长期的细胞用0.25%胰酶消化后,离心去除胰酶,用10% FBS 培养液配制成细胞悬液接种至96 孔板中,每孔180 μL,接种密度4×103个/孔,于37 ℃下,在含5% CO2的饱和湿度的培养箱中孵育24 h。 加药完毕放入培养箱中孵育72 h 后进行检测,取出96 孔板,将其中的MTT溶液轻轻甩出后每孔加150 μL DMSO,在微量振荡仪上振荡5 min 以使甲瓒完全溶解,用酶标仪在492 nm下测光密度(OD)值,并记录。最后,按如下公式计算细胞体外增殖的抑制率(Inhibition Rate,IR):其中,ODControl代表未加药孔的OD 值;ODSample代表加药孔的OD 值;ODBlank代表只加DMSO 孔的OD 值。
2 结果与讨论
2.1 红外光谱
用KBr 压片,在σ 为400 cm-1~4 000 cm-1范围内测定了FSiW 和FGeW 的红外光谱,如图1 所示。在700 cm-1~1 000 cm-1范围内出现了4 个特征吸收峰,且峰位相近,说明其仍保持Keggin 结构。与母体杂多酸的红外光谱相比,FSiW 的W=Od和W-Oc-W振动峰向低波方向移动,FGeW 的Ge-Oa、W=Od、W-Ob-W 和W-Oc-W 振动峰都向低波方向移动,说明与5-Fu 之间存在相互作用。 图谱中的1 679(FSiW)和1 683(FGeW)谱带归属为5-Fu 环的C=O,1 251 归属为C-F 的伸缩振动。 受到多酸阴离子的影响,5-Fu 的电荷密度降低, 导致特征峰向高频移动[10]。
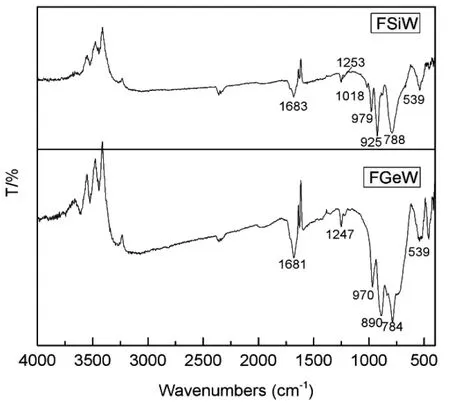
图1 FSiW 和FGeW 的红外光谱
2.2 紫外光谱
FSiW 和FGeW 的紫外可见吸收光谱见图2。 从图中可以看出,FSiW 和FGeW 分别在192 nm 和264 nm(260 nm)处有两个吸收谱带,192 nm 的吸收峰对应于Od-W 之间的荷移跃迁,264 nm(260 nm)的吸收峰归属于Ob,Oc-W 的荷移跃迁,它们为POM的特征吸收峰[11]。
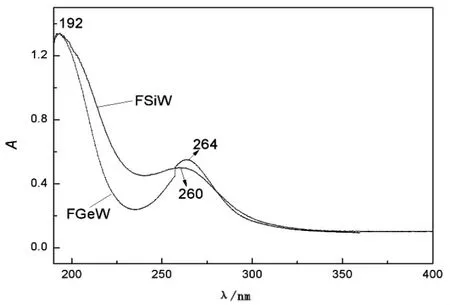
图2 FSiW 和FGeW 的紫外光谱
2.3 1H NMR 核磁共振谱
FSiW 和FGeW 的1H NMR 核磁共振谱如图3所示。谱图中在化学位移分别为7.73 和7.71 处出现双重峰,这是由于氟原子影响了嘧啶环上的C-H 的共振吸收峰,使其发生分裂导致的。 与5-Fu 相比,由于多酸阴离子的去屏蔽效应使嘧啶环上的质子的化学位移向低场移动。
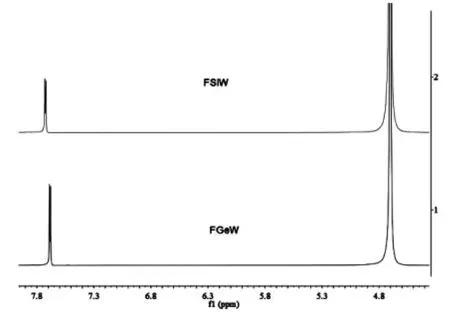
图3 FSiW 和FGeW 的1H NMR 核磁共振谱
2.4 X 射线粉末衍射
采用Cu 靶,Kα 辐射(λ=0.154 18 nm)管流:100 mA, 采用连续扫描方式, 步长0.02°, 扫描速率6°(2θ)/min,对FSiW 和FGeW 进行了XRD 表征,谱图见图4。 与Keggin 型H4SiW12O40和H4GeW12O40谱图相比,FSiW 和FGeW 的2θ 值有显著差别, 表明FSiW 和FGeW 与母体酸有不同的晶体点阵结构。对于FSiW, 在2θ 值为8.26°、15.90°、18.62°、26.54°和28.56°位置出现了与H4SiW12O40相对应的衍射线,表明FSiW 具有Keggin 结构,与红外光谱的结论一致。在16.64°、27.44°和33.44°位置出现了与5-Fu 相对应的衍射线, 表明5-Fu 已与母体酸H4SiW12O40键合[12]。 从谱图4 可以看出,FGeW 与FSiW 的衍射线极为相似,证明5-Fu 与H4GeW12O40也发生了键合。
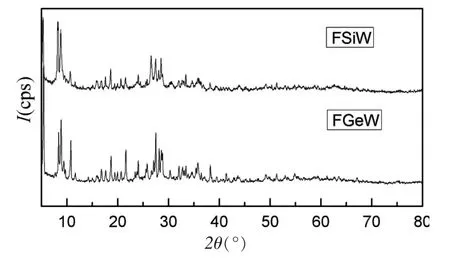
图4 FSiW 和FGeW 的XRD 图谱
2.5 热重分析
为了表征配合物FSiW 和FGeW 的热稳定性,对其进行了热重分析测试, 图5 为配合物的TG 曲线。从TG 曲线可以看出,FSiW 和FGeW 的热分解过程比较相似, 均可以分为三个步骤: 以FSiW 为例,第一步, 从25 ℃~243.3 ℃的损失是结晶水( TG =2.67% ) ,第二步,发生在243.3 ℃~422.6 ℃此范围的失重可归因于5-Fu 的分解,第三步,从422.6 ℃~800 ℃,该范围的失重可能是化合物的Keggin 结构发生分解所致。
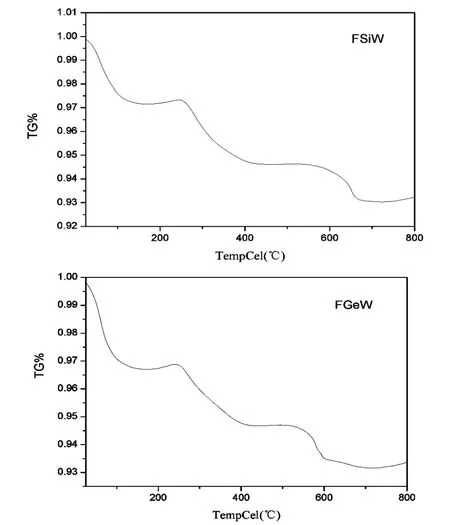
图5 FSiW 和FGeW 的TG 图谱
2.6 目标化合物的体外抗癌活性
采用MTT 比色实验测试了目标化合物对人胃腺癌细胞SGC-7901 和人肝癌细胞HepG2 的体抗癌活性, 以5-氟尿嘧啶 (5-Fu) 作为阳性对照品,实验结果见表1。
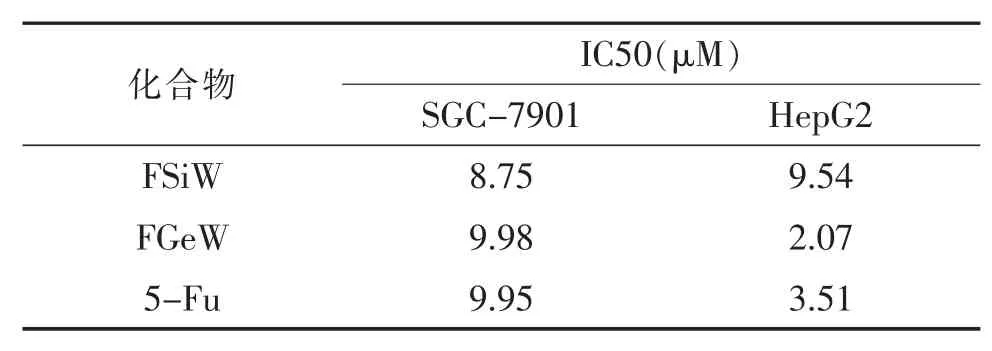
表1 目标化合物对SGC-7901 细胞和HepG2 细胞的IC50
由表1 可知, 所合成的化合物对两种人癌细胞的体外生长显示出不同的抑制作用。 对于人胃腺癌细胞SGC-7901,两种化合物和阳性对照药5-Fu 具有相似的抑制活性。 对于人肝癌细胞HepG2,FSiW的抑制活性要低于5-Fu,而FGeW 的抑制活性要高于5-Fu。
3 结论
本实验合成了两种Keggin 型多金属氧酸盐—硅钨酸5-氟尿嘧啶盐(FSiW)和锗钨酸5-氟尿嘧啶盐(FGeW),通过1H NMR、IR、XRD 和TG-DTA 对其结构进行了的表征。 通过体外实验测定了该化合物的抗癌活性, 发现5-Fu 与杂多酸反应合成的FSiW 和FGeW 具有较高的抗癌活性。

