植物中甜菜色素的研究进展
黄 晨 ,张 威 ,任红旭
(1 中国科学院 西北生态环境资源研究院,沙漠与沙漠化重点实验室,兰州 730000;2 中国科学院 植物研究所,北方资源植物重点实验室,北京 100093;3 中国科学院大学 资源与环境学院,北京 100049;4 国家植物园,北京 100093;5 中国科学院大学 现代农业科学学院,北京 100049)
甜菜色素、花青素、叶绿素和类胡萝卜素并称为四大类天然植物色素。相较于其他三类分布广泛且较为常见的色素,甜菜色素在自然界中分布范围狭窄,仅存在于石竹目(Caryophyllales)[石竹科(Caryophyllaceae)和粟米草科(Molluginaceae)除外]中。常见的积累甜菜色素的植物主要有藜科碱蓬属盐地碱蓬(Suaedasalsa)、苋科苋菜属雁来红(Amaranthus mangostanus)、仙人掌科火龙果(Hylocereusundatus)、商陆科美洲商陆(Phytolaccaamericana)等[1]。除被子植物外,在真菌谱系中的担子菌门和细菌谱系中的某些重氮营养型葡萄糖酸菌中也存在甜菜色素[2]。
甜菜色素因最早在甜菜(Betavulgaris)根中发现而得名,是一种具有生物活性的水溶性含氮色素,在酸性条件下较为稳定,碱性和高温环境下不稳定,耐氧化和还原能力差。甜菜色素的稳定性受酸碱度、光、热、氧化剂、酶和金属离子等多种因素的影响[3]。甜菜色素主要分为以糖苷化为辅基类型的甜菜红素和以氨基酸为辅基类型的甜菜黄素[4]。甜菜红素的吸收光谱为532~550 nm,甜菜黄素的吸收光谱为457~485 nm,甜菜醛氨酸作为最重要的中间产物,参与这2种色素的生物合成。截至2021年,已从17科植物中鉴定出50多种甜菜红素和31种甜菜黄素[5]。
由于甜菜色素生物合成途径独特,且与花青素互斥,因此甜菜色素作为一种重要的化学分类指标,在植物进化和分类研究中极具科学价值,已逐渐成为新的研究热点,且近年来已取得多项重要研究进展[6-9]。鉴于国内学者对甜菜色素的理化性质、生物合成、生物学功能及利用等方面已进行了详细的综述[4,10-11],而对甜菜色素和花青素的关系以及光照对甜菜色素生物合成影响的分析还较少,因此,本文拟从甜菜色素的生物合成及转录调控出发,重点阐述光对甜菜色素生物合成的影响以及甜菜色素和花青素的关系,并对国内外的最新研究进展进行综述和展望,以期为更好地研究和开发利用甜菜色素提供思路。
1 甜菜色素的生物合成及调控
1.1 甜菜色素的生物合成途径
植物体内游离酪氨酸是甜菜色素的合成前体。在酪氨酸酶羟化活性的作用下,酪氨酸首先被转化为L-多巴,之后4,5-多巴双加氧酶催化L-多巴氧化裂解形成4,5-开环多巴,4,5-开环多巴经过自发的分子内缩合反应生成关键的中间产物——甜菜醛氨酸[12]。同时,L-多巴在酪氨酸酶氧化活性的作用下被氧化为多巴醌,多巴醌环化形成闭环多巴,L-多巴也可在细胞色素P450 基因CYP76AD1的催化下直接产生闭环多巴。闭环多巴与甜菜醛氨酸结合最终形成甜菜红素,甜菜醛氨酸也可与氨基酸或胺结合生成甜菜黄素[13](图1)。
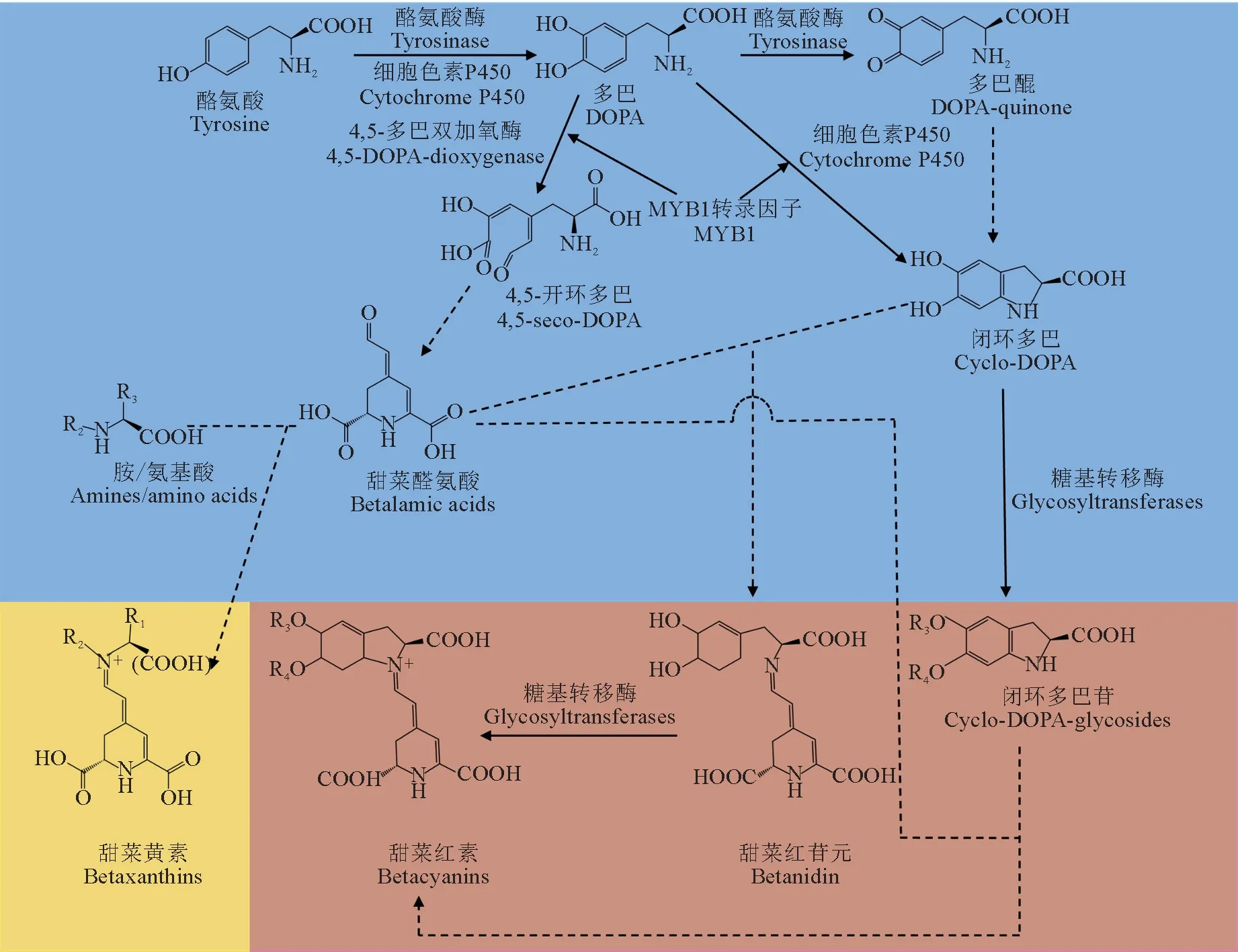
图1 甜菜色素生物合成途径[14]Fig.1 The betalain biosynthetic pathway[14]
由于在甜菜色素植物中CYP76AD1催化L-多巴所形成的闭环多巴比氨基酸更易与甜菜醛氨酸结合,因此在甜菜色素植物中存在的主要是甜菜红素而非甜菜黄素[10]。
1.1.1酪氨酸羟基化和L-多巴氧化
酪氨酸羟基化形成L-多巴是甜菜色素生物合成的第一步,之后L-多巴转化为环多巴,这两步反应通常被认为是由酪氨酸酶催化的。酪氨酸酶是一种具有单酚和双酚双重氧化活性的酶,可催化单酚羟基化为二酚,再将二酚氧化成醌,在大花马齿苋(Portulacagrandiflora)、甜菜和盐地碱蓬等植物中都已检测出酪氨酸酶的活性。然而,对于酪氨酸酶在甜菜色素合成中的作用近年来也颇有争议:首先,酪氨酸酶参与甜菜色素的生物合成尚未在基因水平上得到证实;其次,细胞内酪氨酸酶的定位和甜菜色素的合成位置不同,酪氨酸酶通常定位于质体中,而甜菜色素的合成则是在细胞质中;此外,红甜菜中细胞色素P450 酶基因CYP76AD1的发现则让酪氨酸酶的作用更加充满争议。研究证明,在甜菜色素合成过程中,CYP76AD1不仅是L-多巴转化为环多巴所必需的,而且也催化着酪氨酸羟基化形成L-多巴的反应。在添加酪氨酸的酵母细胞培养液中单独表达重组CYP76AD1会造成L-多巴的积累,其积累水平约为单独表达重组AbPPO2的20倍[15],当与紫茉莉DODA(MjDODA)共表达时,能够产生甜菜红素。另外,在对不同颜色的苋菜(AmaranthustricolorL.)品种进行比较转录组分析时也发现,苋菜AmCYP76AD1的高表达是影响甜菜色素积累的关键因素[16];因此,酪氨酸酶在甜菜色素生物合成途径中的作用还有待于进一步研究。
1.1.2甜菜醛氨酸形成
甜菜醛氨酸是所有甜菜色素的基本生色团,由4,5-开环多巴经过自发的分子内缩合反应生成。4,5-多巴双加氧酶(4,5-DOPA dioxygenase,DODA)是一种含铁蛋白质,催化L-多巴形成中间体4,5-开环多巴,该反应是最终形成甜菜醛氨酸的关键步骤。编码4,5-多巴双加氧酶的基因最初从毒蝇伞(Amanitamuscaria)的cDNA 文库中克隆得到,在大花马齿苋中首先被鉴定,之后在紫茉莉(Mirabilisjalapa)、仙人掌(Opuntiadillenii)和盐地碱蓬中也陆续得以鉴定。Sasaki等[17]在大肠杆菌中成功表达了来源于紫茉莉的4,5-多巴双加氧酶MjDODA基因,证实该酶在体外也具有生物活性,从而实现甜菜醛氨酸的体外合成。而一些来源于非甜菜色素植物的4,5-多巴双加氧酶尽管在体外也表现出了活性,却无法合成甜菜色素,究其原因可能是这些植物体中缺乏L-多巴的存在。
1.1.3甜菜色素生物合成途径中的糖基化和酰基化
甜菜红素的合成过程较甜菜黄素复杂,需要经过糖基化和酰基化过程。甜菜红素的糖基化主要有2种方式:(1)酪氨酸通过多巴黄质、多巴黄质醌等中间产物生成甜菜红苷元,之后在葡糖基转移酶的作用下在甜菜红苷元的C-5 或者C-6 位上连接糖基,形成甜菜红苷或千日红苷等甜菜红素;(2)闭环多巴先进行糖基化形成闭环多巴苷,闭环多巴苷再与甜菜醛氨酸缩合生成甜菜红素[18]。目前尚不清楚上述哪条途径在石竹目植物中更为普遍,以及这2种方式在同一物种中是如何共存的。糖基转移酶(GTs)是一类催化特定糖基和受体之间形成特定糖苷键的多成员转移酶家族[19],在番杏科植物彩虹菊(Dorotheanthusbellidiformis)中首先克隆出了5-O-葡糖基转移酶基因,随后又克隆到6-O-葡糖基转移酶基因,其序列与5-O-葡糖基转移酶基因完全不同,而与花青素葡糖基转移酶基因的序列则非常相似,这进一步说明二者在糖基化过程中各自独立发挥作用。甜菜红素的结构复杂性除了来源于糖基化反应外,还与合成过程中的多种酰基化反应有关。目前已在石竹目至少4个科中发现酰基化的甜菜色素,所连接的取代基包括水杨基、丙二酰基、3-羟基-3-甲基戊二酰基和最常见的羟基肉桂酰基等。
1.2 甜菜色素生物合成途径的转录调控
早在2009 年,Takahashi等[20]便在美洲商陆(P.americana)DODA基因的启动子区域发现多个MYB、bHLH 以及逆境响应转录因子的结合位点。之后,通过与花青素MYB 转录因子进行同源性分析,在甜菜(糖用甜菜)中也推定出2个与甜菜色素合成调控相关的R2R3 型MYB 转录因子,分别定位于2号染色体的R位点附近[21]。与此同时,Hatlestad等[6]也报道了甜菜中位于2号染色体Y位点的MYB转录因子BvMYB1,并证实BvMYB1是甜菜中甜菜色素生物合成的正调控因子,它通过直接结合甜菜中的细胞色素P450 基因BvCYP76AD1和4,5-多巴双加氧酶基因BvDODA1各自的启动子区域而将其激活。进一步研究发现BvMYB1和花青素相关MYBs具有高度的序列相似性,二者的时空表达模式也极为相似,这些都意味着BvMYB1极有可能是从古老的调控花青素合成的MYB转录因子进化而来。除BvMYB1外,在苋菜中也克隆到与甜菜色素生物合成相关的R2R3型MYB转录因子基因AmMYB1[8]。最近,在火龙果中也发现了一类属于1R-MYB 亚家族的R-R 型转录因子HuMYB132,它通过调控HuCYP76AD1-1和HuDODA1基因的表达,正向调控火龙果中甜菜色素的合成[22]。有趣的是,甜菜色素MYB对色素的作用方式与花青素MYB不同,花青素R2R3-MYB在R3结构域内含有1个与bHLH 蛋白互作的(D/E)Lx2(R/K)x3Lx6Lx3R 基序,通过与bHLH、WD40互作共同调控花青素的合成[6],而BvMYB1、Am-MYB1由于bHLH 基序中的结合位点发生突变,从而不能与MYB-bHLH-WD 复合体中的异源bHLH互作,进而阻碍了花青素的正常合成,以致无法合成花青素。近来,在火龙果中发现,转录因子HubHLH159可能参与调控甜菜色素的生物合成,它能够通过激活HuADH1,HuCYP76AD1-1和HuDODA1基因的表达而促进甜菜色素的合成,这一发现为进一步分析HubHLH基因家族的功能提供了重要依据。然而HubHLH159在甜菜色素生物合成中的调控机制以及与其他转录因子之间的互作关系尚有待于进一步研究[23]。此外,在火龙果中还发现了1种新的WRKY 转录因子HmoWRKY40,在火龙果着色过程中HmoWRKY40的表达水平和甜菜色素含量均迅速上升。HmoWRKY40能够结合并激活HmoCYP76AD1的启动子,参与火龙果中甜菜色素的生物合成[24]。
除上述提到的甜菜色素合成相关转录因子之外,研究显示可能还有更多的表观遗传因子也参与了甜菜色素的合成调控。例如,在紫茉莉的研究中发现其红黄杂色品种的花色是由转座因子dTmj1的活性决定的。转座因子dTmj位于紫茉莉花瓣中细胞色素P450基因CYP76AD3的内含子中,形成的CYP76AD3:dTmj1是一种可变基因,该基因在dTmj1切除和转座后能够恢复功能,从而导致花瓣的黄色背景上形成红色斑点[25],该研究说明某些转座子可能也对甜菜色素的合成起到调控作用。
1.3 甜菜色素的分解代谢
对于参与甜菜色素分解代谢的基因迄今所知甚少。已知光、氧气、pH 和高温等各种非酶促因子均可促进甜菜色素降解,甜菜红素比甜菜黄素更容易被过氧化物酶降解,而甜菜黄素更易于被过氧化氢氧化[13]。研究发现,过氧化物酶、葡萄糖苷裂解酶和多酚过氧化物酶可通过协同作用使甜菜色素降解[14]。
2 光照对甜菜色素生物合成的影响
光作为重要的环境信号之一,能够触发植物色素合成等生理过程。对于光照影响甜菜色素合成代谢的机制目前还所知甚少。由于甜菜色素和花青素在植物体内的功能及分布具有一定相似性,因此认为二者对于光以及其他环境信号的响应机制是保守进化的。鉴于2种色素合成过程中某些调控成分具有明显差别,因此进一步研究光照以及光照与关键内源和外源因子(如激素和温度)相互作用对甜菜色素合成的影响是非常有必要的,这将为深入解析光照调控甜菜色素生物合成的分子机制奠定基础[26]。
2.1 光质和光强对甜菜色素生物合成的影响
2.1.1光强
在籽粒苋(Amaranthussp.)幼苗中首次证明了甜菜色素浓度受光信号的调控[27]。尽管目前普遍认为光照对于植物中甜菜色素的积累具有正调控作用,但是其在甜菜色素合成中的必要性仍存在争议。Wohlpart和Mabry[28]比较了几种不同植物2~3周幼苗在白光和黑暗条件下甜菜色素的积累情况,认为光并不是甜菜色素合成的必要条件;Wang等[29]在盐地碱蓬幼苗中也发现,萌发期保持黑暗对于甜菜色素的积累至关重要,而光照促进甜菜色素降解,且这种响应与光照下酪氨酸酶的降解和失活有关。然而,对盐地碱蓬愈伤组织的研究则显示了不同结果:白光或光合有效光谱中不同波长的光均可显著诱导甜菜红素的积累,这种效应与4,5-多巴双加氧酶mRNA 水平的上升以及酪氨酸酶羟化、氧化活性的增加[30]相一致。此外,暗处理导致甜菜和大花马齿苋愈伤组织中甜菜红素降解[31],却有利于红叶藜(Oxybasisrubra)愈伤培养物中甜菜红素的积累[32]。综上所述,甜菜色素合成对于光的需求可能因植物组织和物种不同而有所不同。
2.1.2光质
研究表明,光对甜菜色素的诱导作用也受光质和物种差异的影响,不同植物中不同光质对甜菜色素的合成影响不同。用红光照射红心火龙果(Hylocereuscostaricensis)时发现,红光能够显著提高其愈伤组织中甜菜红素和甜菜黄素的含量[33];对苋菜的研究表明,黑暗不利于苋菜萌发期甜菜色素的合成,白光对于甜菜色素的合成和积累效果最佳,蓝光次之[34];王晓[35]用蓝光和蓝红复合光处理苋菜幼苗,发现苋菜幼苗中甜菜红素和甜菜黄素的含量均随蓝光光强的增加而增加,且蓝红复合光中高比例的蓝光更容易诱导甜菜红素合成;马冰雪等[36]用红光、绿光和蓝光分别照射甜菜幼苗,结果表明蓝光有利于甜菜色素积累,绿光下甜菜色素含量明显下降,红光下甜菜红素含量降至各处理最低,这一研究说明短波长光质更易诱导产生甜菜红素,张媛媛等[37]用蓝光处理苋菜愈伤组织也得到了相同结果。然而,在盐地碱蓬幼苗中则有不同报道:黑暗处理显著促进了盐地碱蓬幼苗子叶中甜菜红素的积累,而蓝光照射强烈降低了黑暗中所积累的甜菜色素含量[38]。进一步的研究显示,蓝光下盐地碱蓬中甜菜红素含量下降是由酪氨酸酶失活造成的,而酪氨酸酶的失活与蓝光受体CRY2蛋白的降解有关。
UV 辐射也被证明对甜菜色素的合成具有促进作用。对灰藜(ChenopodiumalbumL.)细胞培养物分别进行UV、蓝光、白光、红光和黑暗处理,其中仅UV 和包含UV 光质的蓝光和白光能够诱导甜菜红素的形成,而不具有UV 特性的光照则不能诱导甜菜红素形成;将灰菜细胞培养物在UV 照射下形成的红色细胞团转移到红光和黑暗环境下,细胞中所积累的甜菜红素发生降解[39];过滤去除UV-B后,尾穗苋(Amaranthuscaudatus)幼苗中甜菜红素的合成受到抑制[40];单独用UV-A 照射可以诱导冰叶日中花(MesembryanthemumcrystallinumL.)叶片囊泡中积累甜菜红素,表明甜菜红素可能作为紫外线过滤器以保护植物免受紫外线的伤害[41]。
2.2 光和植物激素在甜菜色素合成中的相互作用
研究表明,光和植物激素可以相互作用影响甜菜色素的合成。如在酪氨酸存在的情况下对黑暗中生长的雁来红幼苗施以激动素,能够模拟白光处理所达到的效果,提高植物中甜菜红素的含量[42];生长在蒸馏水中的尾穗苋幼苗,无论是在黑暗还是光照下都只能合成苋菜红素,而当激动素和白光两者同时具备时,甜菜红素也能被诱导出来,再添加多巴底物又能进一步诱导出甜菜黄素[43],说明光和激动素可以共同作为甜菜红素和甜菜黄素合成的正调控因子;黑暗下对盐地碱蓬愈伤组织和苋菜幼苗施以6-BA 也能显著提高甜菜红素含量,且甜菜红素含量与4,5-多巴双加氧酶基因DODAmRNA 的表达水平呈正相关[44]。
UV-B也能够和激素共同作用调控甜菜色素的合成。研究表明,高强度UV-B 辐射能刺激植物合成乙烯,而用乙烯利处理红甜菜植株可使其甜菜色素含量增加,且与BvMYB1、BvCYP76AD1、BvCYP76AD5、BvCYP76AD6、BvDODA1等基因表达水平的上升相一致。在该试验系统中,对红甜菜叶面喷施乙烯利并在收获后短时照射UV-B可以提高甜菜中甜菜红素与仙人掌黄素的比值[45]。SA 和JA 这2种植物激素也受UV-B诱导,并且对甜菜色素的合成具有促进作用[46]。然而,尽管以上结果说明UV-B促进甜菜色素的合成可能是通过激素调节的,但相关证据还不够充分,因而通过更加有效的实验方法以证明UV-B、激素和甜菜色素合成之间的直接联系是非常有必要的。
2.3 光和温度在甜菜色素合成中的相互作用
光照和温度在甜菜色素的合成中也具有交互作用。Elliott的研究[47]显示,在给予一定时间的红光照射之前,先在40 ℃高温下对苋菜幼苗进行预处理,可使其积累较多甜菜红素,而在40 ℃处理之前用红光照射则不具有这种效果。将苋菜幼苗置于40 ℃下2 h后,转移到25 ℃下培养1 h,之后给予红光照射,此时甜菜红素的积累量达到最大。如果从25 ℃再次转回40 ℃,甜菜色素的合成则受到抑制。对此,推测认为当温度升高到40 ℃时,一些能够使光敏色素充分表达的必需活性成分会被诱导形成,为了使这些活性成分最大程度合成或发挥活性,在照射红光之前,幼苗需先在较低温度下保持1~2 h。由此可见,光照对甜菜色素的诱导作用也依赖于温度的变化。此外,在拟南芥(Arabidopsisthaliana)中已经证明,光敏色素phyB以温度依赖的方式与调控花青素合成的关键靶基因的启动子直接结合。暖温有利于黑暗条件下植物体内光敏色素活性形式(Pfr)向非活性形式(Pr)转换,并抑制特异性光敏色素相互作用因子(PIF)的降解,从而使下游靶基因得以表达[48]。
关于UV-B、温度和甜菜色素合成之间的直接联系目前鲜见报道,但在花青素植物中已经证明UV-B和温度协同作用,共同影响花青素的生物合成。UVR8是植物感知UV-B 辐射的特异性受体,UV-B辐射下,UVR8构象发生变化,从二聚体转化为单体,进而能够与E3-泛素连接酶COP1互作,阻止花青素合成的正调控转录因子HY5被泛素化降解[49]。Kim 等[50]研究发现高温能够促进HY5 降解继而抑制花青素合成。此外,拟南芥中UVR8二聚体/单体比例的动态变化受UV-B 和温度的共同调控,低温下UVR8再二聚体化的速率会降低[51];在葡萄(Vitisvinifera)等其他花青素植物中也发现UVR8的表达受环境温度的影响[52]。基于以上在花青素植物中的研究结果,笔者推测在甜菜色素的生物合成中,光和温度也具有类似的协同调控作用,对此需通过更进一步深入研究来加以确认。
2.4 光照调控甜菜色素生物合成的可能机制
尽管对甜菜色素生物合成途径上游的调控事件目前还所知甚少,但在甜菜色素植物中发现的与花青素途径共有的MYB 转录因子,意味着这2种色素合成的调控机制可能是保守进化的。因此,已经阐明的花青素合成代谢机制可以为甜菜色素代谢调控研究提供重要借鉴。如前所述,UV-B 通过不同机制调控植物合成光保护色素,其中HY5 等多个转录调控因子发挥了重要作用。除了E3-泛素连接酶COP1之外,HY5的表达水平还受到其他光响应因子的调节,例如特异性光敏色素相互作用因子PIFs 1 和PIFs 3,以 及B-Box 蛋 白(BBXs)[53]等。其间,HY5是众多光信号转导通路的交汇点,调控着植物光信号响应基因的表达。
对拟南芥的研究表明,除了HY5 之外,MYB转录因子家族的其他成员也参与调控拟南芥中的色素合成。拟南芥中的MYB 转录因子AtMYB4 可以抑制具有光保护作用的苯丙素类色素的合成[54],过表达该转录因子可以抑制查尔酮合成酶基因的表达,表明AtMYB4 参与了花青素的合成调控。此外,光通过激活HY5来阻止转录抑制因子AtMYB2的表达,从而促进了花青素的合成。同时,光还诱导了miR858a的表达,miR858a能够依赖于HY5 的存在而在翻译水平上对MYB2进行抑制[55]。序列对比分析结果表明,这些转录因子的同源基因在石竹目植物中是保守进化的。对藜麦DODA和CYP76AD1的启动子进行分析,发现在藜麦中存在拟南芥中MYB4 和HY5 的结合位点[56]。最近在苋菜[7]和火龙果[57]中也证实有miR858a的表达,进一步证明miR858a可能参与调控甜菜色素合成。利用生物信息学技术对miRNA 目标序列进行预测,发现其目标序列也保守存在于甜菜色素类植物(如甜菜、藜麦、菠菜等)的MYB4mRNA 阻遏蛋白的编码区中。
如2.2节所述,细胞分裂素和光相互作用调控甜菜色素的合成,然而其中的分子机制尚不清楚,相关研究还鲜见报道。在拟南芥中,细胞分裂素受体AHK2、3和4以及B型反应调节因子ARR1、10和12以冗余方式参与光诱导的花青素合成[58]。其中,细胞分裂素的作用部分依赖于光敏色素和隐花色素下游组分HY5,主要依赖于光合电子传递产生的信号,且进一步发现细胞分裂素有助于抑制转录因子MYB2 的表达。以往的研究表明,磷脂酰肌醇-4,5-二磷酸(PIP2)依赖的非α-磷脂酶D(phospholipase D,PLD)的激活是细胞分裂素信号转导途径的早期事件之一。PLD 是一种磷酸二酯酶,可水解磷脂产生磷脂酸(phospatidic acid,PA),PA 可作为多种环境和内源性信号通路的第二信使[59]。尽管PA 的互作元件和作用模式尚不明确,但通过激活PLD 而使PA 水平发生改变可能介导着细胞分裂素诱导的甜菜色素合成。因此,在未来的研究中,通过对DODA和CYP76AD1等基因以及关键转录调控因子MYB1进行序列分析推测PA 可能存在的结合位点,进而阐明PA 在甜菜色素合成调控中的作用,将会是一个有趣的研究方向。
综上所述,目前对于光调控甜菜色素生物合成的分子机制还所知甚少,对于相关机制的推定大多来源于花青素植物的研究。然而,光信号生理和转录调控机制的阐明、甜菜色素生物合成关键基因的鉴定以及石竹目代表性物种中的生物信息学分析,这些研究工作都已提供了非常有力的支持和证据,有助于在不远的未来深入解析光信号调控甜菜色素生物合成的分子机制。
3 甜菜色素在植物中的作用
3.1 甜菜色素与花青素的关系
花青素和甜菜色素互斥,迄今尚未在自然界的任何一种植物中发现二者同时存在。然而合成花青素的前体物质之一——对香豆酰CoA,是由苯丙氨酸在苯丙氨酸裂解酶(PAL)的作用下生成的,而合成甜菜色素的前体物质酪氨酸,则是苯丙氨酸4位被羟基取代后生成的产物,因此两者合成的前体物质存在同源性[60]。系统发育分析显示,甜菜色素是石竹目早期进化过程中的单一起源色素,而后逐渐消失在合成花青素的谱系中。对于这两类色素互斥的原因已经从遗传和进化的角度进行了诸多讨论[61-62],一般认为,甜菜色素和花青素最初是拥有共同祖先可以共存的,但经过漫长的进化之后,其中一类色素成为冗余色素导致其功能被选择性丢失。同时,物种间的竞争、合作和共生作为进化的驱动力、动物对颜色感知的差异等可能造成植物在特定条件下选择合成甜菜红素。此外,在细胞代谢过程中这两类色素氧化还原能力的差异也使甜菜色素比花青素更具优势[63]。因此,从进化的角度来说,一些植物可能更倾向于合成甜菜色素而非花青素。
对于甜菜色素和花青素互斥机制研究已经取得了一定进展。Shimada等[64]在菠菜和美洲商陆(甜菜色素植物)中鉴定到花青素合成所必需的二氢黄酮醇-4-还原酶(DFR)基因和花青素合成酶(ANS)基因,值得一提的是,这两类基因都仅在种子发育过程中的种皮中表达,且都仅用于维持种皮中原花青素的合成,其顺式调节元件的修饰作用可能抑制DFR和ANS基因在其他组织和器官中的表达,从而阻断二氢黄酮醇到花青素生物合成的中间步骤[65]。为了研究三角梅(Bougainvillea)不同苞片颜色形成的潜在机制,Lan等[66]分析了参与甜菜色素和花青素生物合成的全部基因,发现ANS和DFR在所有品种中表达水平均极低是限制花青素合成的主要原因,从而进一步佐证了上述结论。同时,Sakuta等[67]的研究显示,拟南芥MYB 转录因子PRODUCTION OF ANTHOCYANIN PIGMENT1(PAP1)能够激活来源于菠菜的SoANS启动子,在仙人掌中过表达PAP1和PhAN9(区隔化花青素所需的谷胱甘肽S-转移酶)能够造成花青素积累,而来自石竹目植物中的同源PAP却不能激活ANS启动子以诱导花青素合成。通过对石竹目植物PAP的R2R3-MYB结构域进行定点突变研究,进一步鉴定出了抑制PAP转录激活的氨基酸残基,替换该氨基酸残基后石竹目植物PAP 的转录激活能力得以恢复。因此,MYB 转录因子功能的缺失可能是花青素合成后期相关基因表达受到抑制的重要原因,从而导致石竹目植物中无法合成花青素。
虽然自然条件下花青素与甜菜色素在同一植物中不能共存,但随着合成生物学技术发展,在花青素类植物中引入甜菜色素合成途径,已能够实现2种色素同时合成。例如,将甜菜来源的BvCYP76AD1和BvDODA基因,以及紫茉莉来源的葡糖基转移酶基因MjcDOPA5GT在模式植物烟草和经济作物茄子(SolanummelongenaL.)、番茄(Solanum lycopersicumL.)、马铃薯(SolanumtuberosumL.)中表达,能够增加其愈伤组织中甜菜红素的含量[68];在烟草中同时表达甜菜来源的BvCYP76AD1、BvDODA、MjcDOPA5GT和BvCYP76AD6基因,转基因烟草中甜菜红素和甜菜黄素均有合成,且对灰霉菌的抗性也显著提高[69];He等[70]将甜菜色素合成相关基因CYP76AD1、DODA和GT偶联到1个开放阅读框“RUBY”中,成功在烟草(Nicotiana tabacumL.)、拟南芥和水稻(OryzasativaL.)中合成了甜菜色素;Sho 等[71]利用农杆菌侵染法将BpCYP76AD1、BpDODA1和MjcDOPA5GT等基因过表达在烟草中,5 d后发现侵染部位出现暗红色沉淀,并且在520~534 nm 处具有吸收峰,证明甜菜红素的合成。在花青素植物中合成甜菜色素不仅有利于增强花青素植物的抗逆性,而且也能够赋予其更高的营养价值。此外,甜菜色素和花青素的共同出现也为在同一植物中同时研究甜菜色素和花青素的生理功能提供了可能性。
3.2 甜菜色素的生物学功能
甜菜色素可使植物各个部位呈现出不同色彩以吸引昆虫授粉,不同的果实颜色也将吸引鸟类和动物前来取食,从而使得种子被带往各处,促进了植物的传播和繁殖。富含甜菜色素的植物通常具有极强的抗旱和耐盐性,生命力顽强,能够适应恶劣的环境。例如,盐地碱蓬可在3%的高盐环境下完成其生活史[72],其中甜菜色素具有非常重要的作用:甜菜红素可以参与渗透调节过程以维持植物体内正常的生理活动,甜菜黄素也可以间接参与渗透调节过程,通过其合成降解来调控植物体内氨基酸的浓度以维持水分平衡;甜菜红素还可以作为非酶促抗氧化剂,在逆境条件下清除过量活性氧,以保证植物体内细胞代谢过程的正常进行[14];在强紫外线照射下,甜菜色素还可作为“光线过滤器”,对植物起到保护作用;此外,甜菜色素作为植物体内保护性反应中的次生代谢产物,对于增强植物的抗病能力亦有一定作用。
4 甜菜色素的应用
4.1 甜菜色素的经济价值
甜菜色素作为一种天然色素,在食品、饮料、化妆品和医药等领域都有着广泛的应用,其中最主要的用途是作为食品的天然着色剂。甜菜作为甜菜色素的主要来源,甜菜根的浓缩汁可作为食品添加剂,红甜菜提取物是目前甜菜色素作为食品着色剂的唯一商用来源[73]。国外对于食用甜菜色素的利用已非常普遍,而中国对于甜菜色素的研究尚处于初级阶段。虽然民间已有用红甜菜汁给食品着色的记录,但在食品染色市场甜菜色素的应用并不广泛,合成色素仍处于优势地位,因此,对于天然甜菜色素的研究还有待突破。
近几年的研究表明,除了作为优良的食品添加剂和着色剂,甜菜色素在其他领域也发挥着出色作用:例如在棉花中表达甜菜色素合成的关键酶基因,在不影响棉花纤维产量和质量的情况下能够生产出天然粉红色棉花,从而取代对自然环境和人体健康均具有损害作用的合成染料类彩色棉纤维[74];研究表明,添加从甜菜根中提取的甜菜色素到含强酸的铝制品中,铝的腐蚀性降低了98%。因此,甜菜色素还可用作抗酸腐蚀的环保金属涂层[75]应用于食品包装中,添加甜菜色素的食品包装薄膜可用来监测食品质量和检测包装环境,并且这种生物大分子薄膜更易降解且更加环保[76];在生物技术领域,利用甜菜色素的荧光特性可使其应用于显微镜探针中,用于疟疾感染红细胞的荧光检测,对酪氨酸酶活性进行评估,以及通过甜菜醛氨酸与一些氨基酸残基中的游离胺基缩合反应来标记蛋白质[77];此外,甜菜色素在染料敏化太阳能电池中也有着重要作用,该技术将光能转化为电能,转换效率取决于着色剂在可见光谱中吸收阳光的能力及其与电池中二氧化钛半导体相互作用的亲合力。因此,甜菜色素的使用为太阳能电池提供了一种生态环保可再生的替代品[78]。
4.2 甜菜色素对人类健康的作用
氧化应激反应会引起机体一系列生理变化,从而导致一些退化性疾病的发展。甜菜色素由于具有抗氧化和清除活性氧自由基的功效,以及抗肿瘤、保护心脏等作用而越来越受到人们的重视[79]。现代药理学研究表明,甜菜色素在人体内具有抗氧化、抗炎症、抗病毒、降血压血脂、避免心脑血管疾病和糖尿病,以及减轻肥胖的作用[80];传统医学中,甜菜色素可用于治疗便秘、肠胃和关节疼、头皮屑等疾病[11]。近年来,对于甜菜色素在人类健康中的作用又有了很多新的发现:除了抗氧化功能外,抗癌活性通常被认为是甜菜色素的第二大特性,Yin等[81]发现甜菜红素具有加速癌细胞凋亡和缩短癌细胞周期的作用,从而抑制促炎症细胞因子和肿瘤标志物的表达,具有广泛的抗癌活性。也有报道表明仙人掌科植物提取物中的甜菜色素对结肠癌、乳腺癌、肝癌和前列腺癌的细胞活性均具有显著抑制作用[82];此外,火龙果和假刺苋(Amaranthusdubius)中富含甜菜色素的部位表现出对登革热病毒的抑制作用,甜菜色素很可能与病毒的包膜蛋白E 作用,通过干扰病毒与宿主的结合来抑制病毒传染[83];Rivera等[84]在糖尿病小鼠体内添加甜菜色素,发现小鼠体内具有了抗血脂活性,同时甘油三酯、胆固醇含量降低且小鼠体重减轻;Wang等[85]的研究表明,甜菜红素通过提高谷胱甘肽含量和降低髓过氧化物酶MPO 的活性,来降低炎症细胞因子的表达从而可用于青光眼疾病的治疗。综上所述,甜菜色素在多个方面都表现出对人类健康具有积极作用,相信未来会有更多关于甜菜色素的医疗保健价值被挖掘出来。
5 展 望
近些年来,对于甜菜色素的研究方兴未艾,在相关领域已经取得了长足进展。然而,相较于在叶绿素、花青素和类胡萝卜素研究领域所取得的成果,对于甜菜色素的深入研究还亟待开展。由于甜菜色素与花青素之间的“深厚渊源”,且其自身又具有重要的观赏价值和营养保健价值,因此对于甜菜色素的研究不仅有重要的理论意义,同时也具有广阔的开发和应用前景。本文综述了甜菜色素的生物合成及转录调控机制、光对甜菜色素合成的影响以及可能的分子机制、甜菜色素与花青素的关系以及甜菜色素的应用等领域的相关研究进展,希望能够为未来更好地研究和开发利用甜菜色素提供思路。
在未来研究中,非常有必要进一步挖掘甜菜色素生物合成途径中其他的基因和酶类,特别是与糖基化和酰基化反应有关的基因和酶类,这不仅可为阐明甜菜色素结构多样性的形成机制奠定理论基础,同时也有助于利用代谢工程的手段来合成具有不同色彩或更加稳定的甜菜色素化合物;此外,光照作为重要的环境因子之一,在诱导甜菜色素合成中发挥着重要作用,然而目前对于光信号调控甜菜色素生物合成的分子机制还所知甚少。鉴于在花青素植物中,光信号调控色素合成的分子机制已经逐渐明晰,因此,在未来研究中,立足于花青素植物中所取得的研究成果,深入解析光信号调控甜菜色素生物合成的分子机制也将会是一个非常有意义的研究领域。

