胃饥饿素通过抑制内质网应激减少高糖诱导的视网膜血管内皮细胞凋亡
李 蓉,姚国敏,张 敏,王小娣
(1西安医学院第一附属医院眼科,西安 710077;2西安医学院第一附属医院内分泌科;*通讯作者,E-mail:rechelrong198222@163.com)
糖尿病性视网膜病变(diabetic retinopathy, DR)是糖尿病(diabetes mellitus,DM)的常见并发症,也是劳动年龄人群不可逆转失明的主要原因[1]。根据国际糖尿病联合会的报告,预计到2045年,全球糖尿病患者将达到7亿人,这表明目前和未来全球DR负担仍然非常繁重[2]。DR的病变会随着DM病程的延长和血糖水平的增加而越来越严重。视网膜新生血管、玻璃体积血和牵拉性视网膜脱离可能最终导致视力丧失。玻璃体内注射抗血管内皮生长因子药物的研究进展为治疗糖尿病性黄斑水肿和视网膜新生血管提供了额外的方法,并且能有效改善患者的视力结果[3,4]。然而,沉重的治疗负担和难治性疾病[5]等一系列挑战仍然存在。因此,阐明DR新的病理生理机制,探索靶向其他途径的新型药物,可能会在一定程度上改变目前DR的治疗模式[6,7]。已有研究证实,高糖环境下视网膜血管内皮细胞发生凋亡是DR的关键病理特征,因此减轻或阻止该事件的发生成为了治疗DR的重要靶点[8,9]。
胃饥饿素(ghrelin)是一种肽激素,直到1999年ghrelin才被发现[10],因其在刺激食欲、摄食行为、能量稳态和碳水化合物代谢方面的作用而闻名[11]。其许多潜在功能引起了人们对该激素多种临床应用的极大兴趣,如心血管系统[12]、神经系统[13]和眼部疾病[14]。近年来,有研究揭示了ghrelin在糖尿病中的血糖调节作用[15],细胞和动物模型研究也提示了ghrelin对DR可能的保护作用[16],但目前关于ghrelin对DR的作用和机制的报道仍然较少。一系列研究表明,ghrelin能维持血管扩张-血管收缩因子的平衡、抑制炎性细胞因子的产生和免疫细胞向血管损伤部位募集以及促进血管新生,从而维持正常的内皮功能[17]。本研究拟以视网膜血管内皮细胞为对象,观察ghrelin是否对高糖诱导的细胞凋亡具有抑制作用,以及是否对内质网应激产生影响,以期为研究ghrelin对DR的治疗作用奠定基础。
1 材料和方法
1.1 细胞株、主要试剂与仪器
人视网膜血管内皮细胞(human retinal vascular endothelial cells,HRMECs),购自上海中乔新舟生物科技有限公司;M199细胞培养基、0.25%胰蛋白酶及胎牛血清购自武汉普诺赛生命科技有限公司;胃饥饿素购自美国Glpbio公司;Annexin Ⅴ-FITC/PI细胞凋亡试剂盒购自武汉伊莱瑞特生物科技有限公司;BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;兔多抗Bax抗体及Bcl-2抗体购自美国Abcam公司;兔多抗p-IRE1α、兔多抗IRE1α购自美国Invitrogen公司;兔多抗GRP78购自武汉三鹰生物技术有限公司;兔多抗GAPDH抗体购自杭州贤至生物科技有限公司;辣根过氧化物酶标记的羊抗兔二抗购自武汉博士德生物工程有限公司;CO2恒温培养箱(MCO-15AC型)购自日本SANYO公司;酶标仪(Multiskan MK3型)购自美国Thermo公司;倒置显微镜(ECLIPSE Ts2型)购自日本Nikon公司。
1.2 细胞处理及分组
常规复苏HRMECs细胞,转移到含有5 ml培养基的离心管中,室温1 000 r/min离心5 min,离心收集细胞;用含10%胎牛血清、1%双抗(青霉素、链霉素)的M199培养基悬浮细胞,接种到培养皿中,轻轻吹打混匀,37 ℃、5% CO2饱和湿度条件下培养。细胞的密度达到80%时,按1∶3的比例传代细胞。将生长良好的细胞分为对照组、高糖组、高糖+ghrelin组和高糖+ghrelin+衣霉素组。对照组细胞常规培养,高糖组在M199培养基中加入24.5 mmol/L葡萄糖水溶液(即葡萄糖浓度为30 mmol/L),高糖+ghrelin组在M199培养基中加入24.5 mmol/L葡萄糖水溶液和10 nmol/L ghrelin,高糖+ghrelin组+衣霉素组在M199培养基中加入24.5 mmol/L葡萄糖水溶液和10 nmol/L ghrelin,处理36 h后再加入10 μmol/L衣霉素,继续培养12 h后收集细胞。以上四组所有细胞均处理48 h。
1.3 细胞凋亡检测
取生长状态良好的HRMECs细胞,以每孔5×105个的密度接种于6孔板,37 ℃孵育48 h。消化后收集细胞并离心(1 500 r/min,5 min),500 μl结合缓冲液重悬细胞,加入5 μl Annexin Ⅴ-FITC和5 μl 7-AAD混匀,室温避光孵育15 min,流式细胞仪检测细胞凋亡情况。
1.4 Western blot法检测Bax、Bcl-2、GPR78及IRE1α的蛋白表达
按不同分组处理后收集各组细胞,用RIPA裂解液提取细胞总蛋白,BCA蛋白浓度测定试剂盒测定蛋白含量,每个样本取40 μg蛋白,用SDS-PAGE分离,转移至PVDF膜上。用含5%脱脂奶粉的TBST室温孵育2 h,磷酸化蛋白用1%胎牛血清封闭。用封闭液稀释相应的一抗,使PVDF膜浸泡于一抗孵育液中,4 ℃孵育过夜,抗体稀释浓度如下:Bax(1∶2 000)、Bcl-2(1∶1 000)、GPR78(1∶2 000)、p-IRE1α(1∶1 000)、IRE1α(1∶1 000)、GAPDH(1∶1 000)。TBST洗膜,用辣根过氧化物酶标记的二抗(1∶10 000)在室温下孵育2 h。充分洗膜后,使用化学发光盒对蛋白条带进行显色处理,扫描胶片,采用Bandscan 5.0软件分析胶片灰度值。
1.5 统计学分析
2 结果
2.1 ghrelin对高糖诱导的细胞凋亡的影响
细胞流式检测结果显示,对照组、高糖组、高糖+ghrelin组三组之间细胞凋亡率总体比较,差异有统计学意义(F=1 131.95,P<0.001)。与对照组相比,高糖组细胞凋亡率明显升高(P<0.001);与高糖组相比,高糖+ghrelin组细胞凋亡率明显降低(P<0.05,见图1)。
Western blot检测结果显示,3组间Bax(F=162.26,P<0.001)和Bcl-2(F=70.70,P<0.001)的蛋白表达存在差异。与对照组相比,高糖组Bax表达明显升高,Bcl-2表达明显降低,差异均有统计学意义(P<0.001);与高糖组相比,高糖+ghrelin组Bax表达明显降低,Bcl-2表达明显升高,差异均有统计学意义(P<0.001,见图2)。
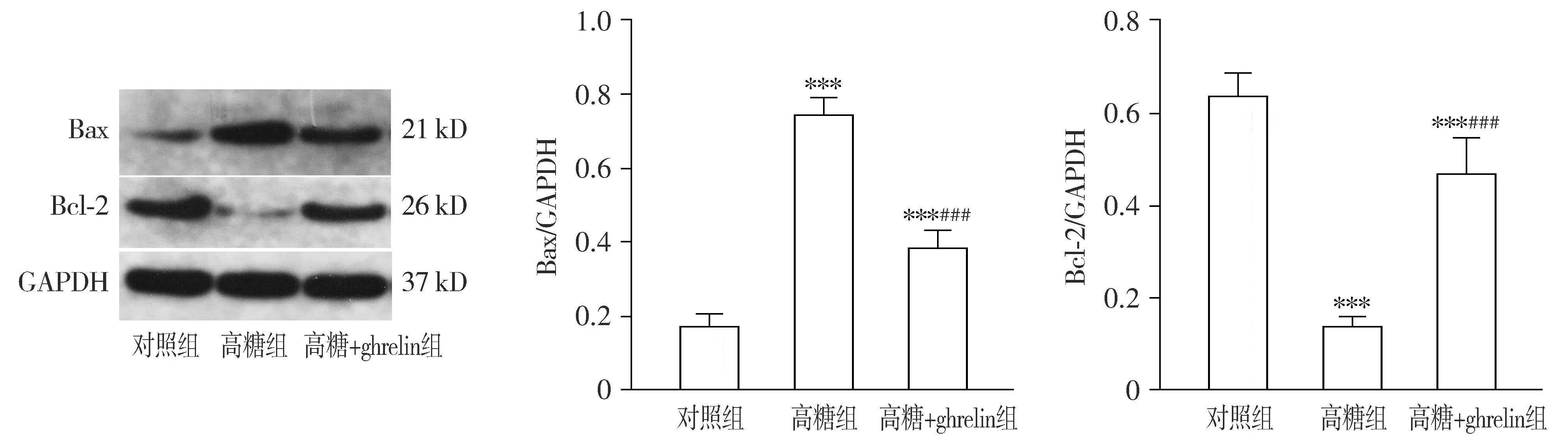
与对照组比较,***P<0.001;与高糖组比较,###P<0.001图2 ghrelin对HRMECs细胞Bax、Bcl-2蛋白表达的影响Figure 2 Effect of ghrelin on protein expressions of Bax and Bcl-2 in HRMECs
2.2 ghrelin对高糖诱导的内质网应激的影响
Western blot检测结果显示,3组间内质网应激标记蛋白GPR78(F=74.18,P<0.001)和p-IRE1α(F=54.89,P<0.001)的蛋白表达存在差异,IRE1α的蛋白表达差异无统计学意义(F=0.01,P>0.05,见图3)。与对照组相比,高糖组GPR78及p-IRE1α表达明显升高(P<0.001);与高糖组相比,高糖+ghrelin组GPR78及p-IRE1α表达明显降低(P<0.01,见图3)。
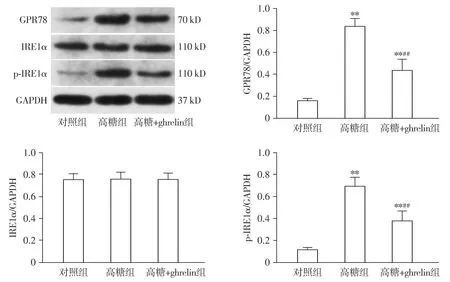
与对照组比较,**P<0.01;与高糖组比较,##P<0.01图3 ghrelin对HRMECs细胞GPR78、IRE1α及p-IRE1α蛋白表达的影响Figure 3 Effect of ghrelin on protein expressions of GPR78, IRE1α and p-IRE1α in HRMECs
2.3 ghrelin减轻高糖诱导的细胞凋亡的分子机制
为了明确内质网应激在ghrelin抑制高糖诱导的细胞凋亡中的作用,最后加入了内质网应激激活剂衣霉素。细胞流式检测结果显示,高糖+ghrelin+衣霉素组细胞凋亡率明显高于高糖+ghrelin组,差异有统计学意义(t=-17.88,P<0.001,见图4)。

图4 ghrelin对HRMECs细胞凋亡率的影响Figure 4 Effect of ghrelin on apoptosis rate of HRMECs
3 讨论
凋亡最早是由Kerr等于1972年用来描述一种形态上不同的细胞死亡类型[18]。细胞凋亡是细胞定期发生的程序性死亡,其特征是细胞结构的一些特征形态变化,以及一些酶依赖的生化过程,从而清除体内的细胞,以确保细胞形成率和细胞死亡率之间的稳态平衡。然而,这种平衡功能的错位会导致异常的细胞生长/增殖或自身免疫性疾病等[19]。随着细胞凋亡研究的不断深入,一系列研究发现DR的发生、发展与视网膜细胞的凋亡有着密切联系。视网膜毛细血管内皮细胞、周细胞及神经细胞的凋亡,与DR基本病理变化及临床表现有着密切的联系[20]。本研究采用经典的DR体外模型,观察到高糖环境下HRMECs细胞凋亡率比正常培养环境中明显增加,凋亡标记蛋白Bax表达上调,Bcl-2表达下调,与文献报道一致[21,22]。在DR的进展过程中,早期视网膜细胞发生凋亡,扰乱了正常的视网膜生理状态,是最终导致DR各种病理改变和临床表现的根本原因。因此,防止或逆转视网膜细胞凋亡可以有效控制DR的发展。既往研究表明ghrelin可发挥血管内皮细胞保护功能[17],对DR可能也具有保护作用[16]。本课题组前期实验用浓度10 nmol/L ghrelin处理HRMECs,发现ghrelin可明显抑制高糖下的细胞凋亡率,同时下调凋亡促进蛋白Bax、上调凋亡抑制蛋白Bcl-2的表达[23],也提示了ghrelin对DR的可能保护作用。
内质网是细胞内负责蛋白质加工转运的主要场所,主要调节分泌蛋白和跨膜蛋白的合成、折叠和翻译后修饰。作为一种保护性反应,受到刺激时内质网应激(endoplasmic reticulum stress,ERS)发生,激活未折叠蛋白反应(unfolded protein response,UPR)以恢复细胞稳态。但当应激过强或持续时间较长,内质网发生功能障碍,导致蛋白折叠和堆积异常[24],细胞内环境无法恢复,就会激活相应的细胞凋亡途径,导致DR患者的视网膜血管内皮细胞、周细胞、神经节细胞的凋亡和神经胶质细胞的反应性增生[25]。因此,研究ERS并加以调控,有望为防治DR提供一种新途径。葡萄糖调节蛋白78(glucose regulatory protein 78,GRP78)是一种多功能蛋白,也是ERS介导凋亡的关键信号分子。UPR主要涉及IRE1α、ATF6、PERK生存途径,而这3条途径都需要有GPR78的参与[26]。IRE1α是内质网上的跨膜蛋白,其信号通路是UPR信号网络中进化上最保守的分支。ERS时,IRE1α与GRP78解离后发生二聚化和自磷酸化,促进下游多种应激基因的表达,使细胞内环境恢复稳态;但长时间的ERS或ERS过强,IRE1α则介导细胞凋亡[27]。细胞和动物实验均已证实,ERS介绍的视网膜血管内皮细胞凋亡参与DR的病理机制[28],本研究发现高糖下HRMECs中ERS被激活,表现为GPR78和p-IRE1α的蛋白表达水平升高,ghrelin干预后细胞ERS明显降低,GPR78和p-IRE1α的蛋白表达明显下调。为了明确ghrelin抑制细胞凋亡与其缓解ERS有关,本研究最后采用ERS诱导剂衣霉素处理高糖损伤的内皮细胞,发现激活ERS后,ghrelin联合衣霉素处理组的细胞凋亡率明显高于ghrelin单独处理组,提示ghrelin对细胞凋亡的抑制作用与ghrelin减轻高糖下的ERS存在关联。
综上所述,本研究结果提示ghrelin可以减轻高糖诱导的视网膜血管内皮细胞凋亡,其机制可能与ghrelin对激活的内质网应激发挥抑制作用有关。本研究为将ghrelin作为治疗DR的新手段提供了新的方向,不过我们只在体外进行了研究,ghrelin是否能真正阻止或延缓DR的进展还不清楚。此外,DR的发病机制十分复杂,ghrelin是否通过其他信号通路发挥作用也值得探讨。目前虽然尚无关于ghrelin毒性的报道,但考虑到药物在眼局部作用部位达到有效浓度和发挥治疗作用可能受到多种因素的影响,如药物吸收率、组织中的结合与分布、给药的剂量等,因此如何利用ghrelin作为治疗药物用于DR还需进一步研究,以期实现基础研究的临床转化。

