初中化学“生活中常见的盐”项目式教学*
——探究自制烤面包中泡打粉的主要成分
侯秀珠 郑柳萍 陈丽裙**
(1.莆田第十七中学 福建 莆田 351111;2.福建师范大学 福建 福州 350007)
一、项目主题内容和教学现状分析
1.教学主题内容分析
碳酸钠和碳酸氢钠的性质及用途是人教版九年级《化学》下册教材第十一单元《盐与化肥》课题1生活中常见的盐第2 课时的教学内容[1],教材在介绍了碳酸钠、碳酸氢钠这两种盐在生产生活中的用途之后,通过已学的碳酸钙与盐酸的反应引出碳酸钠、碳酸氢钠相关性质的讨论和实验,旨在引导学生认识到含碳酸根和碳酸氢根的盐具有与盐酸反应放出CO2的共性,但并没有构建性质决定用途的观念,且与实际生活的联系不够紧密。对碳酸钠、碳酸氢钠两种盐在水中溶解的热效应、溶液酸碱性的认识本不是初中教学的重点,但是忽略这些内容易使学生形成一些错误的认知,如固体溶解无热效应、盐溶液呈中性等。而来自实际生活的泡打粉(主要成分是碳酸氢钠),其发泡的性能有利于激发学生的认知冲突——碳酸钠是否也能作为泡打粉。为此,将项目学习主题确立为“探究烤面包中泡打粉的主要成分”,确定项目学习成果为“揭秘碳酸钠不能替代碳酸氢钠作为烤面包中泡打粉主要成分的探究报告”。让学生体验从化学原理到实验设计再到解决实际问题的科学探究与实践过程,逐渐培养学生分析、综合、比较、归纳、推理、反思和建模等科学思维方法,形成对物质的性质与应用之间关联的科学认识。
2.学生学情分析
针对“探究烤面包中泡打粉的主要成分”的学习主题,学生已有认知及认知需求的学情分析,见表1。
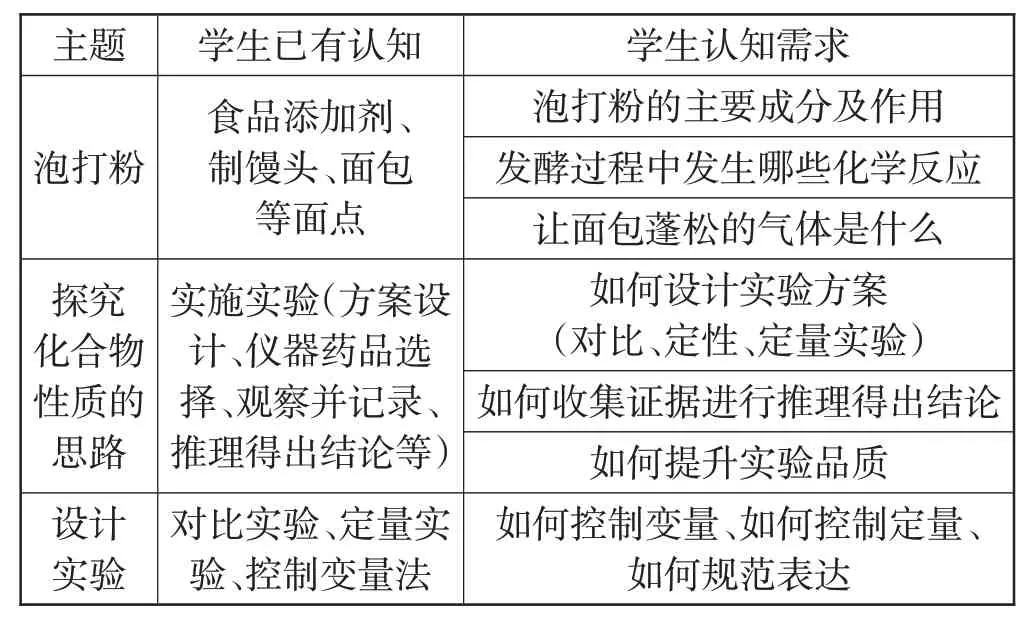
表1 “探究烤面包中泡打粉的主要成分”学情分析
二、教学目标
依据《义务教育化学课程标准(2022年版)》[2]对课程学习目标及科学思维素养提出的要求,融合项目式学习目标,包括核心知识、能力、态度和素养目标,培养学生严谨的科学态度,促进学生高水平思维发展,制定明确、精准的教学目标。
1.能通过实验探究,比较碳酸钠、碳酸氢钠两种固体在水中的溶解性、溶液的酸碱性、与酸反应等性质,从化学的角度评价物质在生活中的应用,形成“物质的性质决定用途”的化学观念。
2.能建构化合物性质探究模型,开展数字化实验对比探究,学会控制变量的思想,能对方案的优劣及可行性进行评判,培养反思意识,能对数字化实验所形成的曲线表征图进行比较与分析,对不同观点和结论作出质疑与批判,形成严谨的证据推理能力,能根据化学方程式计算体会定量思想的实际应用价值。
3.通过运用所学的化学知识、方法与原理,解决生活中的化学问题,感受化学学科的魅力,形成严谨的科学态度,激发学生学习化学的浓厚兴趣。
三、项目任务及教学流程(见表2)

表2 项目任务及教学流程
四、课堂实录
1.体验项目情境,建立学习期待
[创设情境]播放笔者用面包机制作烤面包的剪辑视频。提供资料:烤面包的主要配料有①牛奶100 mL、②食盐3 g、③糖30 g、④面包粉250 g、⑤泡打粉(发酵粉)3 g、⑥黄油20 g等,注意按配料顺序添加配料。
[学生]观看视频,提出要探究的化学问题。
2.提出个人看法,确定研究任务
[学生]泡打粉的成分及作用是什么?如何保存?为什么要按照配料顺序添加各种配料呢?发酵过程中发生哪些反应?让面包蓬松的气体是什么?我们能自制泡打粉吗?等等。
[任务1]上网查找资料,弄清泡打粉的成分、作用及保存方法(课前已布置查找并购买泡打粉)。
[学生展示]课前查找的泡打粉相关资料(图1)。

图1 泡打粉的主要成分、作用及保存方法
[学生发现并展示]发现多种品牌泡打粉(或称发酵粉)都有共同物质碳酸氢钠,并汇报课前查到的资料:碳酸氢钠除了作为发酵粉外,还可用于治疗胃酸过多症、制可乐、泡腾片、做馒头、泡沫灭火器、果蔬洗涤盐等。
[教师提问]这些作用与碳酸氢钠哪些性质有关?能用碳酸钠代替碳酸氢钠作为泡打粉吗?用化学方法如何解决这个问题?以品牌2为例进行探究。
[师生活动]共同讨论、选择几个有价值、有代表性的问题布置课中探究任务(见表2 中任务2-6),学生以小组为活动单位,设计实验并开展探究。
3.预测物质性质,提出探究模型
[教师提问]添加面包配料时,牛奶能与泡打粉同时加入吗?为什么?请用实验证明你的猜想。
[任务2]验证泡打粉加水后产生的气体。
[学生猜想并验证]猜想品牌2泡打粉中碳酸氢钠与固体酒石酸(一种酸性物质)溶于水且两者发生化学反应。于是,取购买的品牌2泡打粉样品少许于试管中,加入适量水,发现有无色气泡产生,将该气体通入澄清石灰水会变浑浊,由此推断在水的作用下,碳酸氢钠与固体酒石酸发生反应产生了CO2。
[教师点评]烤面包一般要经过和面→发面(发酵)→烧烤三个过程,发面时面团会形成许多薄膜,把碳酸氢钠和酒石酸充分溶于水后反应所释放的CO2罩住,这些气体在烧烤时让面包达到膨胀松软的效果,而和面时面团薄膜未形成,泡打粉一旦与水接触,碳酸氢钠与酒石酸迅速溶解,反应产生的CO2逸散导致发酵粉失效(发酵时无气体产生,烧烤就无法达到蓬松的目的),这就是添加面包配料时,牛奶不能与泡打粉同时加入的原因。
[学生]有学生认为,碳酸钠与碳酸氢钠组成相似,性质可能相似,所以碳酸钠可以替代碳酸氢钠作为泡打粉。
[任务3]验证碳酸钠与酸反应也能产生CO2气体。
[学生]取少量碳酸钠于试管中,加入适量稀盐酸(或稀硫酸),有无色气泡产生,将气体通入澄清石灰水中,变浑浊,说明碳酸钠也能与酸反应产生CO2气体。
[教师]既然碳酸钠、碳酸氢钠都能与酸反应产生CO2气体,那么碳酸钠究竟能不能代替碳酸氢钠作为泡打粉?
[学生]产生新问题:碳酸钠能不能替代碳酸氢钠?从哪几个方面找证据呢?
[教师]指导学生根据化合物性质预测模型(图2),设计实验并完成探究活动。
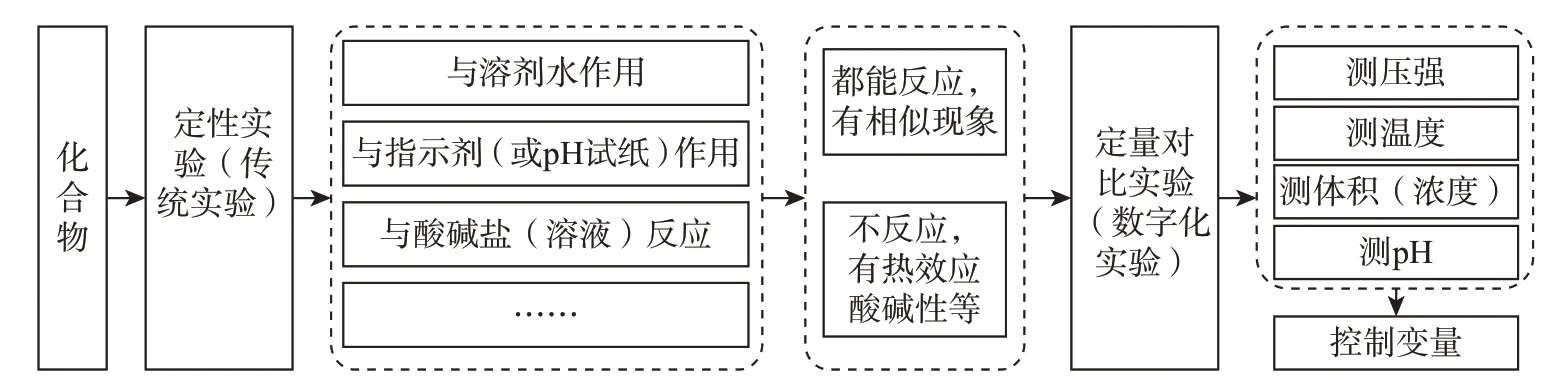
图2 化合物性质预测模型
4.设计实验方案,建构探究模型
4.1 固体与酸的反应
[学生活动]根据预测模型(图2),画出自己要探究的思维导图并展示,见图3。
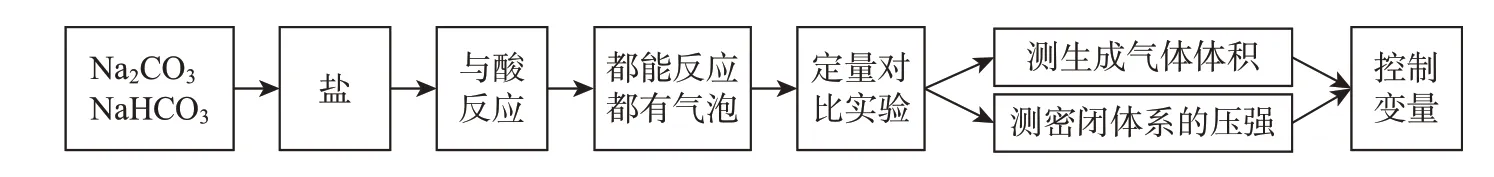
图3 探究“碳酸钠、碳酸氢钠与酸反应”性质的思维导图(部分学生)
[教师]弄清了解决问题的思路,接下来请大家根据相关化学原理与方法设计实验,比较两者与酸反应的情况。
[任务4]设计实验方案比较碳酸氢钠、碳酸钠与稀盐酸的反应。
[第1组学生]小组代表汇报实验方案:各取少量碳酸氢钠与碳酸钠放入两支试管中,同时滴加足量稀盐酸(图4),观察实验现象。

图4 与酸反应(1)
[教师]该实验方案合理吗?为什么?
[学生1]该方案不科学。因为前面我们刚已验证了两种固体都能与酸反应产生CO2(属于都能反应、相似现象类型),故应设计对比实验进行探究,但在对比实验设计中需要控制单一变量,该方案没有控制等量的碳酸氢钠与碳酸钠,无法比较反应的快慢以及生成的气体量的大小。
[学生2]用胶头滴管滴加盐酸,无法保证酸的用量是相同的。
[教师]如何改进?
[第2组学生]我们组做了改进,先各取1 g碳酸氢钠、碳酸钠固体分别放入两个气球中,并把气球套在内装足量稀盐酸的两个锥形瓶口(图5),同时倒入固体,观察到装有碳酸氢钠的气球先胀大且膨胀度比碳酸钠厉害,说明等质量的两种固体与酸反应,碳酸氢钠反应速率快且生成CO2气体量较多。
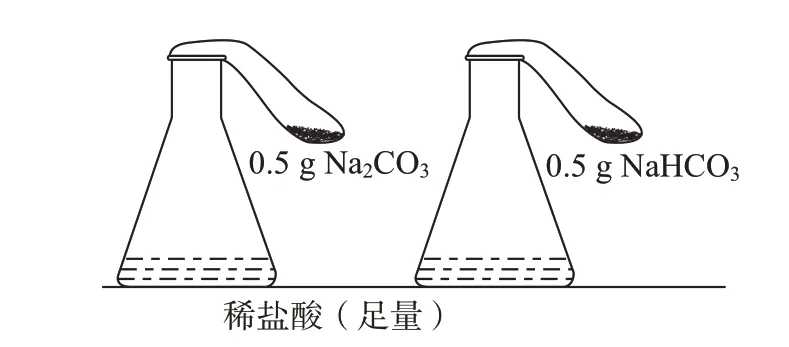
图5 与酸反应(2)
[学生评价]该方案不够严谨,没有说明两个锥形瓶和气球的大小是否相同,且固体必须都是粉末状的才行。
[教师点评](肯定同学们的分析与评价)碳酸钠、碳酸氢钠都能与酸反应生成CO2气体,现象十分相似。所以要判断碳酸钠能否代替碳酸氢钠作泡打粉,必须有相当有力的证据,在设计对比实验时应尽可能找出两者与酸反应的剧烈程度以及生成气体量的大小,但要控制好变量,一般只控制一个条件发生变化(自变量),其他的条件都不变才能找到最终那个变量(因变量)与这个变量之间的关系。刚才第1组与第2组同学设计的实验都是定性对比实验,实验仍存在许多不足,有些实验现象难以用肉眼观察得到,能否设计成定量对比实验?
[第3组学生]我们组也做了改进,采用压强传感器进行实验。各取1 g的碳酸氢钠与碳酸钠粉末分别放在两支Y形管(容量为100 mL)一端,另一端装同浓度足量的稀盐酸(图6),同时倾斜铁架台,让左端盐酸缓缓流向右端,利用压强传感器测量管内气压变化,但本次实验失败了,Y 形管塞子被冲出去,后来我们组改用0.5 g两种固体进行实验成功了,实验结果见图7。从图像很清晰地看出,碳酸氢钠的曲线比较陡(斜率大)、终点压强大,而碳酸钠的曲线相对较平缓(斜率小)、终点压强小,说明相同质量的两种固体与足量酸反应,碳酸氢钠反应速率较快且生成气体量较多。(教师提供信息:斜率大小表示反应速率的大小,而压强大小则表示反应生成气体量的大小)

图6 与酸反应(3)
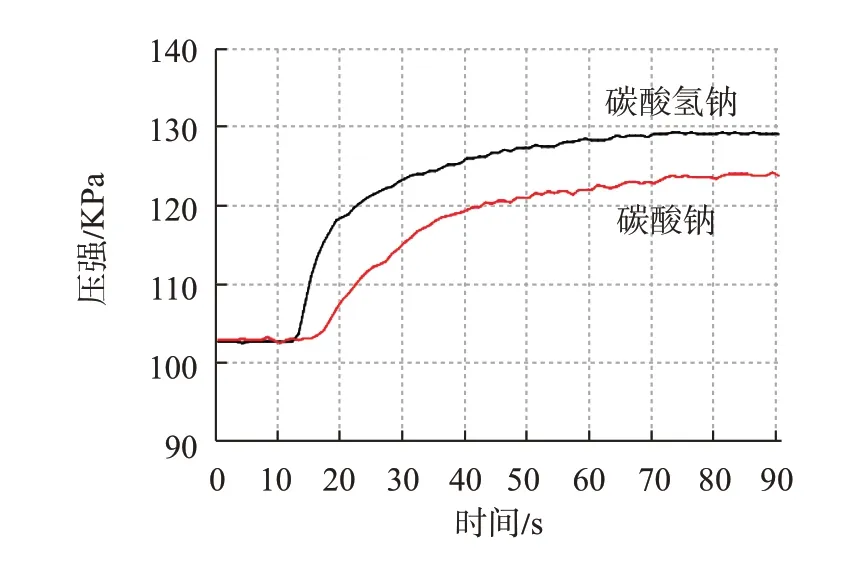
图7 压强随时间变化统计图(温度:15 ℃)
[师生评价实验方案]第3 组方案设计较严谨科学,现象明显,证据确凿,方案可行。经分析推理,归纳得出结论:若用碳酸钠作泡打粉,它与酸反应速率慢且生成的气体量较少,效果不如碳酸氢钠好。
[教师提问]刚才第3组同学在实验过程中,为什么取1 g粉末会发生瓶塞被冲出的情况?
[学生讨论]小组讨论后回答问题。
[学生1]气密性不好。
[学生2]不对,是没有控制好碳酸氢钠与碳酸钠粉末的质量(即自变量的定量问题),导致生成的气体量太大,瓶塞被冲出。
[教师点评]在实施对比实验时,应学会对设计的方案科学性、可行性及安全性等进行评估。第3组同学利用手持技术来开展实验探究,精确度高,可视性强,方案较好,但不足之处:预先没有做好对比实验中自变量的定量计算问题,为什么不能取1 g 而可以是0.5 g呢?这时,教师顺势让同学们当场计算,以生成的CO2为100 mL计算(Y形管容量),CO2密度为1.997 g/L,根据化学方程式HCl+NaHCO3== ==== NaCl+H2O+CO2↑计算,则需要碳酸氢钠的质量约为0.381 g,学生也就自然明白前面取1 g 粉末进行实验失败的理由,由此渗透对比实验中控制定量思维的实际应用价值。制作面包时,相同质量的泡打粉与酸反应产生气体的量越多,则做出来的面包越蓬松、口感越好,而反应越剧烈则表明发面(发泡)越容易进行,缩短面包制作的时间。正因为相同质量下碳酸氢钠与酸反应产生的CO2比碳酸钠多,所以生活中碳酸氢钠常用于作泡打粉、制可乐、做灭火器等,让学生懂得原来物质的用途是由其性质决定的。
4.2 固体的溶解性及溶解热
(2)企业级预案管理。收录采集各级企业部门的综合应急预案、专项应急预案、现场处置方案,对收集的预案进行动态管理。
[教师提问]还有其他证据说明碳酸钠不适宜作泡打粉吗?
[任务5]探究碳酸氢钠、碳酸钠固体的溶解性及溶解热
[学生活动]根据预测模型(图2),画出自己要探究的思维导图并展示,见图8。

图8 探究“碳酸钠、碳酸氢钠的溶解性及其溶液酸碱性”思维导图(部分学生)
[教师]派小组代表汇报任务5设计的实验探究方案及实验结果。
[第4 组学生]我们组取两种固体各1 g 分别放入10 mL 水(水温16.0 ℃)中溶解,边搅拌边用温度传感器测量,发现1 g 碳酸钠全部溶解而碳酸氢钠却有少部分不溶,产生的热效应见图9。

图9 溶解热变化曲线图
[学生对比分析并归纳]在相同温度下,等量的水中,碳酸钠的溶解能力比碳酸氢钠大(即相同温度下碳酸钠的溶解度较大),且溶解放热,而碳酸氢钠溶解吸热。
[教师点评]和面阶段应尽可能保留更多的发酵粉。选用溶解度较小的碳酸氢钠作泡打粉,可确保和面时发酵粉较少被水溶解且反应掉,而溶解吸热也可确保低温环境下碳酸氢钠不被分解(50 ℃时碳酸氢钠就开始分解)。
4.3 固体水溶液的酸碱性及酸碱度
[任务6]探究碳酸氢钠、碳酸钠溶液酸碱性及酸碱度。
[学生活动]根据图8探究思维导图,设计实验方案。
[第5 组学生]我们组取0.5 g 两种粉末分别置于10 mL 水中溶解后得到的溶液,利用pH 计进行测量,测得碳酸钠溶液pH 为11.31,碳酸氢钠溶液pH 为8.41,说明两种溶液均呈碱性,且同浓度的碳酸钠溶液的碱性明显强于碳酸氢钠溶液。
[第6 组学生]我们组分别取1 g 碳酸氢钠与碳酸钠置于10 mL蒸馏水中,边搅拌边用pH传感器进行测量,可以看见整个过程的实验结果(见图10)。

图10 酸碱度变化曲线
[师生点评]第5 组和第6 组设计的实验精确度高,直观性强,方案可行,第5组测的是结果,而第6组可以观察到整个过程中溶液的PH变化情况。
[学生对比分析并归纳]碳酸氢钠和碳酸钠两种溶液都呈碱性,但同浓度的碳酸氢钠溶液的碱性比碳酸钠溶液要小。
[教师点评]制作面包时,若使用碱性较强的碳酸钠来作泡打粉,会使制作的面包带有苦涩味,口感较差。所以溶液碱性较弱的碳酸氢钠,往往用于制作泡打粉、治疗胃酸过多等,而溶液碱性较强的碳酸钠通常则用于清除油污,生活中湿抹布沾了除污粉会发烫,就是除污粉中含有碳酸钠(吸水放热)的缘故,再次渗透“物质的性质决定用途”的化学观念。
5.分析推理归纳,形成项目成果
[教师]探究碳酸钠能否取代碳酸氢钠作泡打粉的报告应该综合考虑哪些方面?实验操作中应注意哪些问题?
[任务7]评价并形成探究报告。
[学生]小组讨论、相互评价,汇报结果(教师及时引导)。
[学生]讨论归纳并完善探究报告。
6.提交探究报告
从各小组提交的探究报告来看,特点有:(1)报告中体现探究内容的逻辑较清晰,多数学生能按照化合物性质探究模型画出思维导图,逐项呈现,说明学生思维有所进阶,达成了建构模型解决化学问题的教学目的。(2)在设计定量对比实验时,对控制哪个自变量有清楚的认识,并能利用化学方程式计算,达成了体会定量思想的实际应用价值的教学预设[3]。能利用数字化实验进行定量实验设计,对曲线表征图进行对比分析、归纳与推理,得出正确结论。(3)在反思评价阶段,有的小组还发现新问题:碳酸钠不能代替碳酸氢钠作发酵粉,可能还与碳酸钠在加热条件下不能分解而碳酸氢钠能分解有关;碳酸钠与碳酸氢钠都是钠的碳酸盐,为什么两者与酸反应的速率会不一样呢?(4)有的小组还说,他们发现生活中物质的用途往往都能体现物质的某种性质,达成了建构“物质性质决定用途”观念的教学目标,感受到了化学学习的价值。
五、教学效果及反思
(1)项目式学习将学生置于主体地位,让学生在动手实践中获得了项目成果的成就感,在真实的实验实践中分析推理、比较归纳,得出结论解决实际问题,获得了核心知识与技能、关键能力和品格。而手持技术数字化实验在定量实验设计中的重要优势,让对比实验结果高度可视化,直观说明了碳酸钠、碳酸氢钠与酸反应、固体溶解热及溶液酸碱度的不同,找到了确凿的证据,证明碳酸钠不能替代碳酸氢钠作泡打粉的多种理由,突破学生已有经验的局限与思维定式,实现学生对课程知识的内化与迁移。
(2)在探究活动阶段,利用多次任务驱动,让学生在“做中学”“做中思”“做中悟”,有利于批判性思维和创新思维的培养,促进学生科学思维的发展。学生们按小组组成一个个学习共同体,通过共同学习研讨、共享资源、共同协作,完成各项学习任务,从而实现共同成长、共同提高的目的[4]。同时,有助于教师发现学生存在的问题,及时进行针对性指导实践研究,进一步深化对项目式学习有助于发展学生核心素养的认识。
(3)课后,笔者鼓励学生利用课余时间进行延伸探究——碳酸氢钠作泡打粉是否与它在加热条件下能分解的性质有关,从而促进学生认知的全面发展,增进对科学实验的情感。在后续综合评价结果中发现小组的合作探究能力大大增强,问题解决能力得到明显的提升,在项目学习过程中学会初步建构化合物性质探究模型,信息素养也得到了提升。

