地黄活性成分治疗骨质疏松症的相关信号通路研究
姚鑫宇 武瑞骐 陈广辉 李振兴 陈定聪 张结 邹起平 纪晓锋 周宾宾*
1.广西中医药大学,广西 南宁 530000 2.广西中医药大学第一附属医院,广西 南宁 530000
骨质疏松症(osteoporosis,OP)作为一种慢性流行病,其主要特征是骨量减少,骨微结构恶化,致使骨骼强度降低,发生骨折的概率增大[1],流行病学调查发现,2020年中国OP或者低骨密度的病人达2.866亿例,预计2050年会增加到5.333亿例[2],形势不容乐观。现阶段,OP的治疗以药物为主,在临床上较为常用的有选择性雌激素受体调节剂、双膦酸盐和降钙素等。这些药物可以缓解骨丢失从而改善临床症状,但长期应用会受到耐受性低、副作用严重和经济成本高等多方面因素的限制。因此寻求一个疗效稳定、安全性高的治疗药物显得尤为重要。
近年来,随着中药研究的投入不断加大,临床及科研工作者对其作用机制、临床应用的理解逐步加深,部分具备疗效好、副作用小、经济性价比高等优点的中药获得患者及临床工作者的广泛认可。中药地黄(Rehmannia glutinosa Libosch)在中国传统医学长达千年的实践历史中占据重要地位,是众多医方中不可缺少的一部分[3]。在中医理论中肾藏精主骨,化生骨髓,以髓养骨,肾虚则精亏,骨枯髓减。肝藏血,主疏泄,人体气血得以正常运行,若肝失疏泄,则气血运行不畅,气滞血瘀;肝主筋,筋连接骨和关节,肝虚则筋骨肌肉无以濡养。而地黄味甘、苦,性寒,归肝、肾经,具有补血滋阴,益髓填精的功效。《本草纲目》中“填骨髓、长肌肉、生精血”的描述肯定了地黄对筋骨肌肉虚劳诸证的补益作用。已有研究证明,其提取物的活性成分有促进骨形成及抑制骨吸收等作用,常被组方应用于OP的预防及治疗[4]。临床治疗中地黄多运用于六味地黄丸、血府逐瘀汤等经典组方,其临床功用得到充分证实。然而,其单体作用机制仍未被完全阐述清晰。综上,本文欲通过总结地黄活性成分治疗OP的相关文献,以期探讨其防治OP的作用机制,望能在防治OP的基础、临床方面提供一些新思路。
1 地黄活性成分治疗OP的相关研究
现代药理学的研究显示,地黄分离的活性成分包括环烯醚萜苷类、苯乙醇苷类等(表1)。在这些化合物的作用下,地黄发挥了抑制氧化应激、抑制肿瘤发展、缓解炎性反应等多种功效[5]。近年来,多项治疗OP的研究表明,地黄及其活性成分可以调节多种与OP相关的信号通路中重要靶细胞的表达,是当前OP药物防治研究领域的热点。

表1 地黄主要活性成分Table 1 Main active ingredients of Rehmannia glutinosa Libosch
1.1 环烯醚萜苷类化合物
环烯醚萜苷类化合物(iridoid/secoiridoid glycosides)属于单萜类化合物,在龙胆科和玄参科等植物中较为常见[6]。研究发现,环烯醚萜苷的各种生物活性在治疗OP方面发挥了重要作用。梓醇(Catalpol)、桃叶珊瑚苷(Aucubin)、京尼平苷(Geniposide)属于中药地黄环烯醚萜苷类化合物中分离得到的主要化学成分,在治疗OP、肿瘤、糖尿病等多种疾病中都起到了令人满意的效果。Chen等[7]研究表明,梓醇可以通过激活信号转导与转录激活因子3(signal transducers and activators of transcription 3,STAT3)从而增强骨髓间充质干细胞(bone mesenchymal stem cell, BMSC)以及其介导的血管生成。同时,体内实验中还证实,梓醇可加速双侧卵巢切除大鼠模型的骨修复并促进血管生成。此外Ha等[8]研究发现,京尼平苷被认为对OP的治疗有作用,因为它们参与成骨细胞的细胞增殖,并抑制破骨细胞的细胞增殖。还有研究表明,桃叶珊瑚苷具有强大的抑制OP的作用,不仅可以增加成骨细胞的分化,同时也能抑制骨吸收,从而促进皮质骨厚度及密度增大[9]。本文对环烯醚萜苷类化合物参与抗OP的机制研究实验进行了汇总(表2),为将来其成为OP治疗候选药物提供一定理论支持。
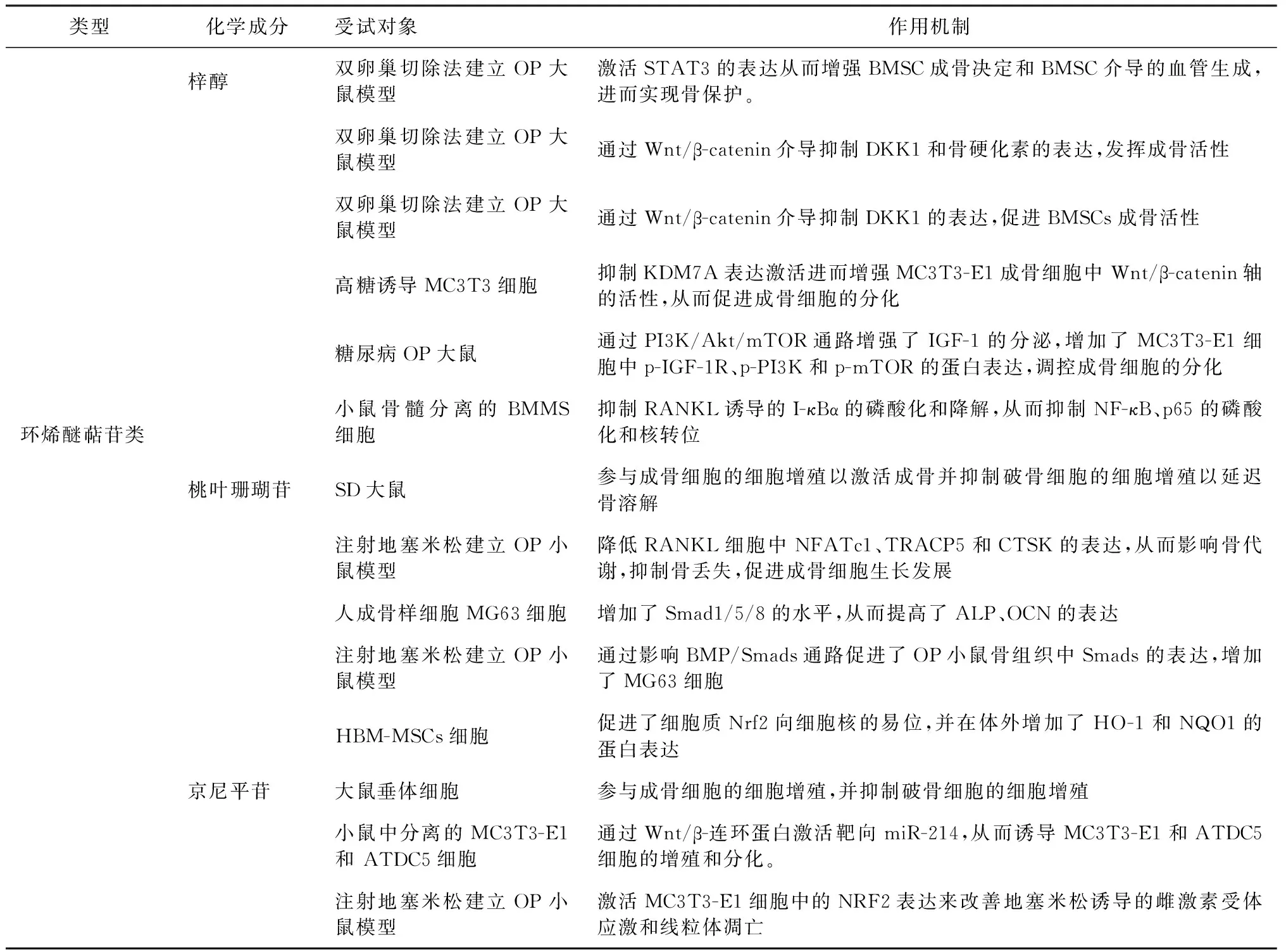
表2 环烯醚萜苷类化合物治疗OP的研究模型及作用机制Table 2 Research model and mechanism of action of iridoid in the treatment of OP
1.2 苯乙醇苷类化合物
苯乙醇苷类化合物(phenylethanoid glycosides)是一类天然糖苷类化合物。目前已经从地黄中分离出多种苯乙醇苷类化合物,其中主要化学成分包括毛蕊花糖苷(Verbascoside/Acteoside)和松果菊苷(Echinacoside)等。其具有抗OP、缓解炎性反应和抑制氧化应激的功能。Yang等[10]发现,毛蕊花糖苷主要是通过下调RANKL/核因子κB受体激活因子( receptor activator of nuclear factor kappa B,RANK)通路、抑制核转录因子-κB(nuclear factor κb,NF-κB)和刺激磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)信号通路,从而调控下游蛋白靶点的表达,进而改善骨小梁的结构和恢复骨骼生理状态。还有研究表明,毛蕊花糖苷减少了肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)所介导的炎症产生,这与活性氧类(reactive oxygen species,ROS)减少一起有助于抑制破骨细胞生成,增加了成骨细胞的增殖和分化,而且毛蕊花糖苷通过改善小梁微结构和骨生物力学能力,在双侧卵巢切除术小鼠中表现出预防骨质流失的潜在作用(表3)[11]。
2 地黄活性成分治疗OP的相关信号通路
2.1 Wnt/β-catenin通路
众所周知,成骨细胞的分化及成熟过程中,Wnt/β-连环蛋白(β-catenin)信号通路发挥了重要作用。在缺乏Wnts时,糖原合成激酶-3β(glycogen synthesis kinase-3β,GSK-3β)将下游的目标靶β-catenin磷酸化。Wnt3a与Frizzleed以及低密度脂蛋白受体相关蛋白5或6(LDL-receptor-related protein,LRP5/6)共受体结合,从而诱导β-catenin磷酸化,进而稳定细胞质内LRP5/6,更重要的是这一过程下调了GSK-3β活性,并引起β-catenin积累,最终使β-catenin转位到细胞核,与核转录因子T细胞因子/淋巴增强子因子(T cell factor/lymphoid enhancer factor,TCF/LEF)相结合,使相关蛋白靶基因活性提高,进一步促进了成骨细胞的分化和增殖[12-13]。而Dickkopf相关蛋白1(Dkk1)和骨硬化素可以通过抑制Wnt/β-catenin信号通路发挥作用,使成骨细胞的活性降低,并且进一步降低骨形成的程度,因而导致OP[14]。
有研究表明,梓醇能抑制去势OP大鼠Dkk1和骨硬化素的表达,并降低磷酸化的β-catenin与β-catenin的比值,使β-catenin的核转位增加,从而激活TCF/LEF转录因子,进而促进β-catenin下游成骨细胞特异性转录因子2(runt-related transcription factor 2,Runx2)激发活性,发挥成骨的作用[15]。Zhu等[16]的研究也同样表明,梓醇可促进BMSC成骨并防止卵巢切除后诱导的骨丢失。根据他们的结果,梓醇的促成骨作用与Wnt/β-catenin通路的激活有关,因为梓醇处理后P-GSK-3β、总β-catenin和核β-catenin的表达水平显着增强。研究表明,京尼平苷实现抗OP的作用是通过抑制小核酸分子(microRNA-214)的活性,从而上调了Wnt/β-catenin信号通路,促进前成骨细胞及软骨细胞ATDC5的增殖及成熟[17]。此外,京尼平苷还通过在体内外激活胰高血糖素样肽-1受体(glucagon like peptide-1 receptor,GLP-1R)表达来改善地塞米松诱导的OP。由此可见,地黄及其活性单体治疗OP的过程中可以通过Wnt/β-catenin信号通路多靶点的调控成骨细胞,进而影响骨代谢,促进骨形成,这为OP的治疗提供了理论支持(图1)。
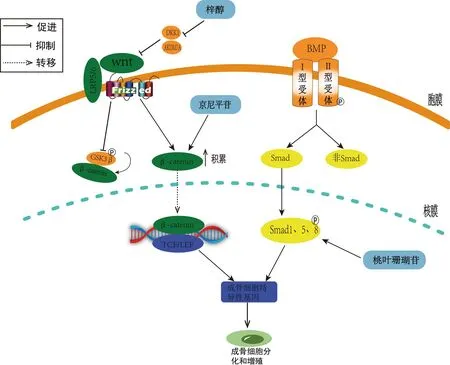
图1 地黄及其活性单体介导Wnt及BMP/Smads信号通路抗OP的作用机制Fig.1 Mechanism of Rehmannia glutinosa Libosch and its active monomers mediating Wnt and BMP/Smads signaling pathways against osteoporosis
2.2 BMP/smads通路
影响成骨细胞的关键信号通路是骨形态发生蛋白(bone morphogenetic protein,BMP)/Smads信号通路[18]。作为BMP配体成员的BMP2表现出高成骨活性,明显增加骨钙素表达,促进骨和软骨形成。BMP与两种类型的跨膜Ser/Thr激酶受体结合,包括I型受体和II型受体,以激活Smads和非Smads信号[19]。Smad有助于将BMP信号从受体传递到靶基因,促进Smad1、5、8等转导因子磷酸化后翻译到细胞核中,激活RUNX2转录表达,以促进早期成骨mRNA的表达[20],从而调节骨桥蛋白(osteopontin,OPN)、碱性磷酸酶(alkaline phosphatase,ALP)和骨钙素(osteocalcin,OCN)等特定成骨细胞分化标志物的表达水平来激活骨形成。
有研究表明,桃叶珊瑚苷强烈增加了Smad1/5/8的水平,从而提高了ALP、OCN的表达,进一步促进骨生成,充分证明BMP2介导Smads信号传导在促进成骨细胞分化过程中具有重要意义[21]。Li等[22]的研究也同样表明桃叶珊瑚苷增加了MG63细胞,以及通过影响BMP/Smads通路促进OP小鼠骨组织中BMP2、P-Smads的表达,因而有利于分化成骨细胞,进一步提高骨骼密度,实现抗OP效果。由此可见,通过调控BMP/Smads通路地黄及其活性成分对成骨细胞的分化具有促进作用,提高骨密度,最终实现抗OP(图1)。
2.3 PI3K/Akt轴
作为一个重要信号通路,PI3K/Akt轴在细胞存活、分化和生长的控制中起着不可替代的作用,并具有与其他信号通路和转录网络相互作用的能力,最终控制骨细胞分化[23]。在破骨细胞方面,PI3K/Akt信号级联在破骨细胞生成过程中调节c-Fos表达,进而调节破骨细胞功能[24]。活化T细胞核因子1(nuclear factor of activated T cells 1,NFATc1)是一种特异性转录因子,可调节破骨细胞特异性基因抗酒石酸酸性磷酸酶5(tartrate-resistant acidphosphatase 5,Tracp5)、组织蛋白酶K(cathepsin K,CTSK)等的表达,提高破骨细胞成熟增殖活性。Akt磷酸化的增加显着促进了c-Fos的激活[25],从而上调破骨细胞标记基因(TRACP5、CTSK等)。在成骨细胞方面,胰岛素样生长因子-1(insulin-likegrowthfac-tor-1,IGF-1)具有调控成骨细胞合成代谢的作用[26]。PI3K/Akt/mTOR通路与Runx2在调控成骨细胞分化的过程中相互依赖。PI3K亚基和Akt的蛋白质水平被Runx2提高,而PI3K/Akt/mTOR通路极大地加强了Runx2以及Runx2依赖性转录的基因结合。正是因为这种正反馈循环,Runx2在成骨细胞分化及其迁移中的活性得到进一步促进了,从而加快成骨细胞的生长。
Jang等[27]发现松果菊苷可以抑制PI3K/Akt/c-Fos通路,下调PI3K表达、降低Akt磷酸化水平和降低c-Fos表达,从而实现了对破骨细胞增殖成熟能力的下调。Gong等[28]发现,梓醇通过PI3K/Akt/mTOR通路不仅增强了IGF-1的分泌,而且增加了成骨细胞MC3T3-E1细胞中p-mTOR、p-IGF-1R和p-PI3K的蛋白表达,并激活Runx2的调控,进而上调了成骨细胞活性,实现了对OP的抑制作用。Li等[29]发现地塞米松抑制了PI3K/Akt/mTOR通路中关键蛋白的水平,而毛蕊花糖苷减弱了这种抑制作用,并且上调了成骨细胞活力。由此可得,地黄及其活性成分在可以通过PI3K/Akt通路选择相应的靶点,从而达到上调成骨细胞成熟分化,抑制破骨细胞骨破坏活性的作用,这为治疗OP提供了更多选择(图2)。
2.4 OPG/RANKL/RANK通路
骨保护素(osteoprotegerin,OPG)/RANKL/RANK信号通路在骨吸收和骨重建过程中发挥重要的调控作用,是破骨细胞分化成熟过程中的关键信号途径[30]。RANKL与其受体RANK之间的相互作用,这会导致各种下游信号通路的激活,从而诱导破骨细胞生成相关基因的表达。RANKL作为刺激破骨细胞的调控靶点之一,其作用是通过与RANK结合导致破骨细胞前体增殖、成熟来完成的。OPG可以与RANK的结合,从而降低RANKL与RANK结合的比例,进而达到降低破骨细胞相关活性表达的目的。白细胞介素1(interleukin-1,IL-1)是一种促进炎症反应的细胞因子,它能够通过刺激IL-6的活性而增加破骨细胞的表达,从而增强破骨细胞的功能并促进RANKL的表达,从而使NF-κB受体与RANKL结合,促进破骨细胞的增殖。RANKL信号诱导c-Fos与NFATc1结合,NFATc1立即刺激破骨细胞TRACP和CTSK等相关基因的活性。CTSK可以分解部分骨基质蛋白,如I型胶原(collagen type I,Col I),进而影响骨代谢,促进骨丢失。
Zhang等[31]发现桃叶珊瑚苷显著降低OP小鼠血清中IL-1的浓度,降低RANKL细胞中NFATc1、TRACP5和CTSK的表达,从而抑制骨丢失,而且他们发现梓醇可以刺激RANK诱导磷酸酶及张力蛋白基因(phosphatase and tensin homolog deleted on chromosome ten, PTEN)磷酸化,从而抑制破骨细胞的形成。还有研究表明,松果菊苷可以增强成骨细胞分化和矿化,包括成COL I分泌以及OPG产生,同时降低RANKL蛋白含量,达到促进成骨细胞生长,减少破骨细胞的生成[32]。Meng等[33]发现梓醇通过抑制RANKL引起核因子κB抑制因子A ( recombinant inhibitory subunit of NF kappa B alpha,IκBα)磷酸化来抑制NF-κB、p65之磷酸化与核转位,降低NFATc1的mRNA和蛋白表达水平,因此TRACP、CTSK等基因表达也随之受到抑制,从而达到了抗OP的作用。综上,炎性因子与OPG/RANKL/RANK信号通路有着紧密的联系,可以促进RANKL的表达而地黄及其活性成分可以抑制炎性因子并通过调控该通路抑制破骨细胞,最终达到抗OP的目的(图3)。
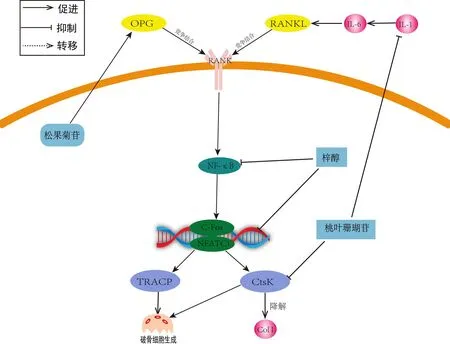
图3 地黄及其活性单体介导OPG/RANKL/RANK通路抗OP的作用机制Fig.3 Mechanism of Rehmannia glutinosa Libosch and its active monomers mediating the OPG/RANKL/RANK pathway against osteoporosis
2.5 Keap1/Nrf2通路
氧化应激是氧化和抑制氧化之间平衡被打破的结果,氧化应激可以促进破骨细胞分化导致OP的发生。核因子E2相关因子2 (nuclear factor erythroid 2 related factor, Nrf2)是细胞氧化还原平衡的关键[34]。从生理状态上看,Nrf2中Neh2结构域和Kelch样环氧氯丙烷有关蛋白(kelch-like ECH-associated protein 1,Keap1)稳定地结合于细胞质中,处于非活性状态。Keap1是泛素-蛋白质连接酶(ubiquitin-ligase protein,E3)的适应蛋白,负责Nrf2的持续泛素化和降解[35]。当大量ROS激发细胞发生氧化应激反应时,叉头转录因子O亚型(forkhead box O,FoxO)被激活,下调了成骨细胞的增殖能力并加快骨细胞的衰亡,但Nrf2磷酸化后与Keap1解离并发生核易位,与抗氧化反应元件(antioxidant response elementt,ARE)在核内相结合,诱导下游血红素氧合酶(heme oxygenase-1,HO-1)、醌氧化还原酶-1(NADH-oxidoreductase-1,NQO1)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)及超氧化物歧化酶(superoxide dismutase,SOD)等抗氧化酶表达,极大地抑制了氧化应激[36]。HO-1则被认为是促进Nrf2抗氧化和抗炎的重要媒介[37]。这些内源性保护物质由酶降解物构成,具有促进机体抗炎及抑制氧化的能力[38-39],从而抑制ROS对细胞的刺激,进而抑制ROS减弱成骨细胞形成的能力。
Wang等[40]发现桃叶珊瑚苷促进了细胞质Nrf2向细胞核的易位,并在体外增加了HO-1和NQO1的蛋白表达,表明了桃叶珊瑚苷改善了由氧化应激引起的成骨抑制,从而表明桃叶珊瑚苷改善氧化应激是通过Nrf2介导的信号通路实现的。Xiao等[41]发现京尼平苷可以触发Nrf2信号的表达,通过激活MC3T3-E1细胞中的Nrf2表达来改善地塞米松诱导的雌激素受体应激和线粒体凋亡,从而达到抗OP的作用。由此可见,地黄及其活性成分可以通过调控Keap1/Nrf2通路来逆转氧化应激引起的损伤及对成骨细胞的抑制。近年来,氧化应激被作为导致OP的重要因素,被越来越多的学者所关注,但目前相关文献还有所欠缺,对其作用机制的研究还不够深入,因此后续还需要研究者进一步借助不同学科的方法,多方面的从分子层面深入研究其作用机理(图4)。
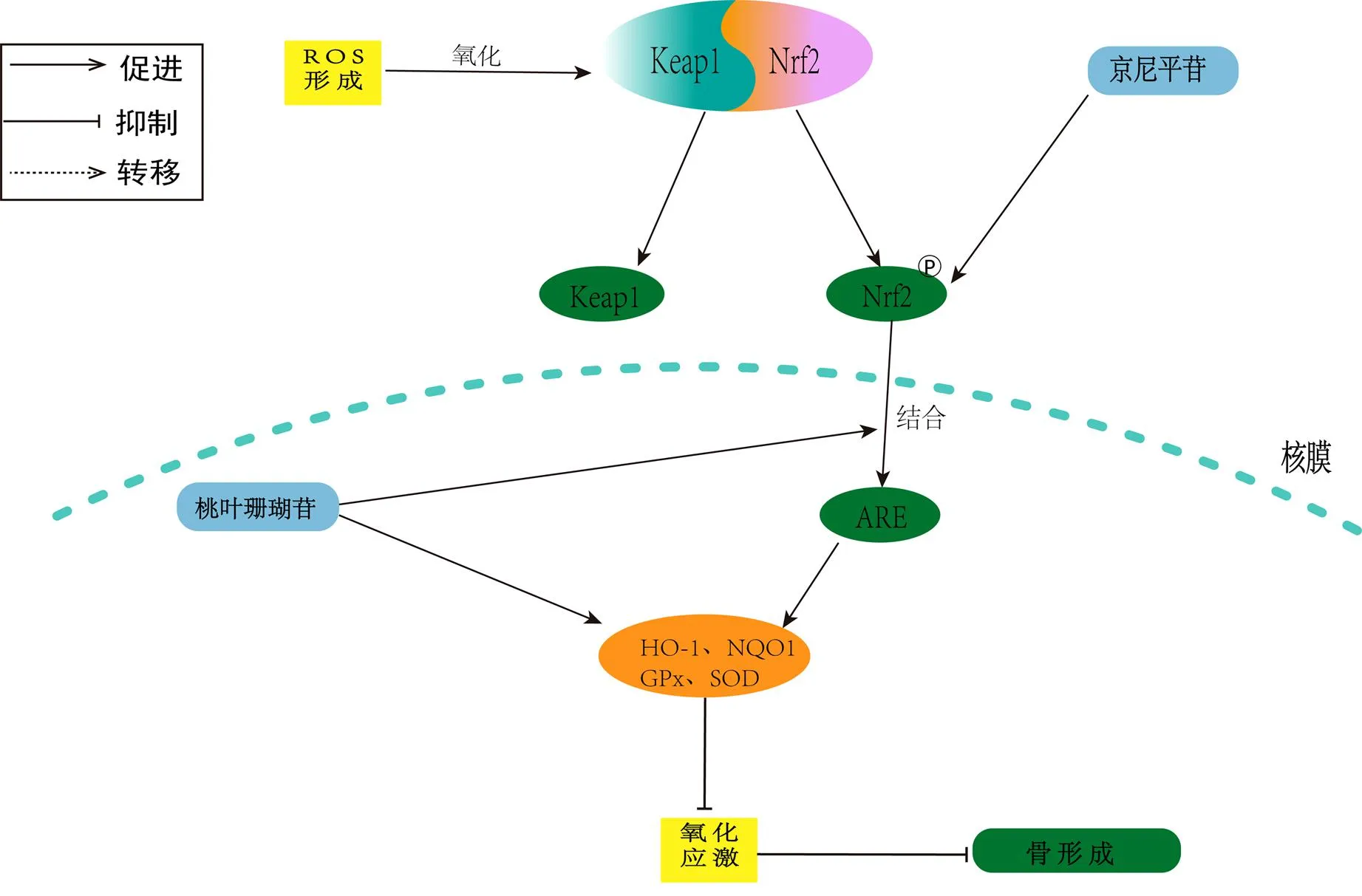
图4 地黄及其活性单体介导Keap1/Nrf2通路抗OP的作用机制Fig.4 Mechanism of Rehmannia glutinosa Libosch and its active monomers mediating Keap1/Nrf2 pathway against osteoporosis
3 小结和展望
目前有关地黄防治OP的研究大多围绕在单一成分展开,但是中医治疗具有多层次、多系统的特点,因此本文通过总结近年来地黄及其活性单体在防治OP领域的相关研究,系统的探讨地黄及其活性单体防治OP作用机理,并通过总结发现其对成骨细胞的作用主要是通过调控Wnt/β-catenin通路、BMP/smads通路及PI3K/Akt/mTOR通路实现的。以上三个通路均可以调控其靶点,从而促进RUNX2等成骨因子的转录表达,最终起到防治OP的作用。而在破骨细胞方面地黄通过调控OPG/RANKL/RANK以及PI3K/Akt/c-Fos通路,实现了对破骨细胞的抑制,进而减少了骨吸收。此外地黄可以通过Keap1/Nrf2通路调控氧化活性,清除ROS,从而减少氧化应激对成骨细胞的抑制,调控骨内稳态。
本文在总结过往文献时发现PTEN作为一种多功能分子,表达于各种类型的细胞中,调节多种细胞过程,其常常被认为是一种重要的抑癌因子,但近几年有研究表明,PTEN可以通过对RANKL诱导的Akt和NF-κB信号的负性调节来抑制RAW264.7细胞中RANKL诱导的破骨细胞的形成,起到抗OP的作用[42]。有研究表明,葛根素可以通过PI3K/Akt通路上调PTEN的表达,从而下调p-Akt蛋白的激活,进而抑制破骨细胞活性[43]。由此可见,除了地黄以外,还有许多潜在的活性成分可以通过该机制治疗OP。因此开展更多活性成分通过干预PTEN治疗OP的研究可以为调控相关通路治疗OP的作用靶点提供新的依据,而且可以挖掘出更多治疗OP的活性成分,为防治OP提供更多的选择。此外,地黄活性成分的研究主要集中在环烯醚萜苷类及苯乙醇苷类。但对其他类别研究较少,这极大地限制了地黄及其活性成分的开发与利用,研究者可以展开更细致的研究,这或许可以促进地黄防治OP作用机制的综合理解。
综上所述,本文总结和探讨了地黄及其活性成分抗OP作用和调控机制,有助于提高对地黄及其活性成分药理作用的认识,可以促进其药理研究,进而加快制剂研发,成为临床防治OP的新策略。

