甲基化酶WTAP通过调控FOXO1的表达参与肾缺血再灌注损伤
赵刚刚,李华锋,张鸿毅,肖克兵,杨 辉,李子峰,傅崇德
1西安医学院第一附属医院泌尿外科,陕西 西安 710000;2西安航天总医院泌尿外科,陕西 西安710100
急性肾损伤(AKI)是一种常见的肾功能突然丧失的临床综合症,表现为血清肌酐显著升高和尿量迅速减少,最终可逐渐发展为慢性肾病和终末期肾病,重症患者可导致死亡[1]。肾脏缺血再灌注损伤(I/RI)是导致AKI的主要原因之一,在过去的几十年里,有关肾脏的I/R损伤在该领域得到了广泛的研究[2]。然而,肾脏I/RI的发病机制十分复杂,尚未完全阐明[3,4]。因此,更为透彻地了解肾I/RI的病理生理反应对预防和治疗AKI具有重要的意义。
N6-甲基腺甘氨酸(m6A)是mRNA修饰物中含量最多的一种,存在于整个转录组四分之一的RNA中[5,6],与各种生物过程有关如干细胞增殖与分化、心脏肥厚、DNA损伤和肿瘤发生等[7],而这种RNA修饰在AKI和I/RI中的功能作用和调控机制研究较少。Wilms瘤1-相关蛋白(WTAP)是一种重要的m6A甲基化酶,可通过调节mRNA修饰来影响基因表达。WTAP在膀胱癌、急性髓系白血病等多种疾病中参与调控增殖、凋亡等过程[8,9]。值得注意的是,WTAP通过调节ATF4 mRNA的m6A修饰增加内质网应激,促进了心肌I/R损伤[10],但WTAP在AKI和肾I/R损伤中的作用目前仍未见报道。
叉头蛋白O1(FOXO1)是叉头转录因子家族中的一员,在哺乳动物中广泛表达,具有调节细胞增殖、凋亡、自噬、氧化应激和能量代谢等功能[11]。FOXO1已被证明在肾I/R损伤中高表达,促进了线粒体相关的细胞凋亡,在维持肾小管上皮细胞线粒体功能发挥关键作用[12]。有关FOXO1的m6A修饰研究较少,有报道称METTL14通过增加FOXO1的m6A修饰加重内皮细胞炎症和动脉粥样硬化[13]。但FOXO1的m6A修饰在肾I/R损伤中的作用仍未见研究。
因此,本项目通过构建肾I/R损伤小鼠模型和缺氧/复氧(H/R)诱导的肾小管上皮细胞损伤模型,体内外探讨WTAP介导的m6A修饰在肾I/R损伤中的作用,并明确该作用是否与调控FOXO1表达有关,旨在为肾I/R损伤和AKI的防治提供新的分子靶点。
1 材料和方法
1.1 材料
1.1.1 实验动物和细胞 实验所用C57BL/6J小鼠购自空军军医大学动物实验中心;将6~8周龄小鼠常规条件下饲养,自由进食和饮水,实验前禁食12 h,自由饮水;所有动物实验经西安医学院第一附属医院伦理委员会批准(XYYFY2022LSDW-001),实验过程遵循“3R”原则;人肾小管上皮细胞(HK-2细胞)购自ATCC细胞库。
1.1.2 主要试剂和仪器 凋亡(TUNEL)检测试剂盒(南京诺唯赞医疗科技有限公司);尿素氮(BUN)及血肌酐(Scr)试剂盒(南京建成科技有限公司);m6A甲基化水平检测试剂盒(武汉艾美捷科技有限公司);CCK-8试剂盒(上海碧云天生物技术有限公司);反转录试剂盒、SYBR Green混合液(TaKaRa);蛋白裂解液和BCA蛋白定量检测试剂盒(上海碧云天生物技术有限公司);10%PAGE 凝胶剂盒(上海雅酶生物科技有限公司);ECL 化学发光底物(西安米鼠生物科技有限公司);m6A、WTAP、FOXO1、GAPDH 抗 体(ProteinTech);LDH检测试剂盒(南京诺唯赞医疗科技有限公司)。小动物麻醉系统(瑞沃德生命科技有限公司);全自动血生化分析仪(中山新锐医疗设备科技公司);实时定量PCR仪(苏州雅睿生物技术有限公司);化学发光机(北京赛智创业科技有限公司);电泳仪、多功能酶标仪和凝胶成像分析仪(Bio-Rad);倒置显微镜(上海维翰光电科技有限公司);细胞培养箱(北京五洲东方科技发展有限公司);厌氧箱(上海龙跃仪器设备有限公司)。
1.2 方法
1.2.1 FOXO1 的甲基化位点预测 从NCBI(https://www.ncbi.nlm.nih.gov/)得到FOXO1的mRNA FASTA序列,将此序列复制到SRAMP(http://www.cuilab.cn/sramp/)网站“Predition”阅读框内,点击“submit”进行预测。
1.2.2 肾I/R损伤模型的构建 选取16只雄性C57BL/6J小鼠(6~8 周,体质量20~25 g),随机分为假手术组(Sham)和肾脏缺血再灌注损伤组(I/R),每组8只小鼠;所有小鼠在造模前12 h 禁饮禁食;术前先称量小鼠体质量,并进行记录;2%异氟烷麻醉(固定过程流量为3 L/min);造模过程(1.5 L/min)进行麻醉,并行右肾切除术,然后用无损伤血管夹阻断左肾动静脉45 min,随后恢复左肾动静脉血流,建立肾脏缺血再灌注模型。整个建模过程中善待小鼠,熟练操作,最大限度减少对小鼠的伤害。
1.2.3 样本收集 造模后24 h,采用苯巴比妥钠腹腔注射麻醉,行腹部正中切口,切取左肾,将肾脏组织纵行剖开,一半放入4%多聚甲醛液中固定,另外一半再分成两份,一份用于组织染色使用,另一份放入冻存管中并放入液氮罐保存。取材时极尽小鼠最大科研价值,结束后立即用CO2安乐死的方式处死小鼠,减轻其痛苦。
1.2.4 肾功能检测 收集各组小鼠血液,分离血清后用根据试剂盒说明书,采用比色法,用全自动生化分析仪检测肌酐及尿素氮水平。
1.2.5 肾组织病理学检测 肾组织病理学检测取各组小鼠肾组织4%甲醛固定48 h后石蜡包埋制作切片,切片厚度大约为5 μm,进行HE染色,在200倍荧光显微镜下观察肾组织损伤情况。
1.2.6 免疫组织化学染色 包埋、切片和脱水同HE染色步骤。将3%双氧水滴加于切片上,37℃阻断内源性过氧化物酶20 min;流水冲洗20 min;将切片浸没在现配的柠檬酸钠中进行抗原修复(微波炉高火6 min;中高火13 min);自然晾至室温;使用5%山羊血清室温封闭15 min;吸去多余血清,滴加一抗,室温过夜;PBS洗切片(3 次/5 min);滴加二抗,37 ℃孵育40 min;PBS 洗切片(3次/5 min);DAB显色液滴加于切片上(显色0.5~3 min);镜下控制,着色深立即终止;流水冲洗10 min;苏木精染核3~5 min,自来水冲洗5 min;0.5%的盐酸酒精分化1 s,自来水冲洗2 min:1%氨水返蓝3 min,流水冲洗5 min;脱水封片步骤同HE染色,最后显微镜下拍照。
1.2.7 细胞凋亡染色 根据TUNEL 染色试剂盒说明书操作。4,6-二脒基-2-苯基吲哚二盐酸盐(DAPI)所染细胞核在紫外激发波下呈蓝色(即为视野所见所有肾小管上皮细胞),阳性凋亡细胞核为绿色。使用Eclipse Ci-L荧光拍照显微镜选取切片的目的区域进行200倍成像。成像完成后使用Image-Pro Plus 6.0分析软件,分别测量每张切片5个视野中阳性细胞数以及对应的总细胞数,并计算出阳性率(%)=阳性细胞数/总细胞数×100%。
1.2.8 qRT-PCR法检测mRNA水平 收集的组织/细胞用TRIZOL提取总RNA。TaKaRa反转录试剂盒反转录为cDNA;然后根据实时定量PCR试剂盒说明书配制PCR反应体系,程序为:95 ℃预变性30 s,(95 ℃变性5 s,60 ℃延伸30 s)×40个循环,GAPDH作为内参,2-△△Ct法计算基因表达水平。
1.2.9 Western blot法检测蛋白表达情况 RIPA裂解液提取总蛋白。BCA试剂盒定量蛋白浓度。上样进行聚丙烯酰氨凝胶电泳(80 V,30 min;120 V,60 min),300 mA电流转膜90 min,50 g/L脱脂牛奶封闭1 h。孵育相应一抗进行4 ℃过夜;TBST 清洗后,室温孵育二抗1 h;TBST清洗3次后进行显影并拍照。
1.2.10 HK-2细胞H/R模型构建和转染 人肾小管上皮细胞株(HK-2)细胞用新鲜的含10%FBS 的DMEM/F12(1∶1)完全培养基于37 ℃、5%CO2的细胞培养箱中进行培养,选对数生长期的细胞根据实验分组均匀铺板。
HK-2细胞H/R模型构建:细胞分为Control组和H/R组待细胞完全贴壁后,弃去培养液,加入不含FBS的无糖培养基,放入厌氧箱中缺氧24 h,除去细胞缺氧液,加入新鲜的DMEM/F12完全培养基于CO2细胞培养箱中复氧培养6 h。
细胞转染:细胞以5×104/孔铺于6 孔细胞培养板,待细胞贴壁长至70%左右时,换成无血清培养基,将Lipofectamine™2000 转染试剂和si-NC、si-WTAP干扰片段混匀静置5~10 min,将混合液体均匀加入每个孔中,4~6 h后进行换液,继续培养24、48 h后,收集细胞用于后续实验。
1.2.11 HK-2细胞活性检测 将各组细胞悬液分别接种于96孔板中,每孔中含5×103个细胞,培养2~4 h后,设空白孔(完全培基和CCK-8总体积110 μL)和对照孔(含正常培养细胞、完全培基和CCK-8,总体积110 μL),周边各孔加100 μL去离子水减少边缘效应,各组细胞均处理完成后,在各孔中斜贴培养板滴加CCK-8 溶液10 μL,然后于37 ℃、5%CO2的细胞培养箱内孵育1~4 h(根据显色情况调整时间),用酶标仪检测各孔的A450nm值判断细胞活性。
1.2.12 HK-2细胞培养液LDH释放水平检测 吸取各组细胞培养液500 μL,每组设置两组重复,全自动血生化仪进行检测。
1.2.13 Caspase3 活性检测 收集细胞样本后根据Abcam试剂盒说明书进行检测。
1.2.14 甲基化RNA免疫共沉淀后实时定量PCR(Me-RIP qPCR)RNA 提取试剂盒提取总RNA,PolyA mRNA 纯化试剂盒纯化提取的总RNA。将小鼠抗人m6A 抗体和IgG 的抗体分别添加到免疫共沉淀(IP)缓冲液中,并与蛋白质A/G 磁珠孵育1 h进行结合。然后将纯化的mRNA以及磁珠-抗体复合物加入到含有核糖核酸酶抑制剂和蛋白酶抑制剂的IP缓冲液中,于4℃下孵育过夜。将使用洗脱缓冲液洗脱下的RNA,用苯酚-氯仿法提取、纯化后,用实时定量PCR分析。
1.2.15 统计学分析 所有数据采用GraphPad Prism8.0.2软件进行统计分析,每种实验至少重复3 次,实验结果以均数±标准差表示,两组之间的比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 小鼠肾I/R损伤组织中WTAP的表达上调
全自动血生化分析仪检测了小鼠肾I/R损伤后的血清肌酐和血尿素氮的水平,与sham组相比,I/R组血清肌酐、尿素氮显著升高(P<0.001,图1A、B);HE染色结果显示,与sham组相比,I/R组肾组织产生病理性改变,表现为肾小球皱缩,肾小囊腔和肾小管腔扩张,上皮细胞肿胀坏死,细胞核缺失,细胞碎片堆积(图1C);qRT-PCR 结果显示,与sham 组比较,I/R 组WTAP 的mRNA水平显著升高(P<0.001,图1D);Western blot结果显示,与sham组比较,I/R组WTAP蛋白的表达水平显著上升(P<0.001,图1E);IHC结果显示I/R后WTAP阳性面积显著增多(图1F)。
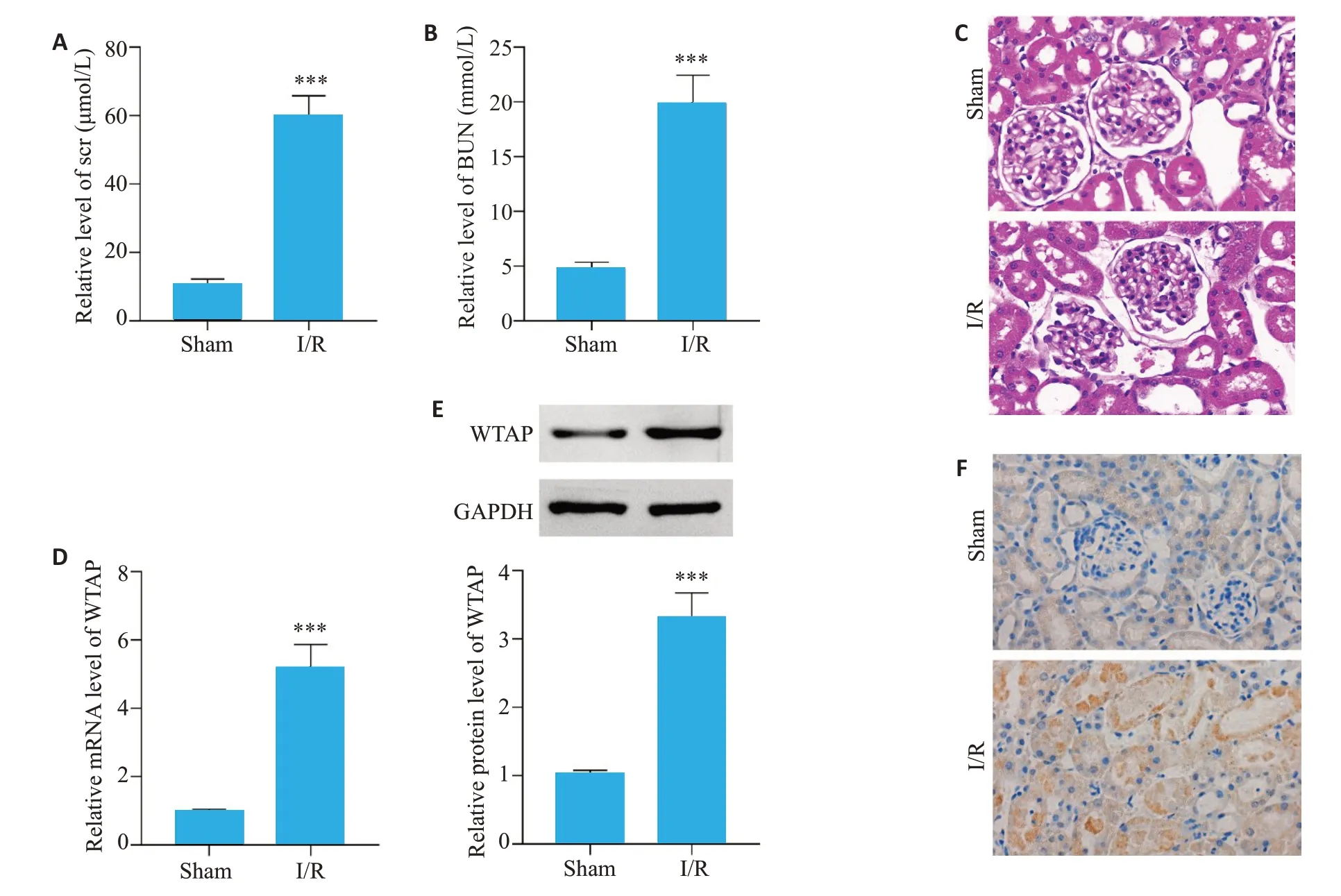
图1 WTAP在小鼠肾I/R损伤组织中的表达情况Fig.1 Expression of WTAP in mouse renal I/R injury tissues.A: Serum creatinine level in mice with renal I/R injury.B: Blood urea nitrogen level in mice with renal I/R injury.C: Pathological changes of the kidney in mice with renal I/R injury(HE staining,original magnification:×400).D:WTAP mRNA level in the kidney of mice with renal I/R injury.E:Changes of WTAP protein expression after renal I/R injury in mice.F:Expression of WTAP after renal I/R injury in mice(IHC,×200).***P<0.001.
2.2 HK-2细胞H/R损伤后WTAP表达上调
CCK-8细胞活性检测结果显示,与Control组比较,H/R组细胞活性显著降低(P<0.01,图2A);全自动血生化仪检测了细胞培养液中LDH的释放水平,与Control组比较,H/R组LDH的释放水平显著降低(P<0.001,图2B);qRT-PCR检测了WTAP的mRNA水平,结果显示,与Control组比较,H/R组WTAP的mRNA水平显著升高(P<0.001,图2C);Western blot结果显示,与Control组比较,H/R 组WTAP 蛋白水平显著升高(P<0.001,图2D)。

图2 WTAP在HK-2细胞H/R损伤中的表达情况Fig.2 Expression of WTAP in HK-2 cells with H/R injury.A:Changes of HK-2 cell viability after H/R injury.B:LDH release in HK-2 cells after H/R injury.C:WTAP mRNA level in HK-2 cells with H/R injury.D:Protein expression level of WTAP in HK-2 cells with H/R injury.**P<0.01,***P<0.001.
2.3 体外证明沉默WTAP对HK-2细胞H/R损伤作用的影响
通过转染siRNA对WTAP进行沉默,qRT-PCR鉴定干扰效果。与si-NC+H/R组相比,si-WTAP+H/R组WTAP的mRNA著降低(P<0.0001,图3A);与si-NC+H/R组相比,si-WTAP+H/R组WTAP蛋白水平显著降低(P<0.0001,图3B、C);细胞活性结果显示,与si-NC+H/R组相比,si-WTAP+H/R组细胞活性显著升高(P<0.01,图3D)。TUNEL染色结果显示,与si-NC+H/R组相比,si-WTAP+H/R组细胞凋亡率显著降低(P<0.01,图3E、F);Caspase-3活性结果显示,与si-NC+H/R组相比,si-WTAP+H/R组Caspase-3活性显著降低(P<0.001,图3G)。与si-NC+H/R组相比,si-WTAP+H/R组LDH释放水平显著降低(P<0.001,图3H)。
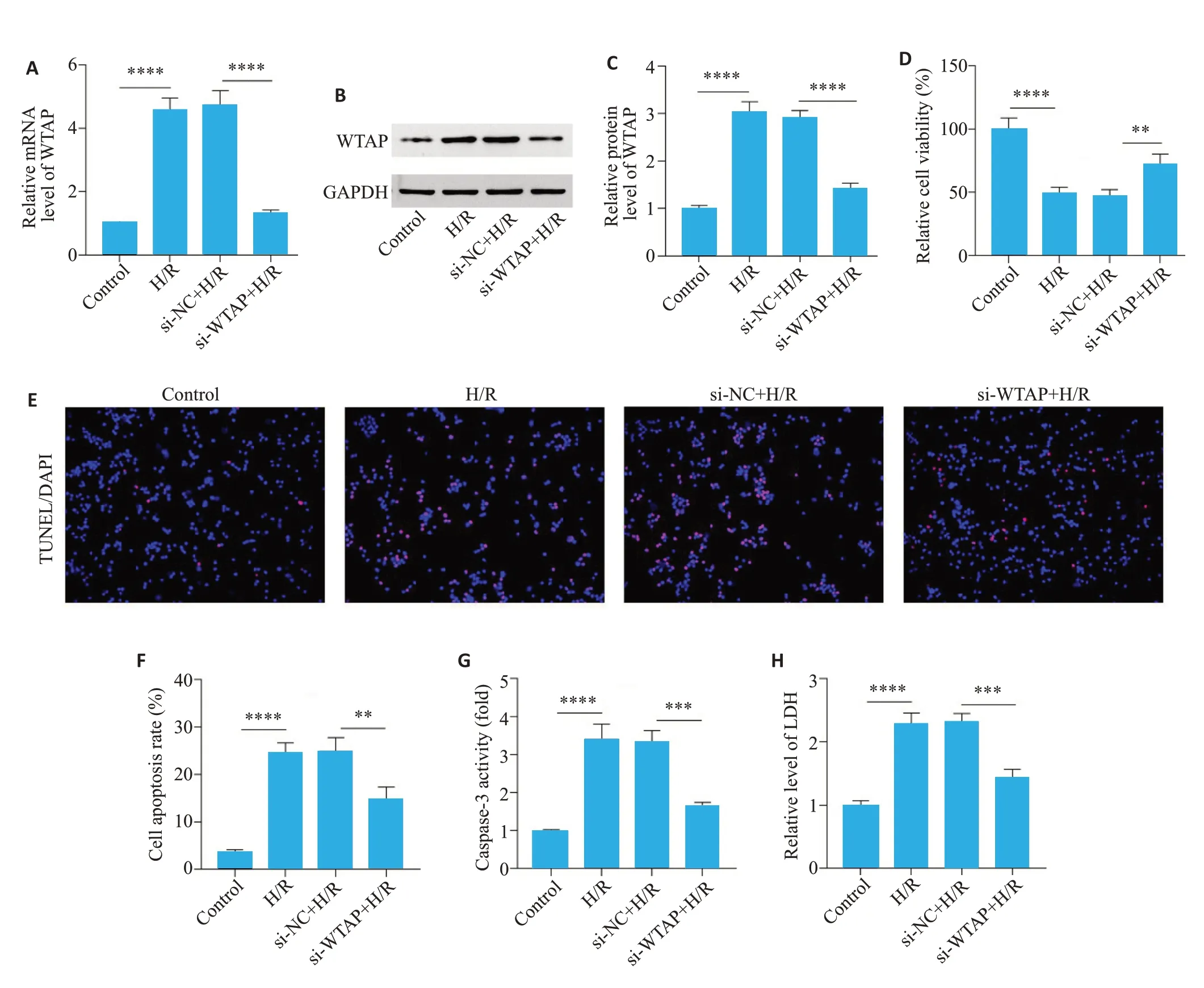
图3 沉默WTAP对HK-2细胞H/R损伤的影响Fig.3 Effect of WTAP silencing on cell damage in HK-2 cells with H/R exposure.A:WTAP mRNAexpression level in HK-2 cells with H/R injury after WTAP silencing.B,C: Protein expression level of WTAP in HK-2 cells with H/R injury after WTAP silencing.D:Cell viability changes in HK-2 cells with H/R injury after WTAP silencing.E:TUNEL staining of HK-2 cells with H/R injury after WTAP silencing(×200).F:Statistical diagram of HK-2 cells with H/R injury by TUNEL staining after WTAP silencing.G:Changes of Caspase3 activity in HK-2 cell with H/R injury after WTAP silencing.H:LDH release in HK-2 cells with H/R injury after WTAP silencing.**P<0.01,***P<0.001,****P<0.0001.
2.4 小鼠肾I/R 损伤组织和HK-2 细胞H/R 损伤中FOXO1 的mRNA和蛋白表达上调
与Sham组相比,在肾I/R损伤组织中,FOXO1的mRNA和蛋白的表达水平都显著升高(P<0.001,图4A、B);IHC 结果显示I/R 后,FOXO1 阳性面积较多(图4C);与Control组相比,H/R组细胞中FOXO1的mRNA和蛋白的表达水平也显著升高(P<0.001,图4D、E)。

图4 FOXO1在小鼠肾组织I/R损伤和HK-2细胞H/R损伤中的表达情况Fig.4 FOXO1 expression in renal tissue of mice with I/R injury and in HK-2 cells with H/R injury.A: FOXO1 mRNA level in mouse renal tissue.B:FOXO1 protein expression in mouse renal tissue.C:Expression of FOXO1 in mice after renal I/R injury(IHC,×400).D:FOXO1 mRNA level in HK-2 cells with H/R injury.E:Changes of FOXO1 protein expression in HK-2 cells with H/R injury.***P<0.001,****P<0.0001.
2.5 WTAP可直接作用于FOXO1 mRNA并与m6A调控有关
首先根据SRAMP(http://www.cuilab.cn/sramp/)网站预测可知,FOXO1具有多个m6A甲基化位点(图5A)。与si-NC+H/R组相比,si-WTAP+H/R组FOXO1 mRNA和蛋白水平都显著下降(P<0.01图5B、C);RIPqPCR 检测结果显示,与IgG 组相比,WTAP 抗体组FOXO1 的mRNA 水平显著上升(P<0.05,图5D);MeRIP-qPCR 结果显示,与si-NC+H/R 组相比,si-WTAP+H/R 组m6A-FOXO1 水平显著降低(P<0.001,图5E)。
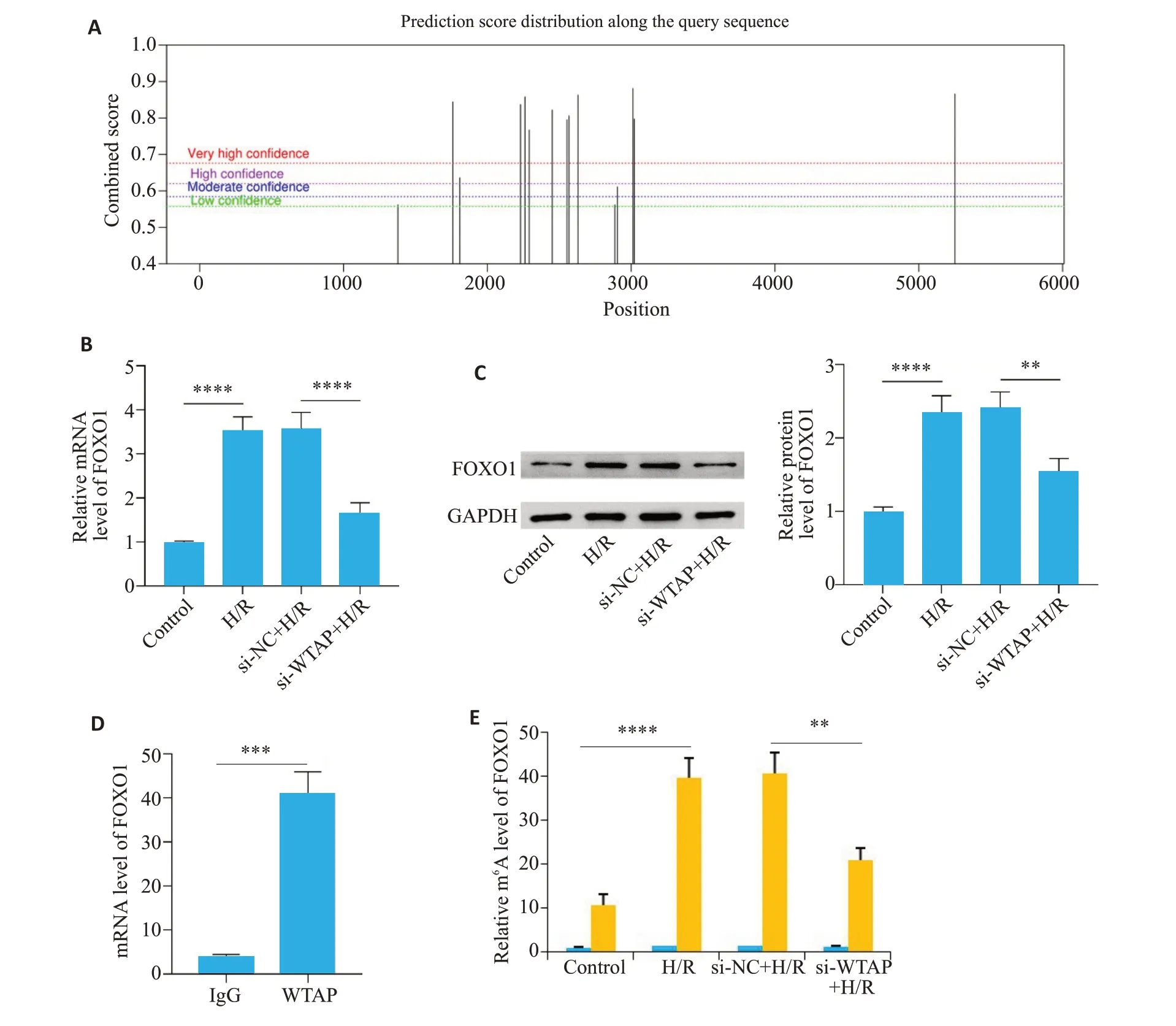
图5 WTAP通过FOXO1发挥作用及其m6A水平Fig.5 WTAP functions through FOXO1 and its m6A levels.A:Prediction of m6A modification site of FOXO1 using SRAMP.B:Changes of FOXO1 mRNA level after WTAP knockdown.C:Expression level of FOXO1 protein after WTAP knockdown.D:RIP experiment showing the interaction between WTAP and FOXO1.E:m6Alevel of FOXO1 detected by MeRIP-qPCR.**P<0.01,***P<0.001,****P<0.0001.
3 讨论
RNA修饰是一类重要的表观遗传修饰,通过影响RNA的稳定性和翻译来调节基因表达[14-16]。RNA甲基化占所有RNA修饰的60%以上,包括m6A、m5C、m3U、m7G等,其中m6A修饰是mRNA中最常见的RNA甲基化类型[17-20]。WTAP 是m6A 修饰中的“阅读者”,和METTL3、METTL14都是重要的甲基转移酶[21]。I/R损伤发生在各种组织和器官中,包括心脏、肝脏、肺、肾脏、皮肤等[22-26]。有关I/R损伤的m6A修饰还未得到广泛的研究。Song等[27]证明m6A修饰与心肌I/R损伤的发病机制密切相关,在心肌I/R损伤小鼠中,METTL3蛋白的表达水平显著升高,心肌细胞活性显著降低;在新生儿心肌细胞的H/R损伤模型中,上调METTL3可降低自噬流,促进心肌细胞凋亡,而沉默METTL3可增强心肌细胞活力。m6A的甲基化调控也参与了肾I/R损伤的发生发展。Xu等[1]的研究证明低表达METTL14,小鼠肾组织和HK-2 细胞的I/R 损伤都被抑制,并与甲基化YAP1和YAP1-TEAD通路有关。WTAP在I/R损伤中的作用目前只在心肌中被研究,其在肾I/R损伤中是否发挥作用还处于未知阶段[10]。本研究发现,WTAP在小鼠肾I/R损伤和HK-2细胞H/R损伤中都高表达,提示WTAP 在肾缺血再灌注损伤中起促进作用。沉默WTAP后,与对照组相比,HK-2细胞活性增加,凋亡率降低,证明降低WTAP的表达可以减轻HK-2细胞的H/R损伤,可能通过凋亡通路发挥作用。
FOXO1作为一种重要的转录因子,是细胞代谢的关键调节者。已有多项研究证明FOXO1参与I/R损伤的进展[28]。FOXO1可促进脑I/R损伤的进展[29];Wang等[12]发现FOXO1下调可抑制肾的I/R损伤;我们的研究结果也与此相一致,在小鼠肾I/R损伤和HK-2细胞的H/R 损伤中,FOXO1 的表达都显著升高,由此说明FOXO1的表达会加重肾I/R损伤。在缺血再灌注损伤诱导的急性肾损伤中不可避免地存在细胞凋亡。细胞凋亡是受多种基因调控的程序性细胞死亡;在凋亡信号调控下,线粒体膜电位之间的转运孔被打开,膜电位崩解,最终导致细胞凋亡[30]。大量研究表明,Caspases是参与调控细胞凋亡的重要蛋白[31]。当线粒体膜通透性改变时,启动Caspase 9的表达,Caspase 3作为最后的效应器元件被激活,Cleaved Caspase 3 是其活化形式,进入内源性凋亡通路,阻碍PARP 发挥正常功能,导致细胞凋亡[32]。Wang等[12]在HK-2细胞H/R损伤研究中,用FOXO1的抑制剂AS1842856进行预处理,结果显示与对照组相比,TUNEL 阳性染色的百分比降低,pro-Caspase3的裂解减少,说明FOXO1在HK-2细胞的H/R损伤中促进了细胞凋亡。本次研究结果显示,在小鼠肾I/R损伤后,TUNEL阳性肾小管上皮细胞数目增加,说明损伤后凋亡加重;同时,通过体外研究HK-2细胞的H/R 损伤,Caspase3 活性检测结果显示H/R 损伤后Caspase3活性显著增加,进一步证明了肾I/R损伤的机制与凋亡有关;以上研究结果与前人相一致,都证明了FOXO1在急性肾损伤中起促凋亡的作用。
m6A修饰在多种生物过程中发挥着重要作用,但有关FOXO1 这一重要转录因子的m6A 修饰研究甚少。目前相关学者报道了FOXO1的m6A修饰在内皮细胞炎症和动脉粥样硬化中的作用。内皮细胞炎症过程中,FOXO1的m6A修饰水平显著升高;METTL14敲低之后,FOXO1 的表达显著降低;MeRIP 实验证实METTL14可直接与FOXO1 mRNA结合,增加其m6A修饰,促进其表达,诱导内皮细胞炎症反应和动脉粥样硬化斑块形成[13]。虽然本研究采用SRAMP(http://www.cuilab.cn/sramp/)网站预测了FOXO1有多个高水平的m6A修饰位点,但仍需进一步的实验证明。通过MeRIP实验检测了HK-2细胞H/R损伤中,FOXO1的m6A修饰水平显著升高;沉默WTAP,FOXO1的m6A修饰水平显著降低。以上结果提示,WTAP可直接作用于FOXO1 mRNA,增加其m6A 修饰,调控其表达,诱导HK-2细胞凋亡。
综上所述,在I/R损伤的小鼠肾组织和H/R损伤的HK-2 细胞中,WTAP 和FOXO1 表达均上调;沉默WTAP可明显抑制和HK-2细胞的H/R损伤,其机制可能是沉默WTAP,减弱了FOXO1的m6A修饰,降低了FOXO1及凋亡相关蛋白的表达,从而抑制细胞凋亡,对肾I/R损伤起到保护作用。本研究证明WTAP-FOXO1可能成为治疗肾I/R损伤的潜在靶点,抵抗H/R损伤。但由于HK-2 细胞属于肾小管上皮细胞,WTAPFOXO1轴能否参与调控肾I/R损伤中其他类型细胞的功能,还需进一步探讨。

