索拉非尼联合吴茱萸碱对肝癌HepG2细胞的协同抗肿瘤作用*
陈 慧,宁 琳,蔡 丽,陈天宇,欧阳昌汉
(1.成都东软学院健康医疗科技学院,四川 成都 611844;2.湖北科技学院医学部药学院;3.成都医学院药学院)
原发性肝癌已成为全球常见癌症,也是全球癌症相关死亡的常见原因。国际癌症研究机构(IARC)公布了2020年全球肝癌的发病率与死亡率分别位居所有恶性肿瘤第6位与第3位[1]。据国家癌症中心的数据显示,肝癌已成为我国第4位常见恶性肿瘤,中国肝癌死亡率占全球肝癌总死亡数的一半以上[2]。目前,肝癌的治疗方法主要包括肝切除、肝移植、局部消融、肝动脉化疗栓塞和药物治疗等[3]。索拉非尼(sorafenib,Sora)是治疗晚期HCC的一线抗癌药,但由于其敏感性和耐药性问题,使患者服用后无法达到良好治疗作用[4],因此,需要更有效的治疗药物或治疗方式。吴茱萸碱(evodiamine,Evo)是一种从中草药吴茱萸中提取的生物碱,在多种肿瘤细胞和动物模型中均证实具有较强的抗肿瘤及化疗增敏作用[5]。但吴茱萸碱联合索拉非尼能否发挥协同抗肝细胞癌的效应目前尚未见报道。本研究旨在探讨Sora与Evo联合对肝癌细胞HepG2增殖及凋亡的影响,为肝癌的有效治疗提供理论依据及实验基础。
1 材料与方法
1.1 实验材料
索拉非尼(批号:S739708;纯度:99.89%)、吴茱萸碱(批号:S238202;纯度:99.76%),均购自美国Selleck公司;DMEM高糖培养基、胎牛血清、0.25%胰酶、青霉素、链霉素、PBS缓冲液、CCK-8均购自美国Gibco公司;RIPA缓冲液、Annexin V-FITC/PI均购自上海碧云天生物科技有限公司;一抗GAPDH、Bax、Bcl-2、Cleaved caspase-3,二抗山羊抗兔IgG-HRP均购自美国Cell Signaling公司。
1.2 实验仪器
CO2细胞培养箱(赛默飞世界科技有限公司);倒置荧光显微镜(日本OLYMPUS公司);酶标仪(美国Bio-Tek公司);电泳仪(美国 Bio-Rad 公司);自动发光凝胶成像系统(英国SYNGENE公司);流式细胞仪(美国BD Biosciences公司)。
1.3 实验方法
1.3.1 细胞培养
HepG2细胞系均在含10%胎牛血清的DMEM培养基中培养,并在含有5% CO2的加湿培养箱中37℃培养。
1.3.2 细胞毒性测定与协同指数计算
取对数生长期的肝癌HepG2细胞,以5×103个细胞/孔的密度接种于96孔板中,培养24h后分组进行处理,分为空白对照组、Sora单独用药组(0.001、0.01、0.1、0.5、1、5、10、20、50μmol/L)、Evo单独用药组(0.001、0.01、0.1、0.5、1、5、10、20、50μmol/L)、Sora与Evo联合用药组,以上每个组设置6个复孔。细胞与不同剂量的Sora、Evo或其组合物共同孵育24h后,每孔加入10μL CCK-8溶液,37℃避光温育2h。使用酶标仪测量450nm处的吸光度来评估细胞生长抑制率,计算公式如下:生长抑制率(%)=(对照组OD值-实验组OD值)/(对照组OD值-空白对照组OD值)×100%,并计算药物的半数抑制数(IC50),同时使用Compu Syn软件计算协同指数(combination index,CI),CI<1表示协同作用,CI=1表示相加效应,CI>1表示拮抗作用[6]。
1.3.3 流式细胞术(flow cytometry,FCM)检测细胞凋亡率
取对数生长期的肝癌HepG2细胞,以1.5×105个细胞/孔的密度接种于6孔板中,待细胞贴壁培养24h后,将细胞与不同剂量的Sora、Evo或其组合物共同孵育24h。胰蛋白酶消化并收集各组细胞,离心,加入预冷PBS缓冲液洗涤,再加入binding buffer 0.5mL轻柔吹打重悬细胞,避光加入10μL FITC/PI溶液孵育20min,于1h内用流式细胞仪分析细胞凋亡程度。
1.3.4 Western blot检测凋亡相关蛋白Bcl-2、Bax、Cleaved caspase-3的表达水平
取对数生长期的肝癌HepG2细胞,以1.5×105个细胞/孔的密度接种于6孔板中,待细胞贴壁培养24h后分组进行处理,以DMSO为对照组,单用Sora 5μmol/L、Evo 1μmol/L及其联合用药组为实验组。药物作用24h后,于冰上用RIPA缓冲液裂解细胞,BCA试剂盒测定蛋白浓度,取20μg蛋白样品上样,进行SDS-PAGE电泳,采用湿转法将蛋白转移到PVDF膜,5%脱脂牛奶室温摇床封闭2h,膜与一抗在4℃下孵育过夜,PBS洗涤,室温与二抗孵育1h,PBS洗涤,ECL试剂显影。使用Image J分析各目的蛋白的灰度值,用GAPDH作为内参。
1.4 统计学方法
2 结 果
2.1 药物细胞毒性测定
不同浓度的Sora与Evo分别处理HepG2细胞24、48、72h,采用CCK-8检测细胞毒性。结果显示(图1),随着Sora与Evo药物浓度的增大,HepG2细胞的存活率都有明显的降低;随着药物作用时间的增加,肿瘤细胞的存活率同样有所下降。同时,表1显示了不同药物组对HepG2细胞的IC50,随着药物作用时间的增加,IC50值越来越小,在后续的实验中,选择48h作为药物处理时间。上述结果提示Sora与Evo杀伤肝癌细胞HepG2均具有浓度依赖性和时间依赖性,这为Sora与Evo协同治疗肝癌提供了可能性。

表1 不同药物组对HepG2细胞的IC50(n=6,μmol/L)

图1 Sora和Evo对HepG2肝癌细胞增殖抑制作用的时间与浓度相关性
2.2 Sora和Evo联用对HepG2细胞增殖的抑制具有协同作用
采用Compu Syn软件计算两药联用的CI。结果显示,两药在5种不同浓度下联用时细胞生长抑制率的CI均小于1,表明Sora和Evo联用呈现协同效应,能更好地抑制肝癌细胞HepG2的增殖(图2,表2)。
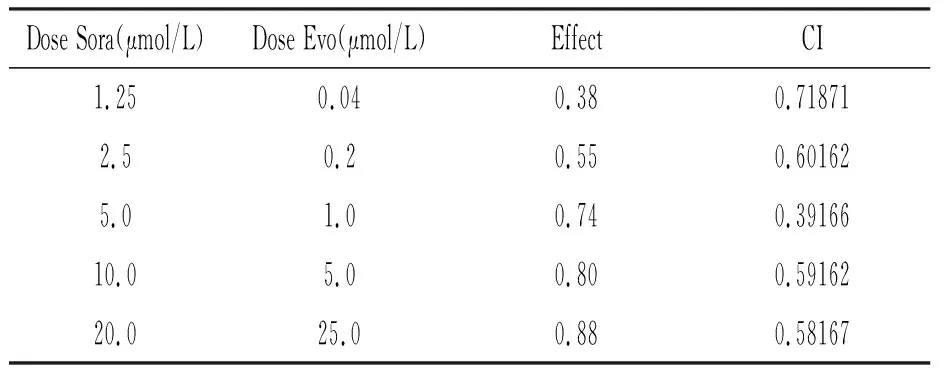
表2 Sora和Evo对HepG2细胞联合作用的CI值

a.不同浓度Sora和Evo联用对HepG2细胞存活率的影响(与Sora组比较,*P<0.05,**P<0.01;与Evo组比较,#P<0.05);b.HepG2细胞中Sora和Evo联合处理的等效线图;斜边左下角,协同作用。图2 Sora和Evo联合在HepG2细胞中的作用评价
2.3 Sora和Evo联用对HepG2细胞凋亡的影响
采用Annexin V-FITC/PI双染法评估药物对HepG2肝癌细胞凋亡的影响,结果显示,与对照组相比,Sora或Evo单独用药组细胞凋亡率明显增高(P<0.01);与Sora或Evo单独用药组相比,联合用药组细胞凋亡率明显增高(P<0.01),提示Sora与Evo联合用药后,能够显著提高其诱导HepG2肝癌细胞凋亡的能力(图3)。

与Control组比较,**P<0.01;与Sora组比较,##P<0.01;与Evo组比较,&&P<0.01。图3 Sora、Evo及联合用药对HepG2细胞凋亡的影响(n=3)
2.4 Sora和Evo联用诱导细胞Bax、Bcl-2、Cleaved caspase-3蛋白表达增加
采用Western blot检测凋亡相关蛋白表达情况。结果显示,与对照组相比,Sora或Evo使Bax、Cleaved caspase-3蛋白表达明显升高(P<0.05,P<0.01),使Bcl-2蛋白表达明显下降(P<0.05)。与单独用药组相比,联合用药可进一步上调细胞Bax、Cleaved caspase-3蛋白(P<0.05,P<0.01)及下调Bcl-2蛋白表达水平(P<0.01)。表明两药联用增强了对HepG2细胞抗凋亡蛋白Bcl-2表达的抑制,诱导细胞凋亡(图4)。

与Control组比较,*P<0.05,**P<0.01;与Sora组比较,#P<0.05,##P<0.01;与Evo组比较,&P<0.05,&&P<0.01。图4 Sora、Evo及联合用药对HepG2细胞凋亡相关蛋白表达的影响(n=3)
3 讨 论
索拉非尼是晚期HCC患者的唯一全身治疗选择,但由于其频发的耐药性导致药物治疗效果不理想,探索更有效的治疗策略来增强其抗肿瘤活性具有重要临床意义。Wang等[7]报道葫芦素B联合索拉非尼可通过调节caspase-3和caspase-9水平产生协同抑制肿瘤细胞增殖的作用。Li等[8]研究表明青蒿琥酯可在体内外显著增强索拉非尼对HCC细胞系和荷Huh7肿瘤小鼠的抗癌作用,其机制与氧化诱导的溶酶体活化、诱导铁死亡和提高索拉非尼敏感性有关。以上研究均证实了索拉非尼联合中药可增强HCC的治疗效果,激发我们进一步探索更有效的联合治疗药物。
吴茱萸碱是一种喹唑啉咔啉生物碱,具有抗肿瘤、保护心脏和调节代谢性疾病等药理活性[9]。研究表明吴茱萸碱不仅对多种恶性肿瘤具有显著的抗肿瘤作用,还与部分抗肿瘤药物联合也可发挥协同增效作用[10]。本研究结果显示,索拉非尼和吴茱萸碱单独应用可明显抑制HepG2细胞的生长,其在48h的IC50值分别为5.263μmol/L和1.454μmol/L。两药采用不同浓度联用时细胞生长抑制率的CI均小于1,表明两药联用具有协同作用。
通过靶向程序性细胞死亡或细胞凋亡是临床上有效消除癌细胞的疗法,若肿瘤细胞逃避凋亡,则可发生肿瘤耐药。既往研究表明[11],索拉非尼联合ASC-J9®可显著抑制p-STAT3表达及其下游基因CCL2和Bcl2表达,从而抑制HCC进展。吴茱萸碱可导致HepG2细胞内活性氧堆积和氧化-抗氧化系统平衡失调,引发氧化应激,从而激活细胞凋亡[12]。本研究通过流式细胞术和免疫印迹分析表明,索拉非尼与吴茱萸碱均能够促进HepG2的凋亡,两药联用后,促凋亡作用更加显著,两药联用组Bax、Cleaved caspase-3蛋白表达水平增加,而抗凋亡蛋白Bcl-2表达水平降低,以上结果表明索拉非尼与吴茱萸碱联合使用具有协同促凋亡作用。
本研究首次证实索拉非尼联合吴茱萸碱可明显抑制HepG2肝癌细胞增殖并显著诱导细胞凋亡,为索拉非尼联合吴茱萸碱作为HCC的新化疗方案提供了理论依据,但需进一步研究以阐明其抗肿瘤作用分子机制,为有效治疗肝癌患者提供证据。

