口腔微生物与食管癌关系的研究进展
孙凡钥,杨玉鑫,陈宏伟,师鑫鹏,罗晓勇,王保永
人体微生物组是指定植在人体不同生态位置中的微生物群体,包括细菌、真菌和病毒等[1],其在维持人类健康方面发挥重要作用,包括机体代谢活动和免疫系统成熟等方面[2]。近年来,新一代测序技术的发展使得研究微生物群的组成和多样性成为可能。微生物群的组成受到多种因素的影响,如饮食、运动、药物摄入以及宿主免疫系统和遗传因素等[3]。近期的研究表明,口腔等上消化道的微生物群在食管癌(esophageal cancer,EC)的发病机制中起到重要作用[4]。然而,关于口腔微生物在EC发展中的确切作用和机制的研究还相对较少[5]。本文概述口腔微生物与EC相关研究的进展,探讨口腔微生物与EC之间的潜在联系,为EC的早期预测和治疗提供理论基础。
1 EC
EC是世界第八大最常见癌症和第六大常见癌症相关死因[6]。在我国恶性肿瘤中,EC的发病率居第三位,死亡率居第四位。根据组织病理学分类,EC可以分为管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)和食管腺癌(esophageal adenocarcinoma,EAC)[7]。在发展中国家,ESCC是主要类型,而在发达国家,EA更为常见[8]。在分子水平上,ESCC的亚型常伴有多个基因的频繁突变,包括MLL2、ZNF750、TP53、NFE2L2、NOTCH1和TGFBR2[9]。而在EA中,常见的突变发生在ARID1A、SMAD2和ERBB2基因中[10]。由于缺乏准确的早期筛查方法和有效治疗,EC的5 a存活率仅为15%~25%[11],因此迫切需要研究早期EC预测的新型高效生物标志物。
2 口腔微生物
2.1 口腔微生物的组成与功能
人体的口腔微生物群是仅次于胃肠道的第二大丰富微生物群,也是人类微生物组成的重要部分,包括数百到数千种不同的物种。人类口腔的16S rDNA谱分析表明,口腔细菌群主要包括厚壁菌门、拟杆菌门、变形菌门、放线菌门、螺旋菌门,这些细菌占口腔细菌总数的96%(口腔微生物组数据库可从网站www.homd.org获得)。口腔微生物群的组成平衡对人体口腔健康、免疫系统、消化系统和代谢功能正常发挥均具有重要作用。
2.2 口腔微生物与健康的关系
口腔微生物是口腔内环境的重要组成部分。多项研究表明,口腔微生物组成失调不仅对人类最常见的两种口腔疾病--牙龈炎和牙周炎具有显著影响[12],而且也是其他疾病的重要诱因,如糖尿病、心血管疾病、肿瘤等[13-15]。因此,维持口腔微生物组成的稳定与平衡,对于人体健康至关重要。
3 口腔微生物与EC的关系
人体口腔、食管和后肠道等处的微生物数量庞大,种类多样。随着微生物测序新技术的发展,食管中的放线杆菌(如罗氏菌)、变形杆菌(如嗜血杆菌)、梭杆菌(如具核梭杆菌)、拟杆菌(如普雷沃菌)及厚壁菌(如链球菌)等细菌种类不断被发现和报道[16]。由于口腔与食管在解剖结构上具有连续性,因此食管微生物与口腔微生物组成类似[17]。研究表明,中国EC患者和健康人群的口腔微生物组成存在差异,EC患者增加最显著的类群是厚壁菌、负菌纲、硒足菌科、前蝶科、普雷沃菌和韦荣氏球菌,而减少最显著的类群是变形杆菌、β变形杆菌、奈斯序列、奈瑟菌科等[18]。EC的发生与发展与口腔微生物之间的机制十分复杂,涉及多种因素及之间的相互作用,如细胞因子、趋化因子、致癌信号通路、细胞表面受体、细胞外基质降解和细胞凋亡等[19]。
3.1 口腔微生物与ESCC
ESCC是EC最重要的病理类型,其在发展中国家更为常见[20]。ESCC的危险因素主要包括饮酒、吸烟、不良饮食、化学因素、感染、EC家族史和遗传突变等[21]。研究表明,不良的口腔健康是食管鳞状上皮不典型增生的一种危险因素,而食管鳞状上皮不典型增生是ESCC的癌前病变[22]。因此,对口腔微生物与食管鳞状癌关系的研究备受关注。
诸多研究表明ESCC患者的口腔微生物群与健康口腔微生物群之间存在显著差异。如表1所示,ESCC患者的口腔微生物中的厚壁菌门、拟杆菌门,以及牙龈卟啉单胞菌属、普雷沃菌属、链球菌属等的丰度显著升高,而变形杆菌属、梭杆菌属和奈瑟菌属等的丰度显著降低。此外,ESCC患者的口腔微生物群常伴有α多样性及β多样性显著降低,表明与健康人群相比,ESCC患者的口腔微生物菌群多样性和丰富度均受到不良影响。与表1总结的现象有所不同,作者比较(未发表数据)了25例ESCC患者的癌组织及癌旁组织的微生物组成,发现ESCC组织和其癌旁组织在α多样性和β多样性均无显著差异,但在属水平上,与癌旁组织相比,ESCC组织中的普雷沃菌、消化链球菌、具核梭杆菌的相对丰度显著增加。作者与表1中结论的不同可能与各试验参与者的饮食习惯、采样季节和采样部位等存在差异有关。一项研究关注EC前病变和鳞状细胞癌中口腔和食管微生物群的特征,发现颗粒菌、罗氏菌、链球菌、孪生球菌属、钩端菌和沙利亚是低度异型增生患者的常见生物标志物,乳酸杆菌是高度异型增生患者的常见生物标志物。EC多伴随发生氨基酸、脂肪酸和糖代谢紊乱等相关生物标志物的代谢组学变化[23]。本团队早在2020年对中国EC患者的口腔微生物群进行了研究,发现与正常人相比,ESCC患者口腔微生物群存在差异,其中奈瑟菌属、普雷沃菌属和韦氏菌属的相对丰度差异显著。这些差异菌可能成为EC的新潜在标志物,并为研究口腔微生物与ESCC之间的关系提供方向[18]。此外,有研究比较健康对照组和ESCC组,发现普雷沃菌的丰度显著增加。最近的研究通过收集牙菌斑和未刺激的唾液样本,使用16S rDNA测序技术,在EC患者的癌组织中检测到了心绞痛链球菌和牙菌斑中的连翘曲霉,这可能与ESCC的高风险有关[24]。目前需要进一步的研究以验证先前的发现,并阐明口腔微生物对ESCC发生机制的影响。研究口腔微生物群与ESCC风险因素的相关性有望在深入了解该癌症的病因方面取得显著进展,并可能为早期ESCC的检测提供新的思路。
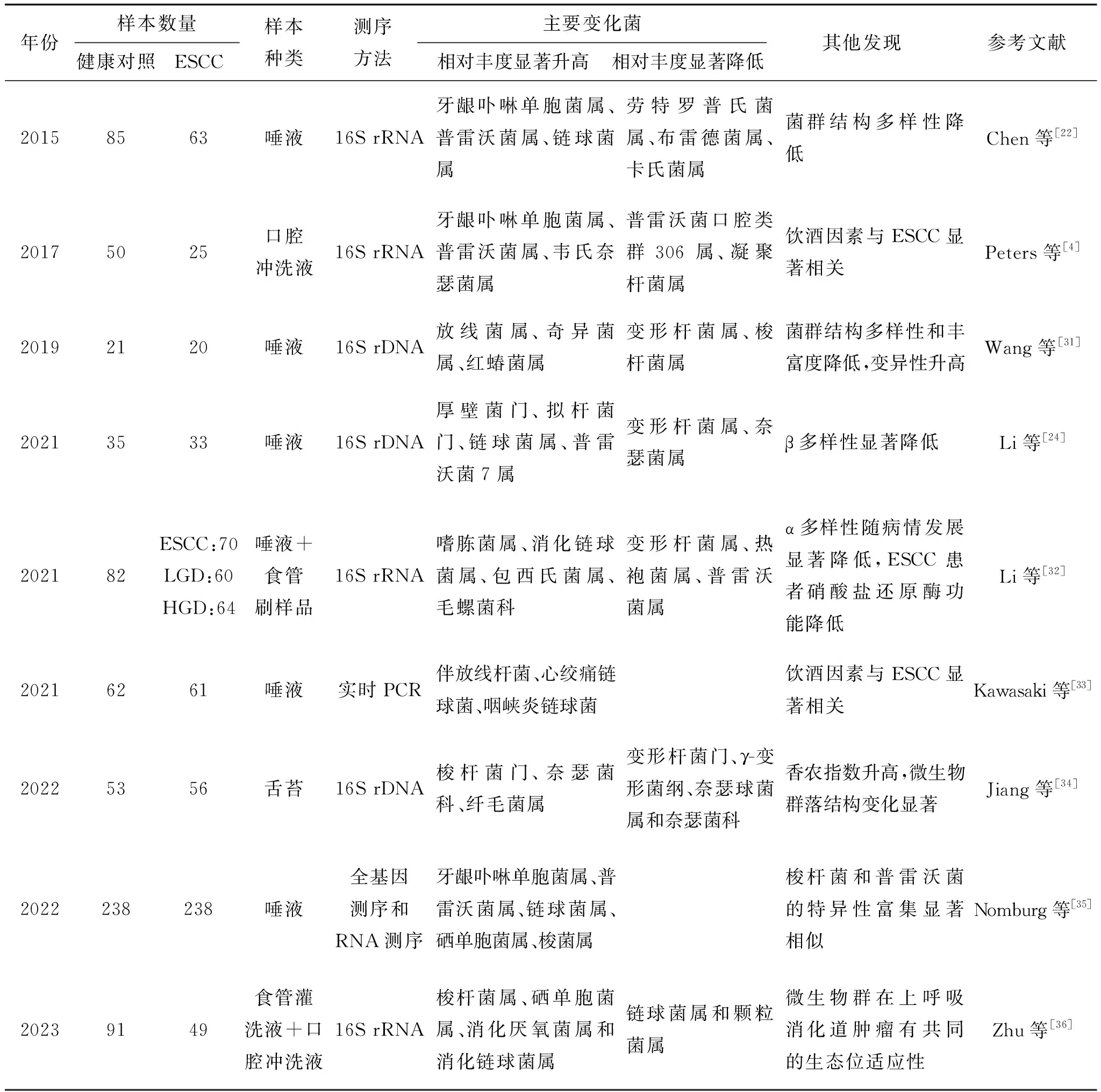
表1 口腔微生物与ESCC的研究
此外,口腔与肠道微生物的联合效应在系统性疾病中的研究越来越受到关注。最近的研究表明,口腔微生物可以转移并定植在肠道中,口腔可以作为肠道微生物的内源性储存库[25]。口腔中的有害菌群转移到下消化道(即食道、胃、小肠和大肠),可能引起肝硬化、类风湿性关节炎和炎症性肠炎等疾病[26-28]。Deng等调查研究了23对食道癌患者及匹配的健康个体的肠道(新鲜粪便)微生物组,通过16S rRNA基因测序进行比较分析,发现与健康个体相比,食道癌患者的肠道中厚壁菌和放线菌相对丰度显著升高[29];此外,Li等的研究中发现,EC患者的肠道中脆弱拟杆菌、大肠杆菌、梭杆菌等菌群的相对丰度显著增加[30]。虽然较少研究直接关注于比较EC患者与正常个体的口腔及肠道微生物组的相关性及差异性。然而由表1可知,EC患者的口腔厚壁菌、拟杆菌、放线菌和梭杆菌等微生物的丰度普遍升高。综上可以发现,EC患者的口腔及肠道中高丰度菌群存在较强的一致性,表明它们可能成为早期EC诊断的生物标志物,然而其具体效果还有待进一步研究与验证。
3.2 口腔微生物群与EAC
EAC是发达国家的主要EC类型,而在亚洲和非洲则为罕见[33]。该癌症的主要危险因素包括慢性胃食管反流病、肥胖和吸烟等[37]。巴雷特食管被认为是EAC的癌前病变[38]。一项研究通过16S rRNA基因测序等方法比较了17名正常人与32名巴雷特食管患者的口腔微生物组,发现与正常人相比,巴雷特食管患者的口腔微生物组的厚壁菌门相对丰度显著增加,变形杆菌门丰度显著降低。此外,该研究还发现,在患有高度不典型增生和癌症的巴雷特食管患者中,肠杆菌科的相对丰度显著增加,该研究还揭示了肠杆菌科细菌的相对丰度在患有高度不典型增生和癌症的巴雷特食管患者中显著增加,表明其与从巴雷特食管到EAC的进展显著相关[39]。近年来,仅有较少研究直接关注于口腔微生物与EAC的关系,表2总结了部分口腔或食管微生物与巴雷特食管及EAC关系的研究结果,发现主要差异菌在不同研究之间存在较大变异性,但总结来看,巴雷特食管和EAC的发生可能与放线菌和韦荣球菌属的相对丰度升高存在正相关,而与变形杆菌门,链球菌和棒状菌的相对丰度升高存在负相关。食管是人类胃肠道系统的重要组成部分,具有独特和多样化的微生物组成,且与口腔微生物组成相似[40]。研究表明,在巴雷特食管中革兰氏阴性菌(包括梭菌、奈瑟氏菌、弯曲杆菌、拟杆菌,变形杆菌和类杆菌)的相对丰富度增加,这可能与EAC的发生发展有关[41]。然而,一项基于16S rDNA的研究却未观察到口腔微生物多样性或组成与EAC风险之间的显著相关性[4]。目前,关于口腔微生物与EAC关系的研究较少,其与EAC的发生和发展机制尚不清楚,需要进一步研究和探讨。揭示口腔微生物与EAC之间的关系,有助于早期发现和预防该疾病,并为其预防开辟新的研究领域,提供成本效益高、相对安全的治疗方法。
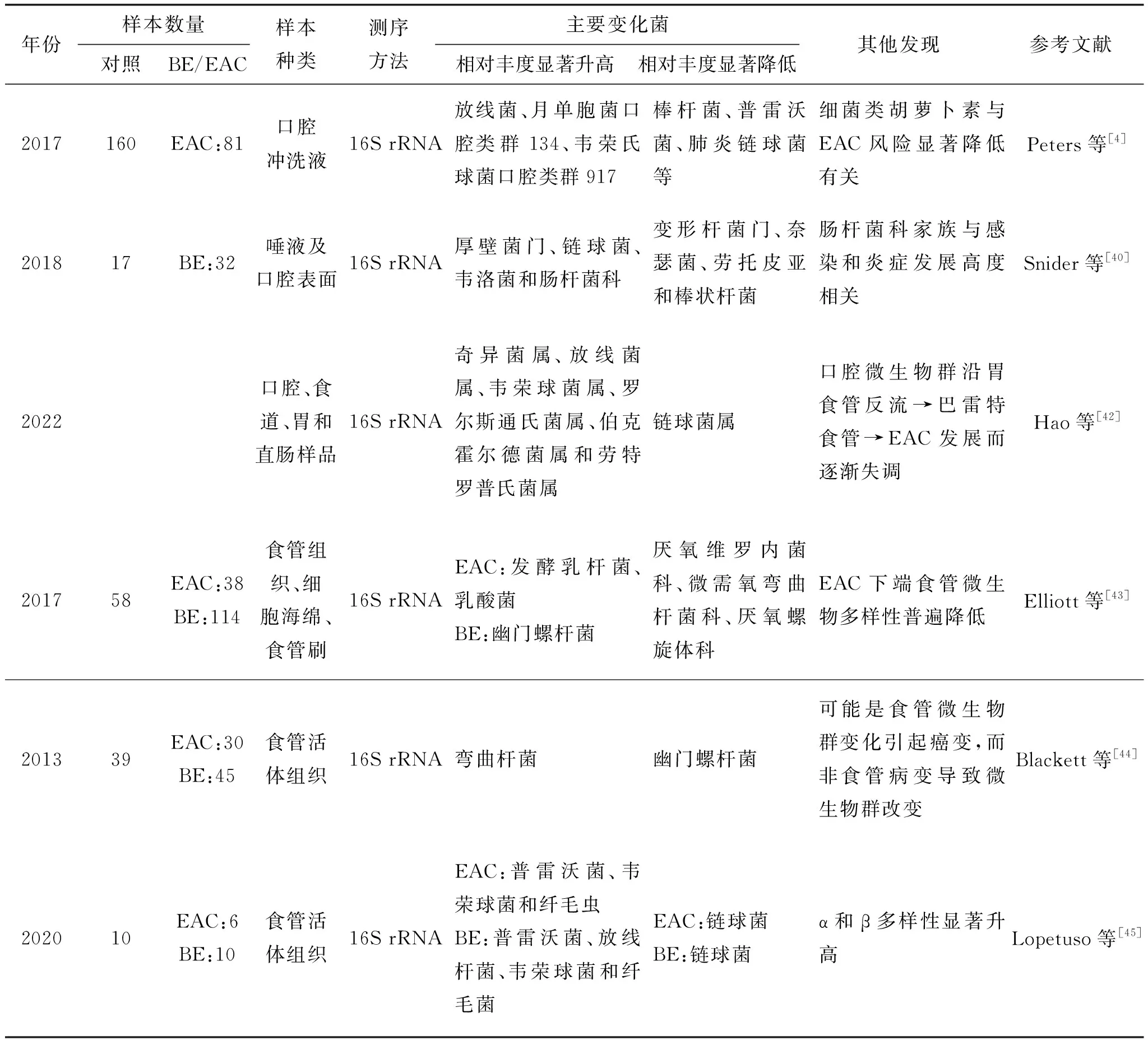
表2 口腔及食管微生物与巴雷特食管和EAC的研究
口腔微生物与EC的研究尚处于早期阶段,但已有研究表明口腔微生物组成的变化在不同类型的EC中可能扮演不同的角色,并为EC的早期预测和治疗提供了重要线索。这些研究发现特定口腔细菌(如牙龈卟啉单胞菌属、普雷沃菌属和链球菌属)的相对高丰度、口腔微生物多样性和丰富度的降低可能与ESCC和EAC的发展相关。此外,革兰阴性食管菌(主要是链球菌和普雷沃菌)的比例变化可能与巴雷特食管有关。然而,目前尚未观察到明确且一致的口腔微生物变化与EC之间的关系模式,因此需要进一步的研究来加深我们对这一领域的理解。
4 口腔微生物对EC的作用机制
目前关于口腔微生物对EC发生发展作用机制的研究较少,已有的报道主要集中于口腔微生物对食管的炎症和免疫调节、NF-κB 通路激活、EC细胞增殖与细胞凋亡以及微生物的代谢产物和内毒素等方面。
4.1 炎症和免疫调节
微生物通过多种途径产生促炎微环境引起慢性炎症,进而促进EC的发生发展。引发EC的一个潜在机制是产生白细胞介素6(interleukin 6,IL-6),这是一种促炎细胞因子,可激活信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3) 通路。IL-6/STAT3 级联的靶基因参与调节细胞增殖、分化和存活,从而导致各种癌症的发展[46-47]。牙龈卟啉单胞菌可促进食管黏膜IL-6 的生物合成,进而激活下游 STAT3 通路,维持EC的恶性表型[48]。该菌也可促进IL-6 的分泌,进而促进食管上皮-间质转化(epithelial-mesenchymal transition,EMT) 以及骨髓源性免疫抑制细胞募集,从而促进肿瘤转移和免疫逃逸[49]。此外,普雷沃菌也可以通过刺激上皮细胞产生IL-8、IL-6、CCL20等细胞因子,促进黏膜Th17免疫反应和中性粒细胞募集[50],但普雷沃菌是否可以通过影响 IL-6的分泌而影响EC的发生发展尚未见报道,需要未来的进一步研究证明。
此外,宿主免疫系统在抑制胃肠道肿瘤的发生发展中起着重要作用[51]。微生物群落失调引起的免疫系统紊乱可能诱导炎症,炎症介质的持续释放通常是癌症的重要促成因素[52]。牙龈卟啉单胞菌通过降解免疫球蛋白和补体系统影响宿主免疫系统来促进人ESCC的进展和化学抵抗[53];具核梭杆菌诱导CD8+T细胞表面的抑制性受体KIR2DL1高表达,从而削弱抗肿瘤免疫反应,促进ESCC的进展[54]。这些研究均表明,宿主口腔等微生物引起的宿主免疫失调与炎症反应,是导致EC等癌症发生的重要途径。
4.2 NF-κB通路与细胞的增殖与凋亡
NF-κB信号通路是经典的炎症通路,已经被证明可能与ESCC细胞的迁移和侵袭有关[55]。NF-κB可被多种因子刺激而激活,如细菌LPS、肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)、白细胞介素1-β(Interleukin-1β,IL-1β)和胆汁酸等[56-57]。研究表明,具核梭杆菌感染EC细胞后,使NOD1和磷酸化RIPK2过表达进而激活NF-κB信号通路,从而显著提高EC的增殖能力[58]。此外,口轻微生物可以通过抑制细胞的凋亡来促进癌细胞的增殖。Li等的一项研究表明,牙龈卟啉单胞菌通过诱导激活人上皮KB细胞线粒体凋亡诱导因子(apoptosis inducing factor,AIF)而抑制口腔黏膜的修复[59];具核梭杆菌通过靶向TLR4/骨髓分化初级反应蛋白MYD88信号激活自噬途径并消除化学治疗剂介导的细胞凋亡,从而导致结直肠癌细胞的化学抗性表型[60]。类似的研究也表明具核梭杆菌通过调节自噬级联和细胞凋亡赋予ESCC细胞的化学抗性[61]。
4.3 微生物代谢产物及内毒素
大量研究表明,微生物的毒力因子如LPS、鞭毛和其他微生物相关分子模式 通过模式识别受体与宿主的先天免疫系统通信,导致持续的炎症反应和致癌作用[62],其可能是微生物促癌的机制之一。LPS是一种免疫活性成分,可通过环加氧酶延迟胃排空1/2或直接影响食管下括约肌的功能,进而增加胃内压促进胃食管反流病的发生,导致EAC的发展[63-64]。Toll样受体家族是负责连接微生物和机体免疫系统的重要识别受体,其激活代表了炎症相关肿瘤发生的重要调节因子[65]。如具核梭杆菌通过其毒力因子LPS与Toll样受体4(toll-like receptor 4,TLR4)/髓系分化初级反应基因88(MYD88激活NF-κB通路,增加microRNA-21(miR-21)的表达,进而激活肿瘤RAS信号传导,导致肿瘤细胞的增长[66-67]。肠道微生物群也可以分泌一些代谢物,如多胺、腐胺[68]以及丁酸盐等来刺激癌症的发展[69-70]。
此外,一些细菌可以直接产生内毒素导致基因组损伤,进而导致癌症的发生发展。例如,由革兰氏阴性菌分泌的细胞致死性肿胀毒素可能引起宿主DNA损伤[71],而食管DNA损伤的进一步修复可能导致EC的发展[72]。Li等发现CagA1阳性幽门螺杆菌可引起食管上皮细胞DNA断裂,从而导致食管鳞状上皮组织非典型增生,并促成ESCC的致癌作用[73]。
5 EC相关的常见口腔微生物
5.1 牙龈卟啉单胞菌
牙龈卟啉单胞菌是革兰氏阴性菌,属于拟杆菌属。该菌能够表达和分泌多种物质,包括牙龈蛋白酶、胞外多糖、脂多糖和血红蛋白摄取系统相关的物质,并干扰生物体的正常生理代谢,抑制细胞凋亡。因此,牙龈卟啉单胞菌被认为是诱导肿瘤发生的潜在危险因素[4]。
既往研究表明,在ESCC患者中,牙龈卟啉单胞菌的IgA和IgG血清水平明显高于食管炎和健康对照组。此外,牙龈卟啉单胞菌的高血清IgA或IgG水平与ESCC患者的不良预后相关,高IgA和IgG的患者预后最差。因此,该研究结果表明牙龈卟啉单胞菌可能与ESCC的发病机制有关[53]。此外,牙龈卟啉单胞菌可以通过多种途径促进ESCC的进展,包括通过TGFβ依赖的Smad/YAP/TAZ信号通路、miR-194/GRHL3/PTEN/Akt信号通路、NF-κB信号通路的激活,以及增加IL-6和IL-8的产生等促进ESCC的进展[74-77]。研究表明,牙龈卟啉单胞菌通过下调Beclin1的表达以及通过GSK3β介导的线粒体氧化磷酸化促进人ESCC的进展和化学抵抗[78-79]。
5.2 具核梭杆菌
具核梭杆菌是一种存在于人类口腔中的革兰氏阴性菌,是人体微生物组的重要组成成分,已被发现与牙周病以及多种癌症的发展密切相关[80]。研究表明,具核梭杆菌可能通过激活趋化因子(如CCL20)促进调节性T细胞的富集,进而促进肿瘤细胞的免疫逃逸[81]。此外,具核梭杆菌可通过激活NOD1/RIPK2/NF-κB通路、上调IL-32/PRTN3表达、通过AHR/CYP1A1/AKT信号传导促进ESCC的增殖、改变癌细胞全基因组甲基化水平以及诱导CD8+T淋巴细胞KIR2DL1高表达等机制[54,58,82-84],促进ESCC的发生与发展。有研究表明,具核梭杆菌能产生高水平的腐胺,干扰多胺代谢,促进ESCC的增殖[68]。具核梭杆菌在衰老的ESCC细胞中侵入并存活,并诱导DNA损伤的增加以进一步激活DNA损伤反应途径,从而增强衰老相关的分泌表型的分泌,从而促进ESCC的进展。因此,具核梭杆菌在ESCC的发生和发展中扮演重要角色,通过多种机制影响肿瘤的免疫逃逸、细胞增殖、基因组甲基化、免疫调节和衰老相关的分泌表型等过程。
5.3 普雷沃菌
普雷沃菌是拟杆菌门的革兰氏阴性菌,通常被认为是一种共生菌。该菌的丰度增加与Th17介导的黏膜炎症有关,可激活Toll样受体2,导致抗原提呈细胞产生Th17极化细胞因子(如IL-23、IL-1);普雷沃菌介导的黏膜炎症可导致炎症介质、细菌和细菌产物的在宿主集体的传播,从而可能影响全身性疾病的结果[50]。研究发现普雷沃菌在EC中的相对丰度高于正常组织[18,24],牙龈卟啉单胞菌和普雷沃菌的比值对早期ESCC诊断具有良好的敏感性和特异性[28]。而普雷沃菌在EC发生和发展中的作用机制尚不清楚,需要进一步的研究来阐明。
5.4 其他
除了已经提到的牙龈卟啉单胞菌、具核梭杆菌和普雷沃菌外,口腔微生物组中的其他菌也与EC发展相关。其中链球菌被认为是食管中的主要微生物[24]。然而,食管炎和巴雷特食管中革兰氏阳性菌转化为革兰氏阴性菌可能与EC的发病机制有关。巴雷特食管患者与对照组的微生物组成存在许多差异,有研究发现巴雷特食管患者中厚壁菌的相对丰度显著增加,而变形杆菌的相对丰度显著降低。另外,一项研究对与ESCC相关的口腔微生物组进行了分析,发现ESCC受试者的口腔微生物多样性总体降低,并且ESCC患者的月桂属、大疱菌属、卡托氏菌属、棒状杆菌属、莫里氏菌属、消化球菌属和心杆菌属的水平相对较低[22]。
总之,虽然目前尚未观察到明确且一致的口腔微生物与EC之间的关系模式,但口腔微生物组成的失衡和特定菌群的变化可能与EC的发展相关。进一步的研究将有助于深入了解口腔微生物与不同类型的EC之间的关系,并为EC的早期预测和治疗提供更多的指导。
6 未来与展望
目前尚不清楚口腔微生物与EC发生发展的确切机制。然而,慢性感染已被认为是癌症发展的重要流行病学和环境决定因素。研究发现,ESCC中炎症标志物升高,表明ESCC与慢性炎症有关。炎症信号通路激活是EC发生的主要机制之一,其中NF-κB通路在ESCC的发展中起着重要作用,其激活与ESCC的癌细胞的迁移和侵袭有关[85]。此外,NF-κB及其两个主要下游效应子,即IL-8和IL-1β,可调节重要的细胞功能,如血管生成、存活、肿瘤细胞干性、细胞迁移、转移和免疫细胞浸润等[86-87]。因此,未来的研究或许将口腔菌群与NF-κB通路、Smad/YAP/TAZ等信号通路联系起来,以进一步明确EC的发病机制。当然,上述机制的研究仍存在一些问题需要解决。首先,口腔微生物的变化是EC的病因还是结果需要深层次的探究。其次,需要鉴定否存在特定的口腔微生物致病菌推动了EC的发展。
综上所述,本文通过对口腔微生物与EC发生发展的关系进行综述,以期发现特定微生物菌株作为敏感且特异性的临床诊断标志物,从而实现对ESCC的定向诊断和治疗,提高患者的生存率。本综述有助于深入理解口腔微生物在EC发展中的作用,并为发展更有效的治疗策略提供新的思路。

