hsa_circRNA6448-14对食管鳞癌细胞恶性增殖能力的影响
李梦辉,王 平,张耀文
食管鳞癌(esophageal squamous cell carcinoma,ESCC)病因不明、机制不清、死亡率极高[1-2]。全球每年新发的ESCC患者中,中国占一半以上,其中河南占中国的一半以上[3-4]。因此,寻找ESCC早诊早治的特异性分子标志物,对降低其发病率及改善患者预后至关重要。
资料显示,新发现的内源性非编码RNA-circRNA(circular RNA,circRNA)具有结构稳定、种类丰富、特异性强、序列保守等特点,可调控天然小RNA(microRNAs,miRNAs)活性,参与结合转录调控元件及转录蛋白互作基因等[5-7]。circRNA已被证实为肝癌、胃癌、肺癌等多种恶性肿瘤的生物标志物[8-10]。本团队前期研究发现hsa_circRNA6448-14在ESCC中的表达量显著高于正常组织,表明hsa_circRNA6448-14与ESCC发生发展相关,但其具体致病机制尚不明确[11-12]。
本研究建立hsa_circRNA6448-14敲低的ESCC细胞系,采用CCK8及平板克隆实验检测亲本与敲低细胞系的体外增殖能力,分析hsa_circRNA6448-14在ESCC细胞恶性增殖过程中的作用,为ESCC治疗提供新思路。
1 材料与方法
1.1 主要试剂与仪器
KYSE30及KYSE150细胞系(人ESCC细胞系,中国BNCC公司)。Lipofectamine2000转染试剂(美国 Invitrogen公司);hsa_circRNA6448-14-siRNA及siNC(上海吉玛基因公司);hsa_circRNA6448-14上游引物为5’-CCAATGGGGACTGTC ATGGA-3’,下游引物为5’-TCATGCCGTGTTTCAGCTCA-3’,GAPDH 上游引物为5’-GTGGAGTCCACTGGCGTCT-3’,下游引物为5’-GTGCAGGAGGCATTGCTGAT-3’(中国Sangon Biotech公司);Trizol试剂盒(美国Thermo公司);反转录试剂盒及qPCR试剂盒(中国Vazyme公司);CCK8试剂盒、PBS缓冲液、4%细胞固定液及1%结晶紫染液(中国Solarbio公司)。PCR仪(美国Bio-Rad公司);倒置显微镜(日本Nikon公司);成像系统(美国Thermo公司);酶标仪(美国PerkinElmer公司)。
1.2 hsa_circRNA6448-14敲低
常规培养KYSE30及KYSE150细胞,将两株细胞各分为两组:对照组及观察组。待细胞密度为70%时,根据说明书将siNC及hsa_circRNA6448-14-siRNA与Lipofectamine2000转染试剂混合,分别转染对照组及观察组细胞。48 h后,采用qRT-PCR检测hsa_circRNA6448-14的敲低效率,并进行后续实验。
1.3 qRT-PCR
待各组细胞密度至80%,弃去培养基,PBS清洗后,加入Trizol冰上裂解,根据说明书步骤提取各组细胞总RNA。各组细胞均取1 μg总RNA,采用试剂盒配制反转录体系,反应条件为:25 ℃ 5 min,42 ℃ 60 min,70 ℃ 15 min。采用试剂盒配制qRT-PCR反应体系,反应条件为:95 ℃预变性20 s,95 ℃变性3 s,60 ℃退火 30 s,共40个循环。采用2-△△Ct法计算circRNA的相对表达量。具体步骤参考说明书及文献[12]。实验重复3次。
1.4 CCK8
将各组细胞密度调整为每mL 1 × 104。每组均于96孔板中铺入100 μL细胞悬液,常规培养。采用CCK8试剂盒,每隔24 h于酶标仪测定一次OD450 nm。对比不同组间的体外增殖能力,具体步骤参考说明书及文献[13]。实验重复3次。
1.5 平板克隆
将各组细胞密度调整为每mL 5 × 102个。每组均于6孔板中铺入2 mL细胞悬液,常规培养。1周后可见克隆形成。弃去培养基,于PBS缓冲液清洗、4%细胞固定液固定、1%结晶紫染液染色后,对单克隆进行拍照并计数[13]。实验重复3次。
1.6 统计学方法
本研究采用的统计学软件为GraphPad 8.0。采用t检验比较两组细胞间hsa_circRNA6448-14表达量差异及体外增殖能力差异。检验水准α=0.05,以P<0.05表示差异具有统计学意义。
2 结果
2.1 各组细胞hsa_circRNA6448-14的表达量
建立hsa_circRNA6448-14敲低的KYSE30及KYSE150细胞系。实验分为对照组及观察组,通过qRT-PCR检测各组细胞系中hsa_circRNA6448-14的相对表达量。结果显示,与对照组相比,观察组细胞中hsa_circRNA6448-14的相对表达量显著降低(P<0.05)。表明成功建立hsa_circRNA6448-14敲低的ESCC细胞系。见图1。

A、B:qRT-PCR检测各组KYSE30/KYSE150细胞。图1 各组细胞中hsa_circRNA6448-14相对表达量的检测结果
2.2 各组细胞体外增殖能力的CCK8检测
实验分为对照组及观察组。图2结果显示,与对照组相比,观察组细胞的体外增殖能力显著减弱(P<0.05)。表明hsa_circRNA6448-14可维持ESCC的恶性增殖。

A、C:CCK8法检测各组KYSE30/KYSE150细胞的体外增殖能力;B、D:各组KYSE30/KYSE150细胞的体外增殖能力差异。图2 各组细胞体外增殖能力的CCK8检测
2.3 各组细胞体外增殖能力的平板克隆检测
实验分为对照组及观察组。图3结果显示,与对照组相比,观察组细胞的体外增殖能力显著减弱(P<0.05)。表明hsa_circRNA6448-14在ESCC恶性增殖过程中发挥重要作用。
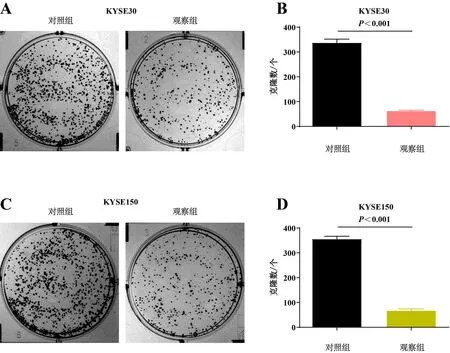
A、C:平板克隆法检测各组KYSE30/KYSE150细胞的体外增殖能力;B、D:各组KYSE30/KYSE150细胞的体外增殖能力差异。图3 各组细胞体外增殖能力的平板克隆检测结果
3 讨论
河南ESCC发病率居全国首位,由于ESCC起病隐匿,多数患者确诊时已发展至中晚期,5 a生存率极低。因此,寻找ESCC的诊断标记物和治疗靶点至关重要。
研究表明,circRNA已被证实与多种恶性肿瘤发生发展密切相关。甲状腺癌中,has_circRNA0058124可通过miR-218-5p/NUMB调控NOTCH3/GATAD2A轴促进癌细胞侵袭及转移,且显著缩短患者生存期[14];前列腺癌中,circCSNK1G3可通过调控miR-181促进癌细胞恶性增殖,降低其治疗敏感性[15];肝癌中,circASAP1可通过调控miR-326/miR-532-5P-MAPK1信号通路促进癌细胞远处转移,引起患者耐药及复发[16];非小细胞肺癌中,circFGFR1可通过miR-381-3P诱导CXCR4高表达,引起癌细胞抵抗凋亡,导致其免疫逃逸[17];胃癌中,hsa_circ_0001725可通过miR-150-5P/c-Myc轴参与胃癌的发生发展,其高表达的患者淋巴结转移率高,TNM分期差,术后生存期短[18];骨肉瘤中,circMYO10可通过miR-370-3P/RUVBL1轴引起染色质重塑,增强β-catenin/LEF1转录活性,促进癌细胞上皮间质转化,导致其恶性转移[19]。
资料显示,CircRNA在ESCC发生发展中扮演着重要角色。Circ-7不仅可通过miR-7激活NFκB/p65通路促进ESCC细胞生长,还可通过miR-7激活KLF4促进ESCC细胞迁移[20-21]。circ_0000654可通过miR-149-5P激活IL-6/STAT3通路诱发炎症反应,降低ESCC细胞的放疗敏感性[22]。本团队前期研究发现hsa_circRNA6448-14高表达的ESCC患者生存期缩短[11-12],表明hsa_circRNA6448-14参与了ESCC的发生发展。基于此,本研究建立hsa_circRNA6448-14敲低的ESCC细胞系,采用CCK8及平板克隆实验检测亲本与敲低细胞系的体外增殖能力,发现与亲本细胞系相比,hsa_circRNA6448-14敲低的ESCC细胞系的体外增殖能力显著减弱,提示靶向hsa_circRNA6448-14可有效抑制ESCC细胞的恶性增殖,表明hsa_circRNA6448-14为ESCC细胞增殖过程中的关键调控因子。
综上所述,hsa_circRNA6448-14在ESCC细胞恶性增殖过程中发挥重要作用。由于ESCC的发生发展是一个多因素相互作用的复杂过程,且本研究检测方法较少,circRNA的具体致病机制后续仍需其他实验进一步验证,但靶向hsa_circRNA6448-14可抑制ESCC细胞生长。本研究为ESCC治疗提供了新思路。

