超声成像技术在脓毒症相关的急性肾损伤中的研究进展
李浩鹏,吴 刚,杨天赐,周 娟,吴登龙
(1.同济大学附属同济医院泌尿外科,上海 200065; 2.同济大学附属同济医院超声诊断科,上海 200065; 3.同济大学附属同济医院重症医学科,上海 200065)

1 S-AKI的发病机制
脓毒症是危重症患者AKI发生的最常见病因[3],但是关于其发病机制尚不明确。过去,经典理论主要集中在脓毒症所导致的全身性血流动力学紊乱上,其强调关键因素为肾血流量(renal blood flow,RBF)减少所致的全肾低灌注,与全身血管阻力降低有关[4]。近些年的研究发现,即使保持足够的RBF,微循环仍未得到改善[5-6]。目前认为,S-AKI存在多种发病机制,普遍得到广泛的认可的有以下3种机制:全身炎症反应、微循环障碍和代谢重编程[1,4]。其中,微循环功能障碍被认为是S-AKI导致器官功能障碍的关键机制[7]。
2 S-AKI的诊断
S-AKI需同时满足脓毒症和AKI两个定义特征的临床综合征。2016年《第三版脓毒症与感染性休克定义的国际共识》发布对脓毒症的定义:脓毒症即机体对于感染的失控反应所导致可以威胁生命的器官功能障碍[8]。近年来,在既往AKI的诊断标准上进一步完善了其诊断与分级标准。2012年的改善全球肾脏病预后组织(KDIGO)对AKI定义为以下任一情况:(1) 血肌酐(serum creatinine,SCr)48 h内升高达≥(>26.5 μmol/L);(2) SCr在7 d内升高达基础值的≥1.5倍;(3) 尿量<0.5 mL/(kg·h),持续6 h,同时将AKI分为3期,见表1。
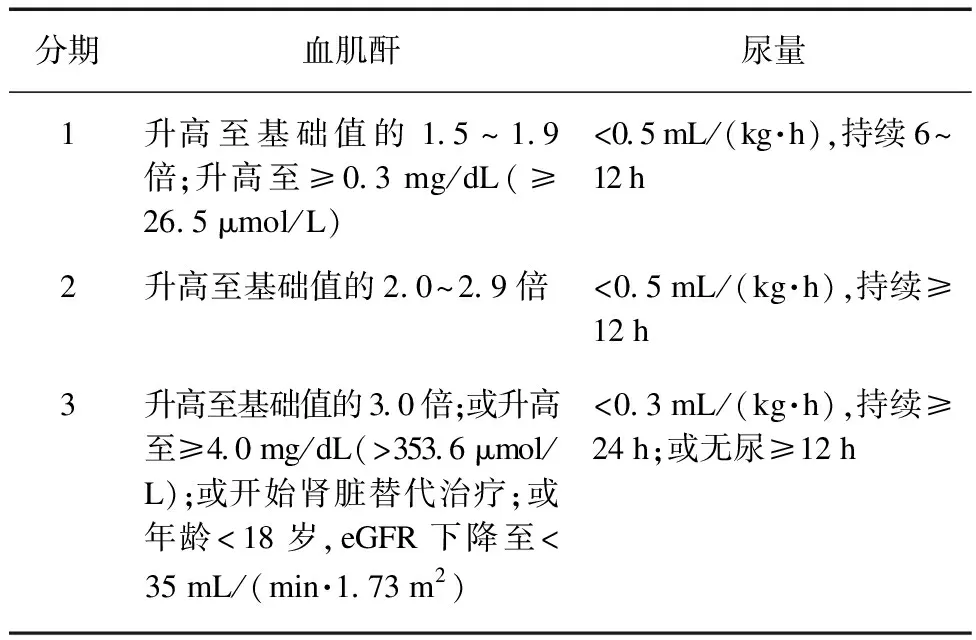
表1 AKI分期
3 超声指标在S-AKI患者中的应用
随着超声技术的发展,床旁超声的应用越来越广泛,尤其是对重症患者及时地进行床旁超声检查可以快速监测病情变化。床旁超声在评估S-AKI患者方面也显示出其独特的优势。与其他影像学检查相比,超声检查对肾脏疾病的监测具有重要意义。计算机X射线断层扫描(CT)在检测肿瘤、结石和钙化方面的灵敏度高于超声,磁共振成像(MRI)在评估血管方面具有独特优势。然而,在评估AKI方面,超声检查要优于CT和MRI,并可能与肾组织病理学变化相关[9]。研究表明,对S-AKI患者进行肾动脉阻力指数监测、增强超声造影检查和能量多普勒超声等检查,在评估AKI的严重程度和预后以及指导临床治疗等方面具有重要的价值[10]。
3.1 肾动脉阻力指数
肾动脉阻力指数(renal resistive index,RRI)是通过超声测量肾内弓状动脉或叶间动脉(图1)收缩期最高流速(peak systolic velocity,PSV)及舒张末期最低流速(end diastolic velocity,EDV),通过计算公式RRI=PSV-EDV/PSV得到的数值[11]。肾血流分级见图1。RRI值其可以反映肾血管血流阻力,正常RRI值测量见图2。S-AKI的RRI≥0.679[12]。当全身有效循环血容量不足时,由于肾脏对缩血管物质更敏感,肾血管收缩较外周血管更加明显。因此,RRI的变化可较早反映外周及肾脏微循环情况,RRI的升高常提示肾脏血流灌注不足。AKI患者异常升高的RRI值见图3。多项研究表明,在S-AKI的患者当中,RRI值有一定的预示作用。一项单中心回顾性研究对111例AKI患者的肾脏超声特征进行了评估,研究发现S-AKI患者的RRI明显升高[13]。另一项研究中,研究人员连续7 d测量了入住ICU AKI组和非AKI组患者的RRI值,发现随着时间的推移,两组的RRI均呈轻微上升趋势;AKI组的RRI明显高于非AKI组,而7 d内不同时间测得的RRI差异无统计学意义[14]。猜测S-AKI患者RRI升高可能不具有时间依赖性。RRI值不仅对S-AKI患者的诊断具有价值,多项研究显示,其对AKI的分层预测也有一定的意义。在一项83例患者的前瞻性研究中,彩色多普勒超声用于评估RRI并预测入院后6 h内AKI的发生;结果表明在心力衰竭和脓毒症亚组AKI3级和AKI0-2级中的RRI值有着明显差异,表明RRI值可以预测重度AKI[15]。急性胰腺炎入院时高RRI是重度AKI发生的重要预测指标[16],对重度AKI的发生有着较好的预测价值。RRI的联合应用的价值可能优于RRI独立预测的价值。一项动物实验研究显示,RRI联合超声心动图可以更早地预测脓毒症患者AKI的发生;在非常早期(3 h),RRI与超声心动图参数相结合,接受者操作特性曲线下的面积(AUC)为0.948,显示出对S-AKI的良好预测价值,预测价值远高于肌酐(Scr)、尿素(BUN)[17]。同样的,有研究人员[18]发现,RRI和中心静脉压(CVP)的联合应用在预测脓毒性休克诱发AKI方面AUC值大于单独使用RRI或CVP的AUC值,但是预测价值不高。但是也有研究表示,RRI的作用尚存争议。一项多中心队列研究中[19],118例脓毒症患者在入组时无AKI。作者比较了3 d后发生AKI和未发生AKI患者的RRI值,未发现明显差异,原因可能是RRI与肾阻力的相关性受到多种因素的影响[20-21]。另外一些肾内或全身血流动力学因素会影响RRI与肾脏阻力的相关性,其中最重要的是血管顺应性;RRI与肾血管阻力之间的关系仅在顺应性正常时呈线性关系,并随着血管顺应性的降低而逐渐降低[20,22-23],另外动脉硬化也会影响RRI,随着动脉硬化程度的增加,RRI与肾血管阻力的关系减弱[22]。同时RRI也受几个变量的影响,包括脉压、心率、动脉硬化、潜在的慢性肾脏疾病、主动脉瓣狭窄等瓣膜疾病以及限制其在床旁应用的药物等[24]。RRI值可通过床旁超声测量,无创、简便等特点使得在临床得以广泛应用。越来越多的研究表明RRI在S-AKI的诊断价值方面要优于肌酐、尿量等传统标志物,并且对患者的预后起到一定的预测作用,RRI值在肾脏可视化方的价值正在逐渐被研究者发掘和认可。

图1 肾血流分级
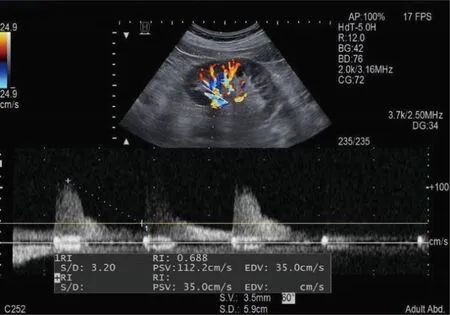
图2 正常RRI值测量
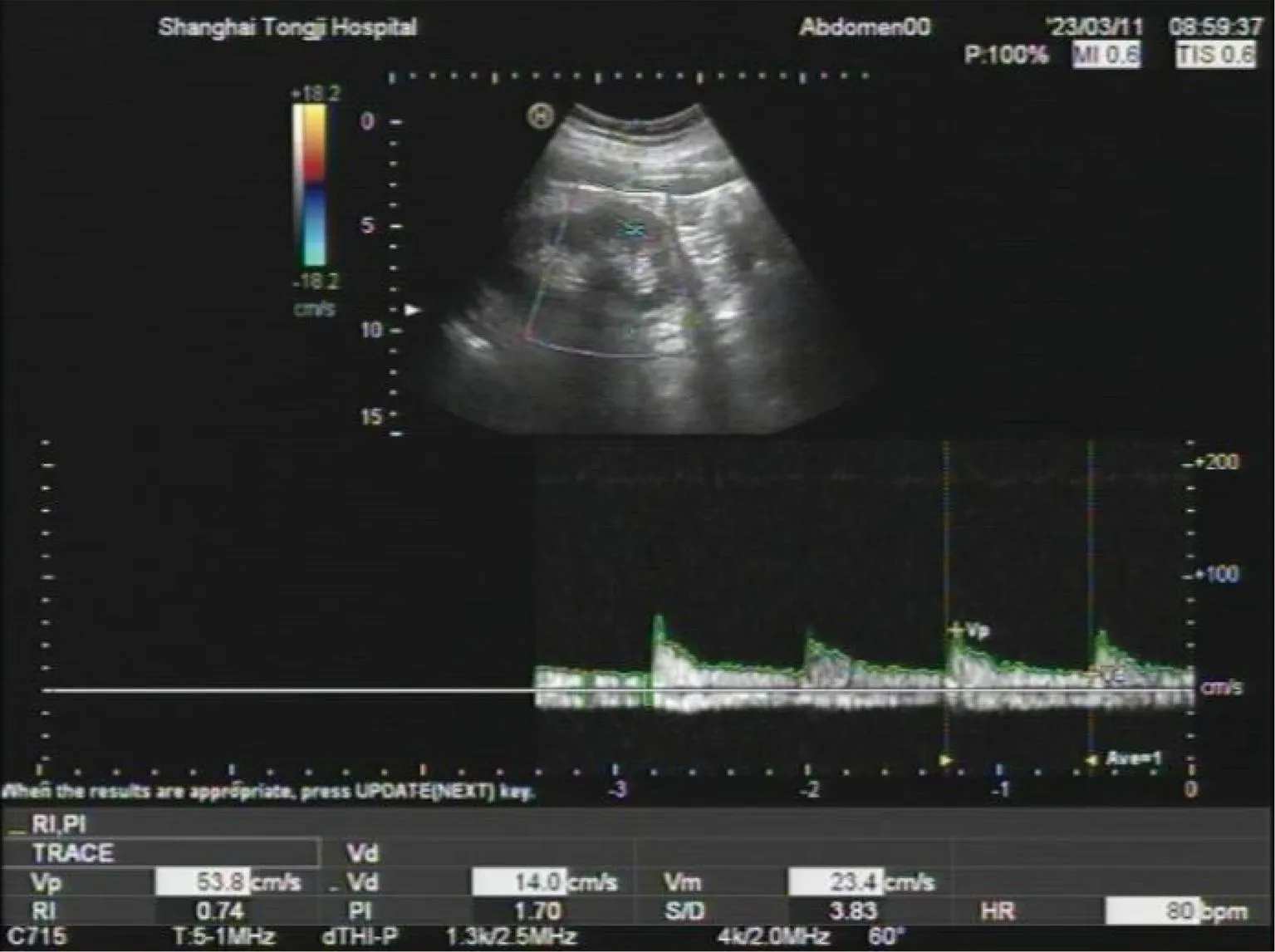
图3 AKI患者异常升高的RRI值
3.2 增强超声造影
增强超声造影(contrast enhanced ultrasound,CEUS)是基于向体内静脉注射或滴入微泡制剂的一种动态成像技术,以微泡为指示剂,观察同一位置在不同时刻微气泡浓度(强度)的变化,即可以得到以时间为横轴、浓度(强度)为纵轴,微气泡的时间-浓度(强度)曲线,然后根据注射方式的不同用数学模型进行拟合,可以得到反映组织器官血流灌注的参数,使病灶血流分布及灌注情况清晰显示[25],以提高病变的检出率并对病变的良恶性进行鉴别,肾脏增强超声造影见图4。普通超声在评估血液微循环和肾脏灌注方面具有一定的局限性,在这些情况下,超声造影剂可以提高常规超声的诊断能力,同时可以减少腹腔气体和液体的干扰[26]。在CEUS期间,使用静脉造影剂会增加血液回声,并在使用超声检查时增强微循环肾灌注的可视化。另外最大的特点在于它的实时、动态显示,可观察到病灶的整个血流灌注过程。由于CEUS对于病变增强信号的高灵敏度和高分辨率,可在其他方式无法确诊的情况下检测病变增强信号,因此可作为补充检查方式,检测未经CT或MRI确诊的病变[27]。造影过程中通过软件显示的时间-强度曲线[28]提供了丰富的定量信息:曲线上升斜率(wash-in slope,WIS)、达峰时间(time to peak,TTP)、峰值强度(peak intensi-ty,PI)、曲线下面积(area under curve,AUC)。时间-强度曲线见图5。TTP是指从推药到造影剂灌注达到峰值的时间,与组织灌注速度有关;PI是曲线尖端强度最大值,反映病灶内平均血容量;WIS与组织灌注的快慢程度有关;AUC与感兴趣病灶内的平均血容量成正比;平均通过时间(mean transition time,MTT)是从造影剂刚到达时的强度下降到一半所用的时间。临床医生根据定量参数可以评估肾脏的血供情况及监测治疗效果[29]。Harrois等[30]的一项研究表明,与未发生AKI的患者相比,发生严重AKI(KDIGO 2期或3期)的脓毒症患者的肾皮质微循环灌注显著减少。这项研究确定了脓毒症患者肾皮质灌注受损与严重AKI发展之间的关联,即CEUS测量的造影剂平均通过时间越长,患严重AKI的风险更大。这一结论突出了肾微血管改变在脓毒症引起的AKI中的核心作用。同样的,Watchorn等[31]的一项最新的单中心研究中,使用CEUS对50例脓毒症患者和10例健康志愿者进行肾皮质灌注评估,严重AKI患者的CEUS平均通过时间明显延长,峰值强度(PI)降低,但全身和局部血流动力学的指标没有明显差异,提示AKI的严重程度与肾皮质低灌注的程度有关,并且这种低灌注似乎与局部或全身血流的改变无关。PI等指标虽然有较好的诊断价值,但特异性较低,为了探索一种能够准确诊断S-AKI发生的方法,有研究学者将独立诊断精度高的指标相结合,发现Scr、WIS和PI联合诊断S-AKI的准确率最高(AUC=0.943),在单独诊断脓毒性AKI时显著高于各指标的AUC。其灵敏度和特异度分别为94.59%和81.13%。建议Scr、WIS和PI联合诊断S-AKI可以达到更高的准确性[32]。在某些情况下,病变组织和正常组织的灌注差别极其细微,仅通过肉眼观察二维图像难以对病变组织进行性质判断。通过对造影图像进行时间强度曲线分析,获得血流灌注的量化信息,能够对细微的差别进行辨别,把握整体灌注趋势、并获得灌注的分析参数量化灌注过程,可以更快地发现细微的病灶。总之,CEUS在S-AKI中的作用正在得到广泛的关注,在探索S-AKI的机制中起到越来越重要的作用。

图4 肾脏增强超声造影前后比较

图5 时间-强度曲线
3.3 能量多普勒超声

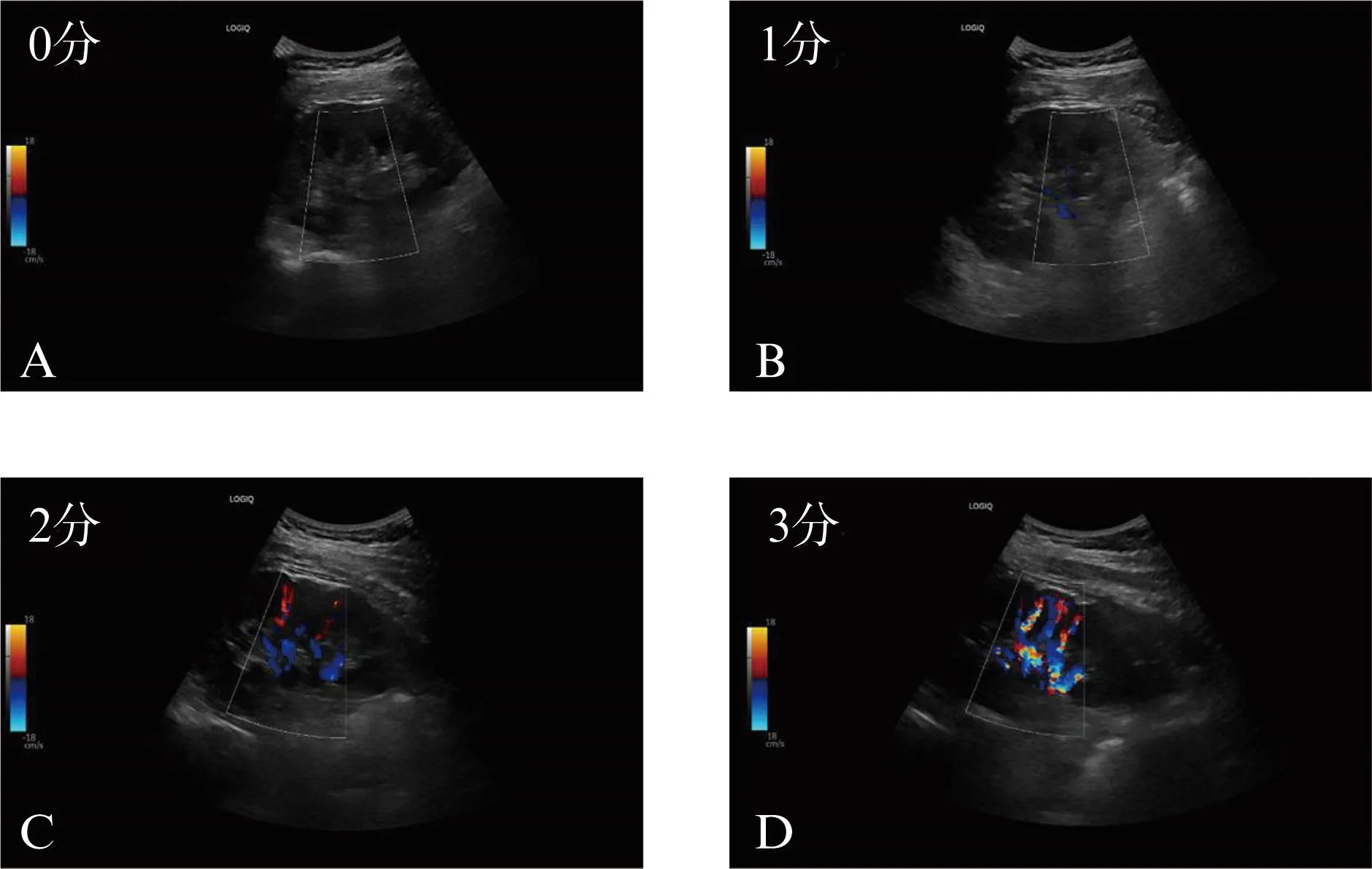
图6 PDU评分
3.4 心肺超声
在S-AKI患者中,由于S-AKI患者血流动力学的改变影响了全身循环系统,引起水钠潴留,容量过负荷,严重影响心肺功能。在一项64例的回顾性研究中[39],将入住ICU脓毒症并发AKI的患者根据预后情况,分为28 d病死组以及28 d存活组,与28 d存活组比较,28 d病死组的双肺超声评分、下腔静脉内径(IVC)、肺动脉收缩压(PASP)都显著升高;下腔静脉吸气塌陷率、射血分数(EF)、每分钟输出量(CO)都明显降低,差异均有统计学意义(P<0.05)。提示病死组心功能减低、容量负荷过高、血管外肺水增多。心肺是体内循环的重要器官,两者相互联系,相互影响,在S-AKI患者中,二者的功能进一步下降,说明了S-AKI引起的血流动力学改变对全身循环系统的影响。
4 结 语
S-AKI是重症监护室常见的疾病,疾病进展迅速,致死率高,临床医生需根据病情尽早对患者实施集束化治疗,所以对AKI的早期诊断显得尤为重要。一般来说,AKI的诊断是基于血清肌酐浓度的变化,但这些变化很难反映肾功能的急性恶化,并且血清肌酐水平缺乏灵敏度和特异度,导致延迟诊断和漏诊率较高[40]。目前正在寻找有可能早期诊断和评估预后的新的尿液和血清生物学标志物[10]。近些年来,虽然也发现了很多生物标志物,包括反映肾小球功能受损的标志物、肾小管组织损伤及功能受损的标志物以及肾小管炎症的标志物等等;但是在临床应用上还很有局限性,没有广泛地用于临床决策。超声成像技术可以直观地体现出有关肾脏解剖结构、梗阻、炎症和水肿的程度[41],对临床有很好的指导作用,可以更早地发现肾脏结构的变化,在S-AKI的诊断和治疗方面起到了越来越重要的作用,为降低S-AKI的死亡率提供了重要的助力。然而,超声成像技术受肾内及全身血流动力学、年龄、体重指数、血管活性药物等众多因素影响,不同病因或不同血流动力学状态下发生S-AKI的病理生理机制并不一致,可能会影响RRI、CEUS、PDU对S-AKI的评估价值。所以在临床工作中,应用超声成像技术对S-AKI进行评估,需结合患者的年龄、体重指数、导致S-AKI的病因以及全身血流动力学状态等进行个体化解读。

