子宫腺肌病患者外周血、衍生参数及凝血功能的临床分析
桑佳特,杜雪
(天津市人民医院妇科,天津 300121)
子宫腺肌病是指子宫内膜腺体和间质细胞侵入子宫肌层,伴有邻近的子宫平滑肌层增生和肥大,导致子宫弥漫性增大或在局部形成腺肌瘤的常见疾病[1]。该病好发于30~50 岁的经产妇,约15%合并子宫内膜异位症,约50%合并子宫肌瘤。子宫腺肌病患者逐渐年轻化,约有5%~25%在39 岁以下[2]。近年来,有关子宫腺肌病患者发生血栓性病变的报道,包括脑梗死、弥散性血管内凝血和静脉血栓栓塞症等,国内外约有30 多例[3]。这些研究分析了患者的病例特点以及相关危险因素,推测可能与组织因子表达增加、贫血和月经过多、炎症、子宫体积增大和血清糖类抗原125(CA125)水平升高等相关,但是确切的凝血功能变化机制并不清楚。
本研究比较了子宫腺肌病患者与对照组的外周血血细胞、衍生参数及凝血指标,为子宫腺肌病患者凝血功能变化提供了新的数据,有助于进一步了解其病理生理变化情况,为未来探讨子宫腺肌病患者凝血功能的变化规律提供依据。
1 对象和方法
1.1 研究对象 本研究是回顾性分析,选择2018 年9 月—2023 年8 月于天津市人民医院妇科住院治疗的子宫腺肌病患者26 例,设为子宫腺肌病组,年龄34~58 岁,平均(47.12±6.42)岁。另选取同期良性卵巢囊肿或子宫内膜单纯性增生患者33 例作为对照组(除外子宫肌层病变),年龄17~83 岁,平均(40.15±17.60)岁。排除标准:(1)合并子宫平滑肌瘤。(2)合并子宫内膜异位症。(3)合并附件包块扭转、破裂、感染等疾病。(4)放置含激素的节育器患者。(5)合并风湿免疫性疾病。(6)合并心、肝、肾及血液系统等相关疾病。(7)合并有临床症状的全身或局部感染。(8)合并恶性肿瘤。(9)服用影响炎症因子及凝血功能的有关药物。(10)合并血栓或静脉滤器置入术后的患者。
1.2 方法 统计患者一般临床资料,包括年龄、生育史、术前1 个月内CA125 值、术前子宫大小[妇科超声计算子宫体积=长度(cm)×宽度(cm)×厚度(cm)×0.523]。患者入院前后1 周内的凝血酶原时间(PT)、活化部分凝血酶原时间(APTT)、凝血酶时间(TT)、纤维蛋白原(FBG)、D-二聚体、血小板(PLT)、中性粒细胞计数、淋巴细胞计数、单核细胞计数,同时计算中性粒细胞计数与淋巴细胞计数比值(NLR)、血小板与淋巴细胞计数比值(PLR),计算系统性免疫性炎症指数(SII)=(血小板×中性粒细胞计数)/淋巴细胞计数,全系统性炎症反应指数(SIRI)=(中性粒细胞计数×单核细胞计数)/淋巴细胞计数。
1.3 统计学处理 采用SPSS26.0 软件进行统计学分析,其中计量数据经正态性检验,若符合正态分布,结果以表示,组间比较采用独立样本t检验。数据若为偏态性分布,结果以M(P25,P75)表示,组间差异性比较采用Mann-Whitney U检验,组内相关分析采用Spearman秩相关,通过绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC)、敏感性、特异性及诊断临界值。P<0.05 表示差异有统计学意义。
2 结果
2.1 一般临床资料的比较 子宫腺肌病组年龄、孕产次与对照组差异均无统计学意义(均P>0.05)。而子宫体积大于对照组,CA125 水平高于对照组(均P<0.01),见表1。
表1 两组患者一般临床资料比较[,M(P25,P75)]Tab.1 Comparison of general clinical data between two groups of patients[,M(P25,P75)]
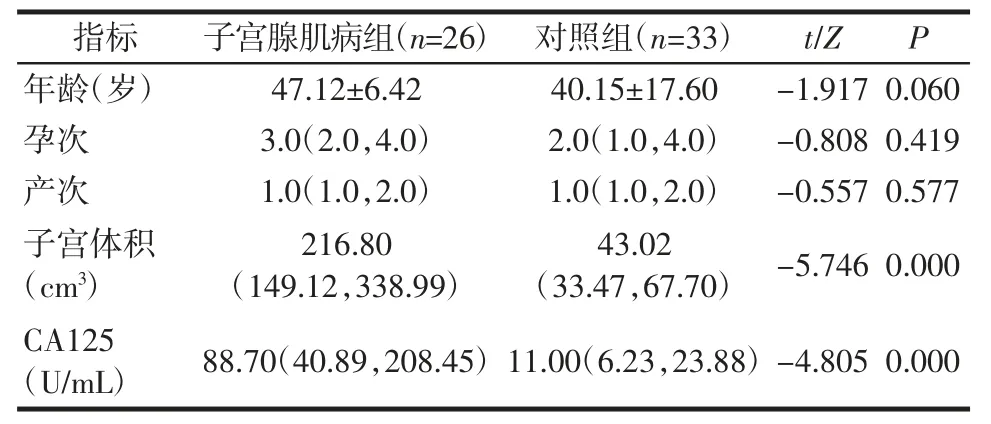
表1 两组患者一般临床资料比较[,M(P25,P75)]Tab.1 Comparison of general clinical data between two groups of patients[,M(P25,P75)]
注:CA125:血清糖类抗原125
?
2.2 外周血及衍生参数比较 子宫腺肌病组血红蛋白明显低于对照组(P<0.01),PLR 及SII 高于对照组(均P<0.05)。两组患者的外周血白细胞、中性粒细胞、淋巴细胞、单核细胞以及血小板间的差异无统计学意义(均P>0.05),见表2。

表2 两组患者外周血及衍生参数比较[M(P25,P75)]Tab.2 Comparison of peripheral blood cells and derived parameters between two groups of patients[M(P25,P75)]
2.3 凝血功能的比较 与对照组相比,子宫腺肌病组TT 明显缩短(P<0.05),而PT、APTT、纤维蛋白原以及D-二聚体之间差异无统计学意义(均P>0.05),见表3。
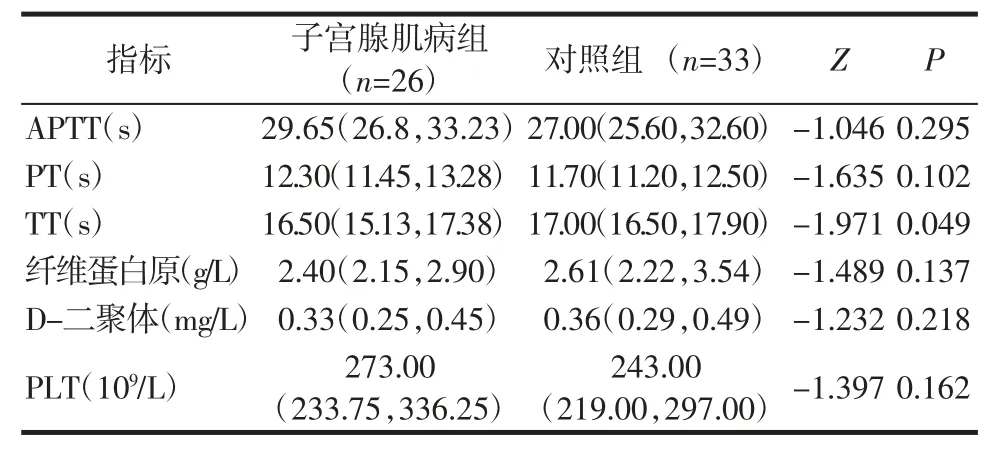
表3 两组患者的凝血功能比较[M(P25,P75)]Tab.3 Comparison of coagulation function between two groups of patients[M(P25,P75)]
子宫腺肌病非出血期患者与对照组非出血患者纤维蛋白原差异具有统计学意义(P<0.05),见表4。子宫腺肌病非出血贫血患者与对照组非出血贫血患者相比,APTT 延长(P<0.05),见表5。
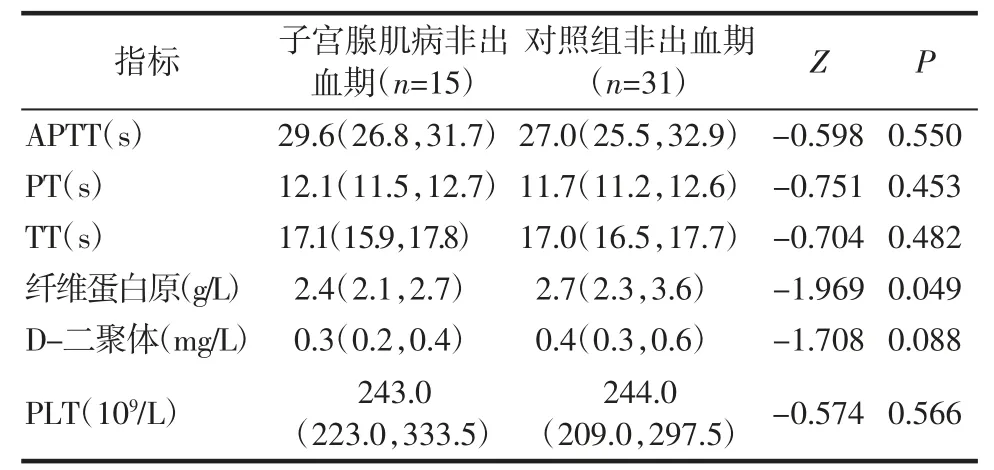
表4 两组非出血期患者的凝血功能比较[M(P25,P75)]Tab.4 Comparison of coagulation function between two groups of non-bleeding stage patients[M(P25,P75)]

表5 两组非出血期贫血的患者凝血功能比较[M(P25,P75)]Tab.5 Comparison of coagulation function between two groups of patients with non-bleeding anemia[M(P25,P75)]
2.4 子宫腺肌病患者凝血功能与血红蛋白、CA125以及子宫体积之间的相关性分析 子宫腺肌病患者TT 与血红蛋白呈正相关(r=0.466,P=0.016),而与CA125、子宫体积无相关性。
2.5 血红蛋白、PLR、SII、TT 及CA125 在诊断中的价值 绘制ROC 曲线,见图1。CA125、PLR、SII 诊断子宫腺肌病的曲线下面积(AUC)分别为0.883、0.665,0.644。PLR 的诊断界值是124.2,敏感性91.7%。SII 的诊断界值是505.42,CA125 的诊断界值是40.71,敏感性和特异性分别是75%和96.7%。
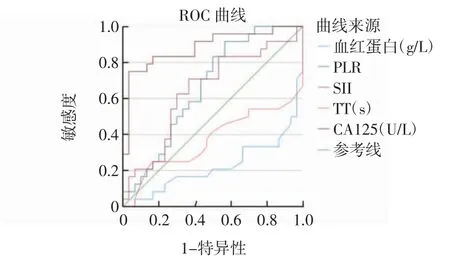
图1 ROC 曲线评价PLR、SII、CA125 在子宫腺肌病中的诊断价值Fig.1 Analysis of ROC curve in the diagnostic value of PLR,SII,and CA125 in adenomyosis
3 讨论
Yamanaka 等[4]研究发现,子宫腺肌病患者处于高凝状态,并有可能导致心肌梗死及血栓的形成。Cernogoraz 等[5]研究发现,在子宫腺肌病合并弥散性血管内凝血(DIC)的患者子宫内膜中存在多种纤维蛋白性血栓,以上均提示子宫腺肌病患者凝血功能存在异常。
在凝血功能的指标中,PT 是外源性凝血系统的敏感指标,而APTT 反映的是内源性凝血系统。FIB又称凝血因子Ⅰ,其与凝血酶、FXⅢa、Ca2+等多种因素共同作用,生成纤维蛋白,并与之发生交联,从而使其与红细胞、血小板及血浆α-2 抗纤溶酶等形成稳定的血栓结构,因此FIB 在血栓性疾病患者中会呈现高水平。D-二聚体是纤维蛋白以及FIB 在机体内的分解产物,可用来判定是否存在血栓和继发性纤维蛋白溶解。因此,体内D-二聚体含量升高,是机体高凝及以及纤维蛋白溶解增强的一个指标。TT正常的参考范围约为14~21 s,主要反映的是FIB 转化为纤维蛋白的时间。徐凡等[6]研究显示,子宫腺肌病组患者APTT 及PT 较对照组明显缩短。有动物实验发现,若存在APTT 或PT 缩短,同时伴有D-二聚体的升高,则血栓发生的风险明显增加,提示存在高凝状态[7]。张会媛等[8]研究结果提示,在非经期子宫腺肌病患者中D-二聚体水平升高,在子宫腺肌病出血期的患者中PT 明显缩短,并且D-二聚体水平升高。本研究结果显示子宫腺肌病患者APTT 及PT 较对照组延长,FIB 低于对照组,但以上差异均无统计学意义(均P>0.05)。比较子宫腺肌病非出血期患者与对照组非出血期患者发现,FIB 的差异有统计学意义。再将非出血患者按贫血分层后,子宫腺肌病非出血贫血组与对照非出血贫血组相比,APTT 明显延长(P<0.05)。这与张德玉等[9]的结果相似,子宫腺肌病患者APTT 延长,考虑是部分内源性凝血途径的凝血因子消耗或FIB 丢失所导致。本研究的对照组排除了合并子宫肌瘤的患者,这样能有效排除因子宫肌瘤引发月经量过多而造成的凝血功能异常。
虽然目前在子宫腺肌病患者中观察到高凝状态,除了发现凝血指标的变化,还有血小板计数和体积的变化、子宫体积增大、贫血、CA125 升高和炎症因子等,但引发高凝状态的原因仍然不清楚。有研究发现血小板出现在子宫腺肌病病灶中,而在健康的子宫内膜组织中却没有血小板,提示血小板的活化与聚集可能与子宫腺肌病的发病机制相关[10]。更多研究表明,血小板可以通过转化生长因子β-1信号通路介导上皮向间充质转化和成纤维细胞向肌成纤维细胞转化,从而损害自然杀伤细胞的反应性和功能[11],增加雌激素的产生[12],并诱导炎性因子和血管生成因子的合成[10-13],导致子宫腺肌病的发展和进展。有学者提出子宫腺肌病的凝血参数应包括血小板计数、APTT、PT、TT 和FIB,这些参数也有助于子宫腺肌病的临床诊断。Bodur 等[14]研究发现,子宫腺肌病患者的平均血小板体积(MPV)增加,而血小板计数并没有变化,提示MPV 可以作为该疾病的诊断标志。然而,最近的一项研究并没有在子宫腺肌病病灶中发现血小板[15]。Coskun 等[16]的一项病例对照研究表明,PC 和MPV 与子宫腺肌病无关。显然,血小板是否参与子宫腺肌病的发病机制仍需进一步研究。
此外,子宫的大小也可能诱发子宫腺肌病患者出现高凝状态。Yamanaka 等[4]发现当子宫腺肌病患者的子宫体积大于100 cm3时,有激活凝血系统的风险。病例报道也发现,在合并脑梗死、DIC 和静脉血栓栓塞症的子宫腺肌病患者中,有77.42%(24/31)合并子宫体积增大[5,17-19]。有国内学者推测增大的子宫会压迫髂血管,造成血液流动变慢,再加上月经期会导致反应性血小板和红细胞增加,从而出现高凝状态[3]。张德玉等[9]研究显示,子宫腺肌病患者存在明显的凝血功能异常,提出月经过多可能参与并加重了凝血功能的异常,而且子宫腺肌病患者的PT和FIB 与子宫大小呈正相关(P<0.05)。说明子宫体积过大是子宫腺肌病患者出现凝血功能异常的危险因素。
贫血会损伤红细胞的质量和活性,从而影响凝血机制,最终引发凝血指标的变化[20-22]。研究表明,缺铁性贫血和口服避孕药分别因为低氧状态和雌激素反应元件诱导转铁蛋白过表达,使机体处于高凝状态[23]。并且,血小板和红细胞之间通过FasL/FasR信号通路相互作用,引发高凝状态[24]。临床上,子宫腺肌病患者常表现为月经过多,引发贫血或其他并发症,如DIC、急性肾功能衰竭和脑梗死等,提示了贫血在激活凝血机制中的可能作用[25-27]。
血CA125 是一种黏蛋白分子,在卵巢上皮癌患者中显著升高,数据显示卵巢上皮癌患者围术期血栓栓塞的发生率与手术前血CA125 水平有显著的相关性(P<0.05)[28]。将纯化的黏蛋白注射到小鼠体内时,会导致富含血小板的血管内微血栓。黏蛋白相关的促凝机制被认为是通过选择素与血细胞之间的相互作用发生的,即中性粒细胞上的L-选择素和P-选择素糖蛋白配体-1 以及血小板上的P-选择素相互作用,从而形成微血栓[29-30]。张会媛等[8]研究发现,多数子宫腺肌病患者在月经期出现血栓性病变,且其血清CA125 及D-二聚体含量明显升高,推测月经期女性更容易出现血栓性病变。有国内学者发现,在CA125 水平升高的子宫腺肌病患者中,15 例合并脑梗死,2 例合并静脉血栓栓塞,1 例合并DIC,推测血CA125 水平可能与子宫腺肌病的高凝状态有关[3]。
机体的炎性反应可以激活凝血系统,后者也可以对炎性反应进行调控。在炎性状态下,内皮细胞损伤导致大量组织因子(TF)释放,同时,炎性反应会刺激内皮细胞、单核细胞、巨噬细胞及树突状细胞(DC)等分泌TF,而TF 可以激活外源性凝血途径,进而引起凝血功能紊乱。此外,活化的TF/FⅦa、TF/FⅦa/FⅩa 复合体、凝血酶及纤维蛋白均可调控炎性反应,而凝血因子又可经蛋白酶活化受体(PAR)调控炎性反应。有学者提出子宫腺肌病是一种慢性炎症性疾病,在子宫腺肌病病灶中发现高表达的炎症介质,如肿瘤坏死因子(TNF)-α、TNF-β、白细胞介素(IL)-1、IL-8、IL-10 等[31]。由于炎性因子的过度表达,使其在体内产生了大量的血小板聚集,从而引起了PT 和APTT 的变化。同时,血液中的凝血因子和血小板也可通过诱发炎症,导致白细胞、中性粒细胞、SII 和SIRI 发生变化。因此有学者推测,子宫腺肌病患者中炎症与凝血功能存在交互作用,从而引起机体炎症激活和凝血障碍,但其确切机制尚不明确。有研究显示,血小板、SII 及APTT可用于预测子宫腺肌病的发生[6]。本研究结果提示,PLR、CA125 对预测子宫腺肌病有诊断价值。但是,样本例数不多,而且未能将健康女性作为对照。另外,本研究未涉及月经期女性,无法反映出女性在月经期凝血功能的变化。虽然张会媛等[8]研究显示,健康女性月经期与非月经期的凝血指标无显著差异。但月经期对子宫腺肌病患者凝血功能的影响还需要更多的研究。
本研究比较了子宫腺肌病患者与子宫肌层无病变的女性在子宫出血期和非出血期凝血指标的差异,为子宫腺肌病患者凝血功能变化提供了新的研究依据,同时也为临床诊断和治疗提供了新思路。

