肉鸽肠道微生物菌群差异分析和抗生素耐药基因预测
陶 洁,李本强,程靖华,石 迎,刘佩红,刘惠莉*
(1.上海市农业科学院畜牧兽医研究所,上海 201106;2.上海市农业遗传育种重点实验室,上海 201106;3.农业农村部区域特色畜禽品种疾病防控重点实验室(部省共建),上海 201106)
我国肉鸽规模化养殖起步晚,上海市和广东省分别于1976年和1980年引进国外肉鸽品种,自此由南向北、由沿海到内地迅速展开,逐步形成了中国的肉鸽养殖产业[1]。目前,我国肉鸽产业仍以传统饲养模式为主,肉鸽生长和饲养管理研究数据缺乏[2]。近年来,随着肉鸽消费需求量的增加,肉鸽产业技术研究逐步受到重视。
众所周知,肠道微生物群落具有生物多样性功能,与健康和疾病息息相关,除了协助宿主营养吸收和能量摄取、调控新陈代谢,还可促进肠道发育,参与免疫调控以增强抵抗力等[3]。影响动物肠道菌群变化的诱因很多,包括饲养管理水平、饲料营养配比、疾病以及动物机体发育程度等[4],特别是乳鸽,在断乳后因各种外界因素引起菌群失调,导致腹泻[5]。
目前,宏基因组(metagenome)技术是微生物多样性研究的主要手段,不仅能挖掘新基因及其代谢产物等,而且在酶的发现、新药开发、抗生素耐药组等方面具有广阔应用前景[6]。近年来,随着抗生素的大量使用,抗生素耐药问题已成为全球公共卫生面临的严峻威胁[7]。因此,本研究拟利用宏基因组技术对上海某肉鸽养殖场青年鸽和产鸽粪便样品进行微生物菌群差异分析,丰富肉鸽肠道微生物多样性数据,为疾病防控提供参考。同时,深入挖掘分析肉鸽体内抗生素耐药基因谱,以期发挥预警功效,助力肉鸽健康养殖。
1 材料与方法
1.1 粪便样品来源
从上海某肉鸽养殖场分别采集青年鸽(2~5月龄)和产鸽(5月龄以上样品)粪便样品各20份,分别命名为RP组和LP组。RP组包含2个测序样品:JD-1和JD-2。LP组包含2个测序样品:JD-3和JD-4。每个测序样品中包含10份来自不同棚舍的鸽粪样。
1.2 高通量测序与功能预测分析
基于Illumina NovaSeq/HiSeq高通量测序平台,采用全基因组鸟枪法(Whole Genome Shotgun, WGS)策略,利用OMEGA Mag-Bind Soil DNA Kit(Omega Bio-Tek, Norcross, GA, USA)提取样品基因组DNA,进一步利用Illumina TruSeq Nano DNA LT Library Preparation Kit构建文库,并进行双端(Paired-end,PE)测序。对原始数据进行筛查和过滤,用Cutadapt(v1.2.1)[8]软件去除3′端潜在接头序列,以及小于50 bp和含有模糊碱基的序列;利用minimap2软件比对质控后的有效序列与宿主序列,舍弃与宿主有匹配的序列;最后利用Kraken2和Kaiju两种方法进行物种注释[9]。采用MetaGeneMark软件识别重叠群序列(contigs)中的开放阅读框, 并预测编码区域,获得对应基因和蛋白序列文件[10],按相似度95%,对齐区域覆盖度90%进行去冗余,获得非冗余的蛋白序列集合,并与NCBI的nr数据库进行比对, 设置灵敏度参数为5.7,lca-mode 为4[11]。将上述过滤处理后的蛋白序列集与常用蛋白数据库比对,进行KEGG、EggNOG和CAZy注释分析[12]。
1.3 数据处理与分析
使用R软件进行主坐标分析(PCoA)、Venn分析、PLS-DA和LEfSe分析[13]。
2 结 果
2.1 测序数据整理和评估
对4个肉鸽粪便样品进行宏基因鸟枪法测序,得到309 617 334个原始序列共46.75 GB的原始数据。质控分析显示,这4个样品的有效序列比例均高于98.5%,N50长度为1 698~2 321 bp(表1)。
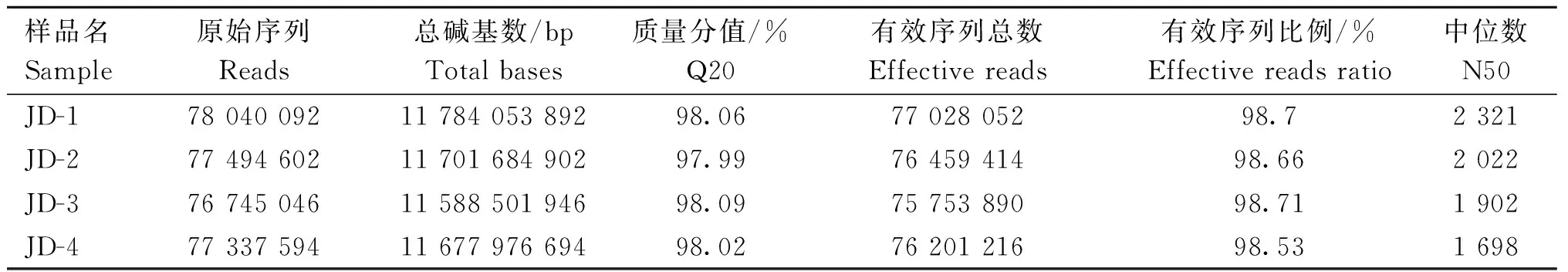
表1 具体测序信息Table 1 Sequencing informations
2.2 肠道菌群组成结构特征
基于OTUs分类结果,共注释到细菌10门27纲57目117科323属1 053种。如图1A,两组样品中相对丰度最高的3个菌门均为厚壁菌门(Firmicutes)、变形菌(Proteobacteria)和放线菌(Actinobacteria)。其中厚壁菌(LP 40.34%,RP 57.49%)和变形菌(LP 54.63%,RP 34.68%)相对丰度之和超过90%,是肉鸽粪便样品中的优势菌。放线菌为第3丰度菌门,在青年鸽和产鸽样品中分布比例相似(LP 5.02%,RP 7.82%)。

图1 青年鸽和产鸽肠道菌群在门水平(A)和属水平(B)的相对丰度Fig.1 Relative abundance of intestinal microbiota of young pigeons (RP) and older pigeons (LP) at phylum (A) and genus (B) levels
在属水平上,LP组相对丰度最高的5个菌属是:埃希氏杆菌属(48.19%)、肠球菌属(13.00%)、乳杆菌属(8.31%)、气球菌属(9.55%)、葡萄球菌属(4.55%);RP组相对丰度最高的5个菌属是:肠球菌属(26.56%)、埃希氏杆菌属(22.11%)、乳杆菌属(12.14%)、气球菌属(10.27%)、嗜冷杆菌属(8.92%)(图1B)。
2.3 肉鸽肠道菌群差异物种
在属水平分析青年鸽和产鸽体内差异物种,Venn图显示,LP和RP组共有700种相同菌种,137和216种差异菌种(图2A)。PLS-DA分析显示,RP和LP组具有分离现象(图2B)。基于MEGAN的多样本分类等级树图显示(图2C),肠球菌属(Enterococcus)中,仅3个物种是LP组占高比例,其余均为RP组占高比例,其中解糖肠球菌(Enterococcussaccharolyticus)几乎为RP组特有。RP组中双歧杆菌(Bifidobacterium)、棒状杆菌(Corynebacteriun)、嗜冷杆菌(Psychrobacter)、链球菌属(Streptococcus)含量显著高于LP组。而LP组金黄色葡萄球菌属(Staphyloccus)、短状杆菌属(Brachybacterium)、库特氏菌属(Kurthia)和埃希氏菌属(Escherichia)含量显著高于RP组。

A. 韦恩图; B. PLS-DA分析; C. MEGAN分类等级树A. Venn diagram; B. PLS-DA analysis; C. MEGAN classification rank tree图2 青年鸽和产鸽体内差异物种分析Fig.2 Species difference analysis of gut microbiota in young pigeons and older pigeons
2.4 肉鸽肠道微生物宏基因组的代谢特征
eggNOG分析显示未知功能基因数量最高,已知功能基因中复制、重组和修复相关基因占比最高(图3A)。KEGG分析显示(图3B),代谢组(Metabolism)丰度最高,其中碳水化合物代谢(Carbohydrate metabolism)和氨基酸代谢(Amino acid metabolism)是最丰富的功能门类,分别占总Reads的16.87%和9.97%。比对碳水化合物活性酶数据库(CAZy),共预测有118 642种CAZy,在六大类酶分子中糖苷水解酶(Glycoside Hydrolases, GHs)和糖苷转移酶(Glycosyl Transferases, GTs)占比最高,分别为45.17%和32.88%(图3C)。进一步利用LEfSe对青年鸽和产鸽肠道微生物菌群功能差异分析发现,差异表达基因主要富集于5个KEGG通路(图3D):生物合成(Biosynthesis)代谢通路、硫辛酸代谢(Lipod acid metabolism)通路、氧化磷酸化(Oxidative phosphorlation)通路和p53信号通路和阿米巴病通路。

A. eggNOG分析; B. KEGG分析; C. LEfSe分析A. eggnog analysis; B. KEGG analysis; C. LEfSe analysis图3 肉鸽肠道微生物菌群代谢功能差异分析Fig.3 Metabolic function differential analysis of gut microbiota in pigeons
2.5 抗生素耐药基因挖掘与分析
挖掘肉鸽体内抗生素耐药基因(Antibiotic resistance genes, ARGs)种类和组成,结果显示,青年鸽和产鸽体内ARGs组成均一度和相似度较高,共11大类198种ARGs,占比顺序为:多重耐药类>大环内脂类>磺胺类>β-内酰胺类>四环素类>万古霉素类>喹诺酮类>氨基糖苷类>elfamycin>氯霉素类>其他ARGs。其中多重耐药类ARGs占40%以上(图4A)。

A. ARGs分类和占比分析; B. ARGs预测分析A. ARGs classification and proportion analysis; B. ARGs prediction 图4 肉鸽抗生素耐药基因谱分析Fig.4 Analysis of antibiotic resistance gene profile in pigeons
青年鸽体内rpoC、Isa、YybT、gshF、gyrB、ileS、A1067、Erm、rpsA等ARGs丰富最高,产鸽体内mshA、gyrB、A1067、tetA、gyrA、fusA、YybT等ARGs丰富最高(图4B),主要源自大环内酯类、多重耐药类、喹诺酮类、氨基糖苷类和磺胺类抗生素。
3 讨 论
肠道菌群构成肠道微生态系统,通过与宿主间相互作用维持相对稳定状态,与机体健康状态密切相关[14]。但目前肉鸽肠道微生物菌群方面研究甚少,阻碍了肉鸽产业健康发展。
本研究利用宏基因组学技术对肉鸽粪便中微生物菌群多样性进行高通量分析,明确肉鸽肠道优势菌门为厚壁菌、变形菌和放线菌。这与肉鸡肠道菌群分布类似,肉鸡十二指肠、空肠和回肠部位厚壁菌门占比最高(>60%)[15],符合肉鸽具有强大消化吸收功能的特性。本研究通过分析青年鸽和产鸽粪便中微生物多样性差异,发现两者之间存在一定差异,青年鸽体内有益菌如双歧杆菌含量显著高于产鸽,而产鸽体内埃希氏菌属含量显著高于青年鸽。值得注意的是,青年鸽粪便中多种肠球菌含量都高于产鸽。肠球菌属于乳酸菌(LAB),益生肠球菌可有效抑制肠道病原菌,维护宿主肠道健康[16]。目前,屎肠球菌和粪肠球菌是最常用的益生肠球菌,属于饲料级微生物菌种[17]。本研究中青年鸽中屎肠球菌含量显著高于产鸽,提示随着日龄增加,产鸽体内有益菌群下降,病原菌数量增加。
抗生素耐药基因递增是各大养殖群体中普遍存在的难题[18],导致临床用药效果不理想,严重影响养殖业健康发展。本研究发现肉鸽体内ARGs多样性丰富,多重耐药类ARGs呈现高流行率。除了高丰度的β-内酰胺类、四环素类、大环内酯类等ARGs,肉鸽体内万古霉素和利福平等耐药基因流行率也较高。已报道结核分枝杆菌rpoA、rpoB、rpoC和rpoD位点突变可影响金黄色葡萄球菌等对利福平的敏感性[19]。而poA、rpoB和rpoC在青年鸽和产鸽体内具有显著的高流行率。肉鸽是一种在短期内即上市售卖的禽类产品,抗生素问题尤需注意,过度使用抗生素不仅造成抗生素残留,而且会导致抗生素耐药性问题。因此,在肉鸽养殖管理中,不仅要加强驱虫和消毒,保持环境卫生,而且特别要重视用药管理。
4 结 论
本研究系统分析了不同日龄肉鸽的肠道菌群差异和抗生素耐药基因,可为鸽场生物安全防控和饲料营养改善等提供数据参考。

