白蛋白结合型紫杉醇联合顺铂同步放疗治疗晚期子宫颈癌的临床效果*
林佳 王丹丹 林庆纯 陈斌 庄梅生
子宫颈癌早期无明显症状,随着病情进展可出现异常阴道流血、接触性出血等。子宫颈癌的治疗根据疾病类型及分期存在一定差异,对于中晚期子宫颈癌患者而言,尽管医疗设备不断改进,患者的5 年生存率仍无根本提高,且复发患者生存率更低,NCCN 等指南指出,为消除中晚期子宫颈癌的微转移灶,可采用放疗结合化疗的治疗方案[1]。在化疗药物的选择方面以铂类药物及紫杉类药物为主,临床常用紫杉类药物为溶剂型紫杉醇,主要存在问题为增溶剂具有较大心脏毒性,且可引起腹泻、休克等情况,影响患者生活质量。随着医疗技术的发展,目前出现的白蛋白结合型紫杉醇是一种以人体白蛋白为载体的化疗药物,其进入人体后因白蛋白载体的作用,吸收更快且利用率更高,同时毒副作用较传统溶剂型紫杉醇更少,已在食管癌、肺癌等肿瘤中开展了相关研究[2],关于其在晚期子宫颈癌放疗患者中的应用相关报道较少,缺乏足量文献加以证实。本研究中采用白蛋白结合型紫杉醇联合顺铂及同步放疗治疗晚期子宫颈癌,取得满意效果,现报道如下。
1 资料与方法
1.1 一般资料
选择揭阳市人民医院2020 年9 月—2022 年9 月收治的100 例晚期子宫颈癌患者作为研究对象,(1)纳入标准:①参考国际妇产科联盟(international federation of gynecology and obstetrics,FIGO)制订的关于子宫颈癌的分期标准[3],分期为Ⅱb~Ⅳ期;②病理检查结果显示分型为鳞癌;③年龄在75 岁以下;④一般情况良好,卡式功能状态评分(Karnofsky performance score,KPS)在70 分以上;⑤为首次确诊肿瘤疾病;⑥确诊时未出现远处转移;⑦预计生存时间在3 个月以上;⑧存在可测量病灶。(2)排除标准:①合并严重肝肾功能障碍;②合并自身免疫性疾病;③合并感染性疾病如乙肝、艾滋病等;④存在精神障碍及过敏史;⑤合并化疗及放疗禁忌证;⑥肿瘤进展速度极快,病情恶化严重。将100 例患者按随机数字表法分为观察组(50 例)和对照组(50 例)。本研究经医院医学伦理委员会批准。所有患者均签署知情同意书。
1.2 方法
两组患者均采用同步放化疗进行治疗,放疗方案:采用盆腔容积调强治疗(VAMT)+三维后装治疗,仪器为美国Varian 公司(Trilogy 及clinac-Ⅸ)医用直线加速器,HM-HDR 型后装治疗机(GammaMedplusTMiX)、模拟定位机。应用6MV-X 盆腔放疗,亚临床病灶靶区包括子宫、子宫颈阴道原发病灶,还包括相应淋巴引流区(腹主动脉旁、髂总、髂内外、骶前、闭孔、腹股沟等淋巴引流区),剂量4 500~5 000 cGy/25 F,5 d/周。PTV 在亚临床病灶靶区外扩6 mm。转移性淋巴结肿瘤大体靶区(gross tumor volume,GTV)-nd 剂量为6 000~7 000 cGy/25~30 F,计划靶区(planning target volume,PTV)-nd 为GTV-nd 外扩5 mm。放疗危及器官(organ at risk,OAR)剂量为:直肠V50≤50 Gy;膀胱V50≤50%;股骨头V50≤5%,小肠V5≤50 Gy,Dmax≤52 Gy,结肠V10≤50 Gy,Dmax≤55 Gy。物理室完成计划后,经物理师医师校位验证无误后方可执行。腔内后装治疗采用192Ir 作为放射源进行腔内近距离照射,放射剂量为600 cGy/次,累计剂量为3 000 cGy,共5 次,于完成外照射后1 周内实施。
对照组患者采用溶剂型紫杉醇(生产厂家:海南海药股份有限公司,批准文号:国药准字H10980170,规格:5 mL∶30 mg)联合顺铂(生产厂家:江苏豪森药业集团有限公司,批准文号:国药准字H20040813,规格:6 mL∶30 mg)进行化疗,化疗开始时间为放疗开始时间,溶剂型紫杉醇剂量60 mg/m2,顺铂剂量30 mg/m2,每周静脉滴注1 次,3 周为1 个疗程,然后停药1 周,连续化疗3 个疗程。
观察组患者采用白蛋白结合型紫杉醇(生产厂家:江苏恒瑞医药股份有限公司,批准文号:国药准字H20183378,规格:100 mg/支)联合顺铂进行化疗,化疗开始时间同对照组,白蛋白结合型紫杉醇剂量135 mg/m2,顺铂用法同对照组,每周静脉滴注1 次,3 周为1 个疗程,然后停药1 周,连续化疗3 个疗程。
1.3 观察指标及评价标准
(1)两组患者治疗结束后,比较临床效果。在开始和结束治疗时,记录患者最大的肿瘤长径和宽径。治疗后第二天,按照实体瘤的评价标准,判断患者的临床效果(如果有多个肿瘤,以最大为准),分为以下四种情况:如果治疗后肿瘤完全消失,评估为完全缓解;如果肿瘤的长径和宽径乘积降低了50%以上,并且没有新的病灶出现,评估为部分缓解;如果肿瘤的长径和宽径乘积变化幅度不超过25%,评估为疾病稳定;如果肿瘤的长径和宽径乘积比原来增加了25%以上,评估为疾病进展[4]。客观缓解率=(完全缓解例数+部分缓解例数)/总例数×100%,疾病控制率=(客观缓解例数+疾病稳定例数)/总例数×100%。(2)使用美国国家癌症研究所常见不良事件评价标准评估两组毒副反应[5],其中,血液指标以治疗期间最低值为准;肝功能和肾功能指标以超出正常范围(最高值)为异常。(3)检测两组治疗前后血液肿瘤标志物水平,在开始治疗前1 d 和结束治疗后第二天早上,患者空腹状态,抽取外周静脉血5 mL,使用美国贝克曼公司生产的低速离心机(离心速率3 000 r/min,离心半径10 cm)离心10 min 后取上清液保存于-80 ℃冰箱待测,使用电化学发光法检测血清糖类抗原125(carbohydrate antigen 125,CA125)及鳞状上皮细胞癌相关抗原(squamous cell carcinoma-associated antigen,SCC-ag)表达水平,试剂盒购自厦门市波生生物技术有限公司,由专人严格按照使用说明书进行操作。(4)比较两组治疗前后生活质量,在治疗前1 d 及治疗完成后次日由专人使用健康调查简表中文版(SF-36)评估患者生活质量[6],该量表包含8 个维度,各维度总分100 分,分数与患者生活质量成正比。
1.4 统计学处理
采用SPSS 19.0 软件处理数据,计数资料以率(%)表示,行χ2检验;计量资料以(±s)表示,组间行独立样本t 检验,组内行配对t 检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 两组一般资料比较
对照组患者年龄49~72 岁,平均(63.85±5.73)岁;疾病分期:Ⅱb 期16 例,Ⅲ期21 例,Ⅳ期13 例;体重指数18.69~27.72 kg/m2,平均(23.52±2.66)kg/m2。观察组患者年龄48~73 岁,平均(63.79±5.96)岁;疾病分期:Ⅱb 期17 例,Ⅲ期22 例,Ⅳ期11 例;体重指数18.64~27.96 kg/m2,平均(23.72±2.62)kg/m2。两组患者一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
2.2 两组治疗效果比较
治疗后观察组客观缓解率及疾病控制率均高于对照组,差异均有统计学意义(P<0.05),见表1。

表1 两组治疗效果比较[例(%)]
2.3 两组毒副反应发生情况比较
观察组腹泻发生率低于对照组,差异有统计学意义(P<0.05),除腹泻外两组其余毒副反应发生情况差异均无统计学意义(P>0.05),见表2。
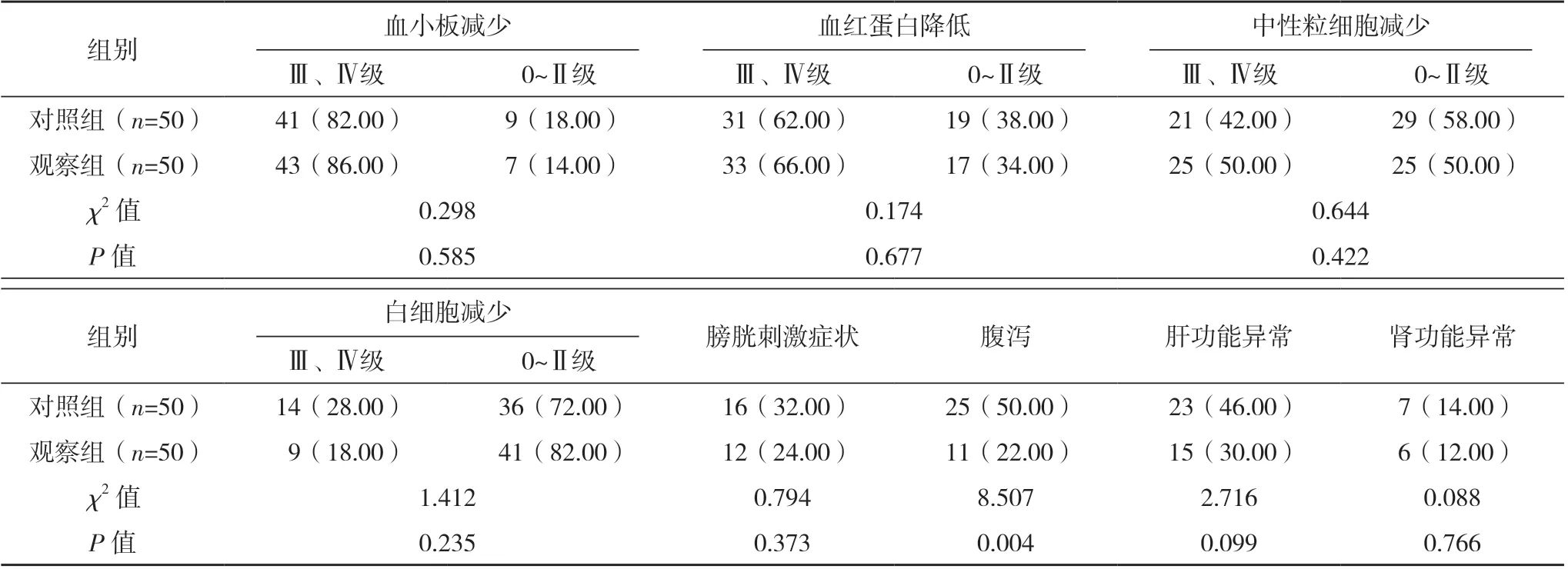
表2 两组毒副反应发生情况比较[例(%)]
2.4 两组血清肿瘤标志物水平比较
两组治疗前血清肿瘤标志物水平比较,差异均无统计学意义(P>0.05);治疗后,两组的CA125及SCC-ag 表达水平均较治疗前降低,且观察组的CA125 及SCC-ag 表达水平均低于对照组,差异均有统计学意义(P<0.05)。见表3。
表3 两组血清肿瘤标志物水平比较(±s)

表3 两组血清肿瘤标志物水平比较(±s)
*与本组治疗前比较,P<0.05。
组别CA125(U/mL)SCC-ag(ng/mL)治疗前治疗后治疗前治疗后对照组(n=50)238.56±22.58 64.55±11.52*2.75±0.521.89±0.33*观察组(n=50)241.52±19.6937.79±9.52*2.77±0.391.58±0.21*t 值0.69912.6620.2185.604 P 值0.487 0.0000.8280.000
2.5 两组生活质量比较
两组治疗前生活质量各维度评分比较,差异均无统计学意义(P>0.05);治疗后,两组的生活质量各维度评分均较治疗前升高,且观察组均高于对照组,差异均有统计学意义(P<0.05)。见表4。
表4 两组生活质量比较[分,(±s)]
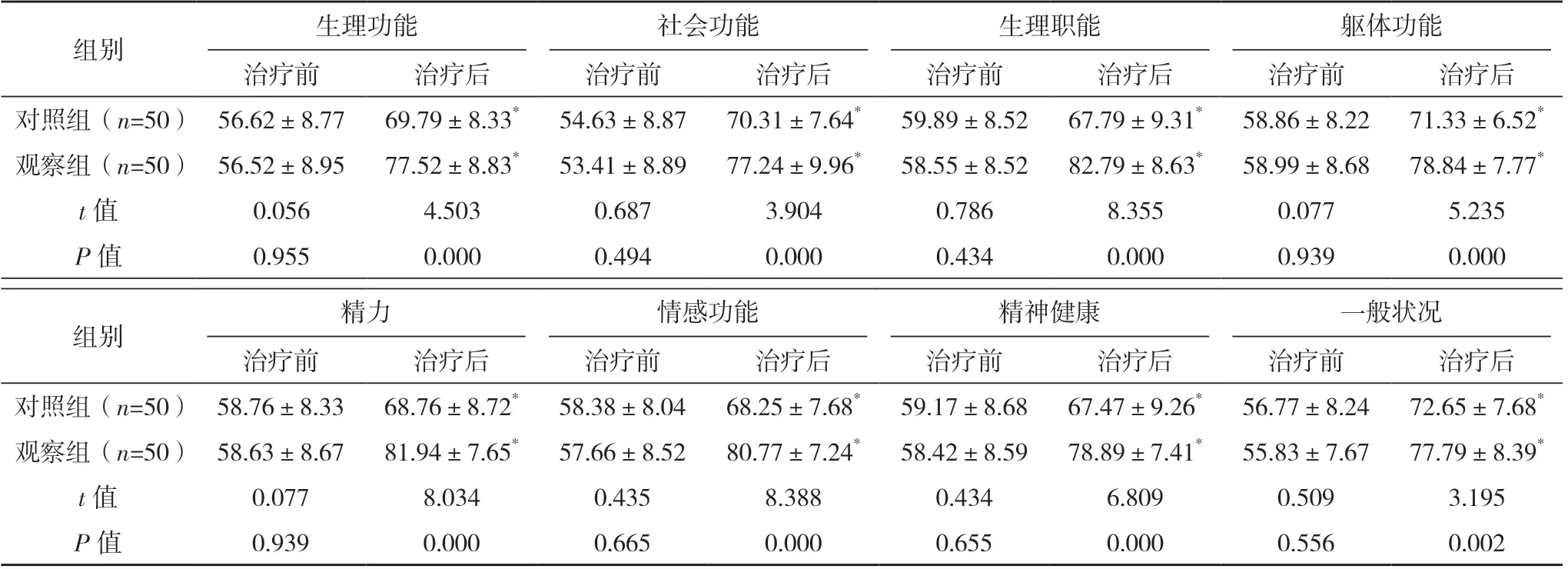
表4 两组生活质量比较[分,(±s)]
*与本组治疗前比较,P<0.05。
组别生理功能社会功能生理职能躯体功能治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后对照组(n=50) 56.62±8.7769.79±8.33*54.63±8.8770.31±7.64*59.89±8.5267.79±9.31*58.86±8.2271.33±6.52*观察组(n=50) 56.52±8.9577.52±8.83*53.41±8.8977.24±9.96*58.55±8.5282.79±8.63*58.99±8.6878.84±7.77*t 值0.0564.5030.6873.9040.7868.3550.0775.235 P 值0.9550.0000.4940.0000.4340.0000.9390.000组别精力情感功能精神健康一般状况治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后对照组(n=50) 58.76±8.3368.76±8.72*58.38±8.0468.25±7.68*59.17±8.6867.47±9.26*56.77±8.2472.65±7.68*观察组(n=50) 58.63±8.6781.94±7.65*57.66±8.5280.77±7.24*58.42±8.5978.89±7.41*55.83±7.6777.79±8.39*t 值0.0778.0340.4358.3880.4346.8090.5093.195 P 值0.9390.0000.6650.0000.6550.0000.5560.002
3 讨论
子宫颈癌发病率居于我国女性恶性肿瘤第2 位,主要发生于40~60 岁,且有逐渐年轻化的趋势[7]。早期子宫颈癌无典型症状,多依靠筛查确诊,由于保健意识水平不高,很多患者在确诊时已经处于晚期,错过了最佳手术时机,预后不乐观。目前临床上晚期子宫颈癌主要使用铂类和紫杉醇类药物进行化疗,目的是减少远处转移和提高疾病控制率[8]。顺铂是一种常用的铂类药物,它属于细胞周期药物,在人体内能与细胞DNA 形成顺铂-DNA,干扰细胞的分裂,达到控制肿瘤进展的目的[9]。紫杉醇提取自紫杉树,其为常见抗癌药物,可使肿瘤细胞微管稳定性增加,进而抑制有丝分裂,达到抗肿瘤效果。有研究表明,紫杉醇还能激活机体中的肿瘤坏死因子-α 基因,提高肿瘤坏死因子-α 表达水平,进而从分子层面发挥不同的抗肿瘤效应[10-11]。
但因紫杉醇水溶性较差,其结构较为复杂,临床上应用时,需要使用特殊溶剂进行溶解,且在用药前需进行预处理,具有较大的毒性,增溶剂在进入人体后可包裹药物,影响药物的吸收,其次增溶剂可引起神经元肿胀及脱髓鞘反应,引起骨髓抑制、腹泻等多种毒副反应[12-13]。随着制药技术的发展,将白蛋白与紫杉醇结合形成白蛋白结合型紫杉醇成功问世,白蛋白结合型紫杉醇在人体中吸收更好,且由于未使用增溶剂,在毒副作用方面较传统紫杉醇更少。颜芳等[14]采用白蛋白结合型紫杉醇治疗食管癌,结果显示观察组疾病控制率更高,且毒副反应发生例数更少。黄万中等[15]研究显示,白蛋白结合型紫杉醇能够进一步调节胃癌患者的肿瘤标志物,在改善患者远期预后方面具有积极意义。本研究结果显示,观察组治疗后疾病控制率及客观缓解率均高于对照组,观察组腹泻发生率低于对照组,治疗后观察组的CA125 及SCC-ag 表达水平均低于对照组,差异均有统计学意义(P<0.05)。说明白蛋白结合型紫杉醇比溶剂型紫杉醇更适合治疗晚期子宫颈癌,效果更好,副作用更少,能够进一步降低肿瘤标志物水平。分析原因如下,白蛋白结合型紫杉醇是用人血清白蛋白作为载体,通过高压均质技术把紫杉醇和白蛋白做成紫杉醇结合白蛋白纳米颗粒;药物进入人体后很快崩解成体积更小的白蛋白-紫杉醇复合物,后者能和血管内皮细胞上的gp60 白蛋白受体结合,和窖蛋白相互作用后通过细胞的胞吞,把药物送到肿瘤细胞间质[16-17]。相关研究证实,机体中的肿瘤细胞能够分泌SPARC 蛋白,其能转运白蛋白-紫杉醇复合物,进而提高肿瘤组织的药物浓度[18]。相关研究证实,在肿瘤新生的血管组织中,其内皮细胞能够分泌高水平的SPARC蛋白,同时gp60 受体呈高水平表达,通过此种机制可减轻药物对正常组织的损伤,且提高药物作用浓度[19-20]。故本研究中观察组治疗效果更好,且肿瘤标志物表达水平更低,同时观察组毒副反应中腹泻比例低于对照组,虽观察组血小板减少、血红蛋白降低、中性粒细胞减少、白细胞减少等比例均低于对照组,但差异均无统计学意义,分析后认为可能与样本量选择过小且为单中心研究有关。本研究结果还显示,观察组治疗后的生活质量各维度评分均高于对照组,差异均有统计学意义(P<0.05),提示白蛋白结合型紫杉醇能够进一步提升晚期子宫颈癌患者的生活质量,与其增效、减毒的作用关系密切。
综上所述,白蛋白结合型紫杉醇联合顺铂同步放疗治疗晚期子宫颈癌较使用传统紫杉醇而言,效果更好,可进一步降低患者肿瘤标志物水平,降低毒副反应中腹泻的比例,同时提高患者生活质量。

