MiR-31促进人牙髓间充质干细胞增殖和迁移
王佳微, 曹利利, 丁雪婷, 田 峰*, 王春芳*
(1)山西医科大学口腔医学院, 太原 030012;2)口腔疾病防治与新材料山西省重点实验室, 太原 030012;3)山西医科大学动物实验中心, 太原 030012)
牙髓炎是由牙髓组织的细菌感染引起的一种炎症性疾病,目前主要的治疗方法是根管治疗,即去除感染的牙髓组织,对根管髓腔进行完备的预备消毒后用生物材料进行严密的充填,目前,我国每年有超过1 400万例根管治疗手术。然而在根管治疗后,牙齿失去了对牙齿硬组织的营养补充、对冷热刺激的敏感反应以及抵御继发感染的能力,因此,发现新的对牙髓炎有效且副作用小的治疗方法十分必要,也是迫切的[1, 2]。在2001年,Iwaya等[3]首次提出了牙髓血运重建的概念,在此基础上将其发展成一种全新的、具有极高治疗效果的牙髓再生技术,其中牙髓间充质干细胞(dental pulp stem cells, DPSCs)作为牙髓再生的一种可行的细胞来源,逐渐进入人们的视野并受到越来越多的关注[4]。Gronthos 等在2000年,首次分离出DPSCs,并且鉴于其易于获取、无伦理问题且增殖能力快等特性而受到了广泛关注[5-7]。DPSCs是牙髓组织再生最重要的干细胞来源,其起源于颅神经嵴谱系,并在牙髓血管的周边,以自我更新,多谱系分化为特征,能分化成软骨细胞、成骨细胞、脂肪细胞及神经外胚层细胞,这一研究结果对人类健康具有重要支撑作用,给我们带来更大可能[8]。更重要的是,它们在异体移植中可能不会引起免疫反应,因其是非免疫原性的,具有很强的免疫抑制特性,可以作为牙髓组织再生的主要干细胞来源[9, 10]。为明确牙髓干细胞在根管移植中的作用机制及方法,已开展大量的研究工作,包括细胞水平的研究和动物研究[11, 12]。尽管DPSCs 为解决牙髓疾病提供了新的手术方法,但是干细胞的移植仍有缺点,例如细胞不能有效汇聚到病变区域,定植在损伤区的细胞存活时间短和存活率低,使细胞治疗的效果大打折扣[13]。
微RNA(microRNAs, miRNAs)为21~24个核苷酸的内源性小RNA,它们既能调控生物体生理机制,也能促进细胞生长发育,因而在生物学、病理学领域中扮演了重要的角色[14]。近年的研究表明,miRNAs不仅参与调控干细胞相关调节因子,还与干细胞增殖、迁移、分化等多种功能的运转有着密切的联系[15, 16]。微核糖核酸31(microRNA-31, miR-31)属于miRNAs家族的一种高度保守的miRNAs,近年的研究表明,miR-31可以调控细胞的功能对细胞表型产生潜在影响,例如,miR-31通过直接靶向RAS p21蛋白激活因子1(RAS P21 protein activator 1, RASA1)、SProuty 相关EVH1 域含蛋白 1(SProuty-related EVH1 domain-containing protein 1, Spred1)、SProuty 相关EVH1 域含蛋白 2(SProuty-related EVH1 domain-containing protein 2,Spred2)和RTK 通路特异性抑制因子(sprouty4, Spry4)来激活Ras 蛋白(rat sarcoma, Ras)/丝裂原活化蛋白激酶 (mitogen-activated protein kinase, MAPK)信号传导, 促进表皮角质形成细胞的增殖和迁移,从而促进皮肤伤口的愈合[17]。MiR-31还是人精原干细胞的主要生物学调节剂,经P21活化激酶1(p21-activated kinase 1, Pak1)-锌指并列基因 1 (juxtaposed with another zinc finger gene 1, JAZF1)-细胞周期蛋白A2(cyclinA2, CCNA2)途径增殖人精原干细胞、调节DNA合成与凋亡[18]。MiR-31在癌症治疗中也发挥着重要作用,它能够抑制癌细胞的生长、扩散和侵袭,而且对化疗有敏感性[19]。因此,可将miR-31机制归纳为靶向关键信号通路,调节相应细胞的增殖和迁移,最终有利于损伤组织的修复。以上研究揭示了,miR-31对细胞功能的影响。同时,Michon等[20]在研究miRNA芯片技术时发现,miR-31在牙胚形成阶段具有重要作用。然而,miR-31在DPSCs生物学过程中是否也具有相同作用,目前仍未见到相关的研究,因此,本文研究了miR-31对细胞增殖和迁移的影响,希望为DPSCs更好的应用于牙髓再生提供一定的理论基础。
1 材料与方法
1.1 主要试剂与仪器
流式细胞仪(安捷伦ACEC, 美国);DMEM高糖培养基(Gibco, 美国);胎牛血清(Biological Industries,比利时);CD90,CD75,CD34(博士德,中国);酶标仪(Thermo scientific, 美国);高灵敏度化学发光成像系统(Bio-Rad,美国);实时荧光定量PCR仪(Thermo Fisher Scientific, 美国);Hoechst(Sigma, 美国);增强型RIPA裂解液,蛋白酶抑制剂PMSF,BCA试剂盒(博士德,中国);脱脂奶粉(Cell signaling Technology);Ki67,PCNA ,MMP-2 ,CXCR4,GAPDH抗体(博士德,中国);INTERFERin®转染试剂(Polyplus, 法国);miR-31agomir和antagomir(锐博生物科技,中国);4%多聚甲醛,CCK-8,0.1%结晶紫(索莱宝,中国);RNA 裂解液,Mir-X First-Strand Synthesis Kit,TB Green Premix Ex Taq II试剂盒,Revert Aid First Strand cDNA Synthesis Kit(Takara, 日本)。
1.2 伦理问题
本实验所需要的牙收集于山西医科大学口腔医院,并与患者签署了相关知情同意书,且已通过山西医科大学口腔医院伦理委员会的严格审查(2022SJL32)。
1.3 牙髓间充质干细胞的提取和培养
健康牙取自18~22岁患者完整的第三磨牙或者因正畸而需要拔除的牙齿,炎症牙取自因牙髓炎而需要拔除的牙齿。用锤子劈开取新鲜牙髓,将组织剪碎并加入浓度为3 mg/mL I型胶原酶消化,消化45 min。把组织块置于T25培养瓶内,各组织块之间大致相距0.5~1 cm,加入1~2 mL完全培养基。待细胞融合率到达80%后使用细胞计数板将消化下来的细胞根据1~2个每孔的密度接种到96孔板中,镜下选择长势好、克隆形成能力较强的细胞,用于孔板标记,当细胞汇合到80%时,稳定传代。
1.4 鉴定牙髓间充质干细胞表面标志物,并绘制细胞生长曲线
取P3代细胞,消化离心后弃上清,调节密度至1×106个/mL;将其分别标记为对照组、分化簇90(cluster of differentiation 90,CD90)、分化簇73(cluster of differentiation 73,CD73)、分化簇34(cluster of differentiation 34,CD34)和分化簇45(cluster of differentiation 45,CD45),向各管加入100 μL细胞悬液,2.5 μL PBS和抗体;4 ℃避免光照30 min,离心弃上清,1 mL PBS滤膜滤除细胞团,用流式细胞仪进行检测。生长曲线:P3代细胞消化后调整密度到5×104/mL,接种于12孔板。置于细胞培养箱中,从第1 d到第10 d,每日取3孔消化,离心,重悬和测定,最后取其平均值,将测量时间作为横坐标轴,细胞的数目为纵坐标轴。
1.5 RT-qPCR 检测组织和转染后miR-31水平的表达
每个孔加1 mL Trizol充分裂解,静置 5 min后每管加入200 μL氯仿,13 000 r/min离心 15 min;随后加入500 μL异丙醇,离心后将上层水相转移到该新的 EP管中;酒精沉淀10 min,离心去除上清液;75% 乙醇洗涤 RNA 沉淀,离心后去上清并风干RNA 沉淀 5~10 min;将RNA溶解在30 μL DEPC水中后按体系加样并反转录为cDNA;使用TBGreen试剂盒在实时PCR系统上进行定量分析,其中以U6作为内参(引物序列见Table 1)。

Table 1 Primer sequence
1.6 细胞转染和分组
将细胞以1×105细胞/孔的数量接种于6孔板;用200 μL/孔的无血清DMEM稀释5 μL /孔的miR-31 agomir、miR-31 antagomir和NC于EP管中混匀,后将4 μL 的INTERFERin®转染试剂加入3个EP管中并静置10 min;最后将129 μL/孔转染复合物加入到六孔板的细胞中,放入培养箱4~6 h后更换培养基。
1.7 CCK-8检测miR-31对牙髓间充质干细胞增殖的影响
将转染后的细胞分别接种于96孔板上,并分别在24 h、48 h、72 h和96 h时弃旧培养基,加入100 μL10% CCK-8溶液和90% DMEM培养基的混匀液,培养2 h后通过酶标仪测定长度为450 nm的吸光度值。
1.8 Transwell检测miR-31对牙髓间充质干细胞垂直方向迁移的影响
转染后消化计数;把Transwell培养小室放入24孔板中,分3组,各组复孔3个,小室下层加入600 μL含有20%胎牛血清的培养液,小室内添加200 μL单细胞悬液,其中含有3×104个细胞,培养24 h;取出小室,甲醛15 min固定,用0.1%结晶紫染料20 min,PBS进行两次洗涤后拍照。
1.9 划痕实验检测miR-31对牙髓间充质干细胞水平方向迁移的影响
用标记笔在6孔板后面约每0.5~1 cm画一道线,在每个孔内种5×105个转染后的细胞;用PBS洗细胞3次,添加无血清培养基;置于培养箱中培养,按照0 h与24 h的时间拍摄照片,并利用Image J进行影像分析。
1.10 Western 印迹检测增殖蛋白质和迁移蛋白质的表达
取适量裂解液并添加蛋白酶抑制剂,将裂解液加入转染后的DPSCs,使细胞充分裂解后将裂解液移入离心管,10 000 g离心10 min,取上清,BCA法测蛋白质浓度。SDS-PAGE凝胶电泳后,将蛋白质转移至PVDF膜上,用TBST 洗膜后5%BSA封闭1.5 h,一抗孵育过夜(Ki67抗体稀释比例1∶1 500;PCNA抗体稀释比例1∶3 000 ;CXCR4抗体稀释比例1∶2 000;MMP2抗体稀释比例1∶1 000;内参GAPDH抗体稀释比例1∶1 500)。孵育结束后TBST洗膜,之后孵育二抗2 h(HRP标记的山羊抗兔IgG,稀释比例1∶5 000),孵育结束TBST洗膜,ECL显影,并用Image J软件对条带进行分析。
1.11 统计学分析
每组实验重复3次,实验数据采用IBM SPSS Statistics 26软件统计分析,并使用 GraphPad Prism 5.0软件绘制柱状图。多组间比较运用单因素方差分析(one-way ANOVA),以P<0. 05表示差异具有统计学意义。
2 结果
2.1 牙髓间充质干细胞的体外分离培养
通过组织块酶消化法从牙髓组织中提取DPSCs(提取过程大致如Fig.1A所示)。在第10~11 d,通过倒置显微镜观察发现, 少量原代细胞从组织块边缘爬出,随后,细胞以辐射状向周围游离,贴壁生长,形态呈长梭形,即纤维细胞样 (Fig.2A)。经过传代培养后DPSCs 在体外大量扩增,传代培养后细胞为长梭形 (Fig.2B-C)。

Fig.1 Experimental flow diagram (A) DPSC extraction diagram: we first split the isolated tooth to extract the pulp, then wait for the cells to crawl out from the edge of the tissue block following enzyme digestion, and purify by the limited dilution method after reaching a certain fusion rate. (B) CCK8 experiment diagram: A mixture of 10% CCK-8 solution and 90% DMEM medium was prepared, and the absorbance value of 450 nm was measured using an enzyme-labeled instrument after 2 hours of culture. (C) Cell transfection diagram: A mixture of miR-31 agomir/antagomir and transfection reagents was applied to pre-planted cells, and the cells were left for 24 hours before further studies. (D) Transwell diagram: the transfected cells were implanted into the upper chamber of the Transwell chamber, fixed with paraformaldehyde 24 hours later, and the cells passing through the polycarbonate membrane were stained with crystal violet, observed, and counted under an inverted phase contrast microscope

Fig.2 Isolation and culture of DPSCs in vitro (A) The image showed cells climbing out of the optical microscope from the tissue block edge (×100). Scale bar = 250 μm. (B) The second generation of DPSCs (×40). Scale bar = 500 μm. (C) The second generation of DPSCs (×100), cell morphology of the spindle was shown. Scale bar = 250 μm
2.2 体外培养的牙髓间充质干细胞的鉴定
取第3代细胞采用流式细胞术检测其表面特异性标志物,得到的结果表明,其高表达间充质干细胞的表面标志物CD90(99.2%)和CD73(99.0%),而造血干细胞表面标记CD34(0.09%)和CD44(0.19%)均未表达(Fig.3A)。此外,DPSCs免疫荧光鉴定结果显示,间充质干细胞的表面标志物STRO-1阳性表达97.8%(Fig.3B-C)。以上结果均表明,已成功提取培养DPSCs。为了进一步了解其生长状况,本文绘制了其生长曲线,呈典型“S”形,在接种后1~2 d内,细胞生长缓慢,处于停滞期,从第2 d开始,增长速率变得异常迅速,增长曲线急剧向上,进入对数增殖期,第8 d,细胞总量达到了相当大的水平,随时间的延长增长曲线又出现了平线(Fig.3D)。这表明,所培养DPSCs具有良好的生长状态,并取对数期细胞进行实验。
2.3 炎症牙来源的牙髓组织和 牙髓间充质干细胞中miR-31的表达水平较正常组显著下降
通过RT-qPCR检测发现,炎症牙来源的牙髓组织和DPSCs中miR-31的表达大约为健康牙的1/2,结论具有显著的统计学意义(P<0.05,Fig.4),这提示炎症环境下miR-31的表达降低,可能对牙周组织功能有不利影响。

Fig.4 Expression levels of miR-31 in dental pulp tissues and DPSCs from inflammatory and normal teeth (A) Samples of normal extracted teeth and teeth with pulpitis were collected from the clinic. (B) The relative expression level of miR-31 in the pulp tissue and DPSCs of normal and inflammatory teeth was detected by RT-qPCR (Mean ± SD, n=3 ). #P<0.05: pulpitis tissue compared with the control group;*P<0.05: inflammatory DPSCs compared with the control group
2.4 miR-31转染牙髓间充质干细胞
为进一步观察miR-31对细胞的影响,本文定制了高亲和力胆固醇修饰miR-31agomir和miR-31antagomir,且在Cy3荧光标记下表现出了良好的稳定性。用其转染细胞后(转染过程正如Fig.1C),直接在荧光显微镜下观察到其发出红色荧光,进一步统计发现,miR-31 agomir组和miR-31 antagomir组转染效率均大于90%(Fig.5A-B)。为进一步探讨miR-31 agomir和miR-31 antagomir是否作用于细胞,本文通过RT-qPCR加以证实。结果显示:细胞转染后,miR-31agomir组miR-31的表达是对照组的20倍(P<0.001),而miR-31antagomir组miR-31的表达是对照组的0.2倍(Fig.5C),进一步说明转染成功。

Fig.5 MiR-31 was successfully transfected into DPSCs Immunofluorescence and PCR were used to confirm the transfection of miR-31 into DPSCs further. (A) The status of miR-31agomir and miR-31antagomir transfection was evaluated by immunofluorescence, with red fluorescence indicating successful transfection. Scale bar = 250 μm. (B) Statistics of the results of miR-31agomir and miR-31 antagomir transfection efficiency. (C) The relative expression level of miR-31 in the control group, miR-31 agomir group, and miR-31 antagomir group after transfection was detected by RT-qPCR (Mean ± SD, n = 3). ***P<0.001
2.5 miR-31促进牙髓间充质干细胞的增殖
为探讨miR-31在DPSCs增殖过程中的作用,本文在转染后,进行了CCK-8的检测(CCK-8过程,大致如Fig.1B)。结果表明,与对照组相比,两组的增殖能力在24 h时已出现差异,且在72 h时miR-31agomir组的DPSCs增殖能力相较于其他时间段显著优于NC组(P<0.01)。除此之外,miR-31antagomir组对DPSCs增殖的抑制作用也显著优于其他时间段(P<0.001),表明miR-31能够有效促进细胞增殖(Fig.6) 。
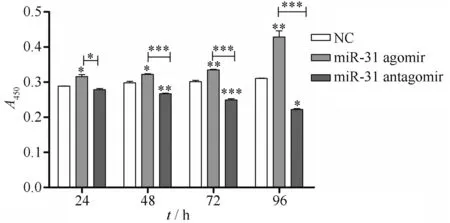
Fig.6 MiR-31 promoted the proliferation of DPSCs in different time periods After transfecting DPSCs with miR-31, the effect of miR-31 on cell proliferation was detected with the CCK-8 experiment. The absorbance values of the control group, miR-31 agomir group, and miR-31 antagomir group at 450 nm were compared at 24, 48, 72, and 96 hours, respectively (Mean ± SD, n=3 ).*P< 0.05,**P<0.01,***P< 0.001
2.6 miR-31促进牙髓间充质干细胞的迁移
通过CCK8检测发现,miR-31具有促进DPSCs增殖的功能。那么其迁移是否受到影响呢?本文进行了划痕和Transwell实验,以分别探讨转染后miR-31在细胞水平迁移和垂直迁移中的作用。划痕实验结果表明,在24 h时miR-31agomir组的无细胞区域显著小于NC组,(P<0.05),但miR-31antagomir组和NC组细胞的无细胞区域差异无统计学意义(P>0.05,Fig.7A-B),表明过表达miR-31对细胞水平方向的迁移能力有明显的促进作用。为进一步探索和研究miR-31在细胞垂直迁移中的作用,本文进行了Transwell实验,将转染后的细胞接种到上室,培养24 h后统计迁移至下室的细胞数量(Transwell实验过程大致如Fig.1D),结果表明,miR-31agomir组穿过Transwell小室的数目显著高于NC组(P<0.001),miR-31antagomir组穿过Transwell小室的数目显著性低于NC组,差异具有统计学意义(P<0.01,Fig.7C-D)。以上结果表明,过表达miR-31能明显增强细胞水平和垂直方向迁移能力。

Fig.7 MiR-31 promotes the vertical and horizontal migration of DPSCs After transfecting DPSCs with miR-31, the effects of miR-31 on horizontal and vertical migration of DPSCS were detected by wound-healing assay and Transwell assay. (A, B) The cell-free regions of the control group, miR-31agomir group, and miR-31antagomir group were compared at 0 and 24 hours (Mean ± SD, n=3). Scale bar =250 μm. (C, D) The number of cells migrating to the lower chamber of the control group, miR-31 agomir group, and miR-31 antagomir group was calculated at 24 hours (Mean ± SD, n=3). Scale bar =125 μm.*P< 0.05,**P< 0.01,***P<0.001
2.7 miR-31上调增殖蛋白质和迁移蛋白质的表达水平
为了深入研究miR-31是否影响DPSCs增殖、迁移相关蛋白质的表达,本文检测了其关键蛋白质水平。Western印迹检测结果显示,与对照组相比,miR-31agomir组Ki67和PCNA的蛋白质水平显著升高(P<0.01),而miR-31antagomir组Ki67和PCNA的蛋白质水平显著降低(P<0.01,Fig.8A-C)。此外,miR-31agomir组CXCR4和MMP2蛋白质水平较对照组显著升高(P<0.05),miR-31antagomir组CXCR4和MMP2的蛋白质水平显著降低(P<0.05,Fig.8A,D-E)。结果表明,miR-31不仅在表型上促进了DPSCs的增殖迁移,在分子层面上其也有效促进了细胞增殖和迁移相关的蛋白质水平。

Fig.8 MiR-31 up-regulates the expression levels of key proliferation proteins Ki67, PCNA, and key migration proteins MMP-2 and CXCR4 (A) The Western blot method was used to determine the relative level of Ki67, PCNA, CXCR4, and MMP-2 in each group. (B-E) Semi-quantitative analysis of relevant protein levels in A, quantified and standardized to GAPDH (Mean ± SD, n= 3) .*P<0.05,**P<0.01,***P<0.001
3 讨论
牙髓炎是目前临床上的常见病,主要是由牙髓感染引起的牙髓组织发炎。根据北京大学口腔医院2020年调查分析表明,在众多病因中,因牙髓炎而急诊收治的病人占比最大[21]。牙髓炎传统的治疗手段为根管治疗,其成功率在85%~90%左右,但是由于牙髓组织的缺失,牙齿残余组织更加脆弱,并且妨碍未成熟恒牙牙根发育。因此,保持牙髓活力是必要的。
近年来,组织工程及再生医学的发展显著促进了再生牙髓学研究,即寻求用再生的髓样组织代替炎症或坏死的牙髓组织[22, 23]。值得一提的是,20年前有学者从人的牙髓中分离出一种克隆性、高增殖干细胞群,即DPSCs,可使牙本质或者髓样组织再生[5],还能有效再生骨、血管及新形成功能性牙髓[24-26]。于是,人们提出了基于牙源性间充质干细胞的牙髓再生技术来保持牙齿活力。但是,使用干细胞移植也存在着缺点,细胞不能高效募集损伤区域,导致受损区的活细胞数量下降,存活时间短,不足以完全发挥细胞的作用。近期研究发现,部分miRNAs能够对DPSCs进行功能调整,从而改变细胞的生长发育。例如,Tian等人的研究表明,miR-584在蛋白激酶B (protein kinase b, AKT)信号通路中可能对具有PDZ结合模序的转录共激活因子(transcriptional co-activator with PDZ-binding motif ,TAZ)的表达发挥调控作用,从而成为DPSCs增殖的关键调节因子[27]。此外,2019年研究确认,下调miR-224-5p有利于DPSCs的增殖与迁移;当miR-224-5p上调时,发现了与之相反的现象[28]。2022年,Wei等证实,miR-153-3p经由核结合因子亚基β (core-binding factors-beta,CBFβ)信号通路对人类DPSCs的成骨分化具有抑制作用,该研究为骨缺损的治疗和骨再生的促进提供了新的策略[29]。但迄今为止,尚未有确切的证据表明miR-31对DPSCs增殖和迁移的影响。
首先我们采用 RT-qPCR 技术,分别对炎症牙,健康牙的牙髓组织和 DPSCs 中 miR-31 的表达水平进行了测试,结果表明与对照组相比,炎症牙的牙髓组织和DPSCs中miR-31的表现水准明显降低,且差异具有统计学意义(P<0.05),miR-31在健康牙的DPSCs中有较高表达,结果和文献报道相符[20]。在此基础上,我们设计用miR-31成功转染 DPSCs,然后用了一系列细胞功能性实验表明miR-31能促进DPSCs的增殖和迁移。
为了深入了解miR-31对DPSCs增殖影响的潜在机制,本文测量了DPSCs 中 Ki67、PCNA 的蛋白质水平。Gerdes等人在1983年最初使用小鼠单克隆抗体,用霍奇金淋巴瘤细胞系的细胞核免疫小鼠,确定了Ki67抗原的存在并进行了研究,结果发现,其不存在于静止细胞内,而是广泛地表达于增殖细胞(正常细胞和肿瘤细胞)[30, 31]。PCNA作为细胞周期标记物已被人们所熟知,正常增殖细胞和转化细胞及肿瘤中均检出了不同量的该蛋白质,它的浓度随细胞周期而起伏变化,S期显著增加[32]。所以,本文在转染后对Ki67和PCNA的蛋白质水平进行了测量,结果表明,过表达miR-31可上调Ki67、PCNA蛋白质水平,从而有利于DPSCs增殖。接着,本文对miR-31作用于DPSCs迁移生物学机制进行探讨,本文检测了DPSCs中CXCR4、MMP2的蛋白质水平。基质细胞衍生因子-1α(stromal cell-derived factor-1α,SDF-1α)作为小分子趋化因子,提高了细胞的迁移能力,CXCR4作为SDF-1α特异性受体已被人们熟知。SDF1α/CXCR4轴在促进干细胞的募集以及干细胞的生长和迁移过程中发挥重要作用[33-35]。CXCR4在干细胞中表达减少,增殖及迁移能力随之下降[36]。基质金属蛋白酶(matrix metalloproteinases,MMPs)是一组20种以上的蛋白酶,为锌依赖性内肽酶,起初是以蛋白酶的形式发现,其对细胞外蛋白质具有靶向和切割作用,可以有效地改变细胞的功能[37],其中,MMP-2是基质金属蛋白酶家族中参与细胞迁移的重要蛋白质[38]。研究结果表明,过表达miR-31能上调CXCR4、MMP2蛋白质水平从而有利于DPSCs迁移。
总之,本文的数据表明,miR-31在炎症牙中下调,且miR-31过表达有利于DPSCs增殖和迁移,为干细胞在损伤部位聚集从而利于牙髓组织再生提供良好的理论基础,且miR-31作为一种重要的分子标记物,有望成为牙髓炎预后和治疗的一种新的有前途的候选分子。但是该研究目前仍存在许多不足,首先实验多以细胞为主,有关临床组织方面的研究较少,本文的研究结论在临床数据上仍缺乏支持;其次,本研究只探讨了基于miR-31在DPSCs中的生物学作用,需要进一步进行关于其调控细胞增殖和迁移的内在机制研究;最后,DPSCs是多谱系分化的细胞,关于miR-31是否能影响干细胞向成牙髓方向分化将是未来研究的难点和热点。

