桔梗汤促进肺脏Th1细胞募集及拮抗肿瘤肺脏转移的作用机制研究
孔令婉,王悦,张玥,张珊,杨雯越,姚成芳,,✉
(1. 山东中医药大学中医学院,山东 济南 250355; 2. 山东中医药大学中医药创新研究院,山东 济南 250355; 3. 山东第一医科大学,山东省医学科学院,山东 济南 250117)
肺脏肿瘤的高发病率和高病死率严重威胁人类健康。肺脏对淋巴细胞具有较高的依赖性,无论是NK细胞等主导的天然免疫还是T细胞等主导的获得性免疫,都对维持肺脏免疫微环境的稳定发挥着重要作用。在获得性免疫中,T细胞是维持肺脏局部免疫反应特异性和持久性的主体免疫细胞,特别是Ⅰ型辅助性T 细胞(type 1 T helper cell,Th1),通过大量分泌γ 干扰素(interferon gamma,IFN-γ)、颗粒酶B(granzyme B,GZMB)等细胞因子发挥抗病毒、抗肿瘤效应[1-3];同时,Th1还可通过这些细胞因子促进NK、巨噬细胞、树突状细胞等天然免疫细胞的活化,增强天然免疫效应。因此,促进肺脏局部淋巴细胞,特别是Th1细胞的局部募集可成为增强肺脏免疫、防治肿瘤发生和发展的重要策略。
桔梗汤(platycodon decoction,PD)是肺系疾病常用方剂,首载于《伤寒杂病论》,由桔梗、甘草组成,具有清热解毒、利咽止痛、祛痰排脓等功用。现代药理研究表明,桔梗汤抗炎作用显著,可阻断NF-κB和ERK等信号活化,降低IL-17A、TNF-α等炎性因子的表达,抑制COPD进程或缓解急性肺损伤[4-5];另有研究证实,桔梗汤可通过调控Th1/Th2细胞平衡,在肝癌、胃癌、肺癌等多种恶性肿瘤中发挥抗肿瘤效应[6],但桔梗汤是否可以调控生理状态下或肺脏肿瘤微环境中Th1在肺脏的分布或募集尚未见报道。本研究利用流式细胞术和单细胞测序等技术,探讨桔梗汤在生理状态下和肺脏肿瘤微环境中,优势调控Th1细胞在肺脏募集特征及作用机制,为桔梗汤特效治疗肺系疾病的临床应用提供科学依据。
1 实验材料
1.1 实验动物
SPF 级C57BL/6 雌性小鼠42 只(济南朋悦实验动物繁育中心),6~7周龄,体质量18~22 g,动物许可证号:SCXK(鲁)20190003,饲养于山东第一医科大学动物实验中心,室温22~26 ℃,相对湿度56%~60%,光照时长12 h,黑暗时长12 h。小鼠适应性饲养1 周,期间自由摄食、饮水。
1.2 实验药物与试剂
桔梗、甘草(山东省建联中药股份有限公司);佛波酯、DisPase 酶Ⅱ、离子霉素、蛋白转录抑制剂(德国Sigma 公司,货号:6561-29-8、BCBX6041、871911、569029);Oligo-dT、TRIzol、M-MLV(美国 Thermo 公司,货号:406710、279509、00657100);胶原酶D(瑞士Roche 公司,货号: 11088858001);胎牛血清(美国Gemini 公司,货号:A24G00J);脱氧核糖核苷、RNA 酶抑制剂(北京康为世纪有限公司,货号:315A0113、3290-2500); SYBR®Green master(美国Bio-Rad 公司,货 号:17282);破膜 液、Fc-Blocking、CD45-Percp-Cy5.5、CD45-APC-Cy7、CD4-PE、CD3-PE-Cy7、NK1.1-BV510、CXCR3-PE、CD4-BV510、NK1.1-Percp-Cy5.5、IFN-γ-PE-Cy7(美国BD公司,货号:554714、176542、550994、557659、2293891、560591、563096、562152、100449、551114、557649);RT-qPCR引物(上海铂尚生物技术有限公司)。
1.3 实验仪器
超净工作台(型号:SW-CJ-1F,苏州安泰空气技术公司);CO2培养箱(型号:STERI-Cyclei160,美国Thermo 公司);液体真空浓缩煎药机(型号:YZN50,北京东华原医疗设备有限责任公司);高速离心机(型号:ST16R,美国Thermo 公司);细胞计数仪(型号:Countess Ⅱ,美国Thermo 公司);荧光定量PCR 仪(型号:LightCycler96,罗氏诊断产品有限公司);PCR 扩增仪(型号:JCS0118,德国Biometra 公司);酶标仪(型号:Synergy HTX,美国伯腾仪器有限公司);全自动组织处理器(型号:Gentle MACS,美天旎生物技术有限公司);震荡仪(型号:88880018,美国Thermo 公司);流式细胞仪(型号:FACS Aria Ⅲ,美国BD公司)。
2 实验方法
2.1 桔梗汤的制备
依据《伤寒杂病论》中的记载,桔梗和甘草的比例为1∶2,因此称取桔梗250 g,甘草500 g,加入10倍水量浸泡过夜,煮沸后文火煎煮30 min,收集提取液,再次加8 倍水煎煮,合并两次提取液并进行浓缩、醇沉处理,共得上清5 200 mL,负压回收乙醇后得药液240 mL,生药浓度为3.12 g/mL。4 ℃冰箱保存。HPLC 分析可知,主要药效成分含量分别为桔梗皂苷D 3 730 μg/mL,甘草苷4 320.75 μg/mL,甘草酸7 801.38 μg/mL。
2.2 动物模型构建及给药方式
2.2.1 正常小鼠灌胃处理
24 只C57BL/6 雌性小鼠适应性喂养 1 周,依据随机数字表法分为正常对照组(CTRL 组)和PD 用药组(PD 组),每组12 只,分别用于流式分析(6 只)和RT-qPCR 检测(6 只)。按照成人每日服用PD 生药22.5 g为标准,根据不同动物等效剂量折算系数法,计算每只 小 鼠灌胃剂量 为2.925 g(/kg·d),每天灌 胃1次,连续灌胃10 d,实验前12 h禁食,自由饮水。
2.2.2 B16黑色素瘤肺转移模型构建及给药方式
18 只C57BL/6 雌性小鼠适应性喂养1 周,依据随机数字表法分为正常对照组(CTRL 组)、B16 黑色素瘤肺转移模型组(B16 组)和PD 治疗组(B16 + PD 组),每组6 只,用于流式分析及分选。除正常对照组外,B16黑色素瘤肺转移模型组和PD 治疗组小鼠尾静脉注射B16 黑色素瘤细胞(注射浓度为2 × 105个/mL,注射剂量为200 μL/只),其中,PD 治疗组小鼠自注射B16 黑色素瘤细胞前3 d 开始灌胃PD,连续灌胃17 d 至实验结束。动物处理前12 h禁食,自由饮水。
2.3 流式细胞术检测肺脏Th 细胞及其CXCR3,IFN-γ的表达
取小鼠肺脏,制备单细胞悬液,按照每孔2 × 106个细胞接种24孔板,加入佛波酯、离子酶素、蛋白转运抑制剂,置5% CO2培养箱孵育5 h。孵育完成后,经200目无菌过滤网将细胞过滤至无菌EP 管中,PBS 缓冲液洗涤两遍,离心弃上清后加入Fc-Blocking,以阻断非特异性结合。再次洗涤后加入外标抗体(CD45、CD3、CD4、NK1.1、CXCR3等),放于4 ℃冰箱,避光孵育1 h。PBS 缓冲液再次洗涤后加入穿膜固定液,避光孵育40 min,1 × perm wash洗涤后,加入内标抗体(IFN-γ),放于4 ℃冰箱,避光孵育1 h,洗涤过滤后上机检测。
2.4 RT-qPCR 检测肺组织CXCL9,CCL5,IFN-γ,GZMB mRNA水平
取小鼠肺脏,匀浆后加入TRIzol 试剂,室温放置5 min,提取RNA,检测其浓度和纯度。将RNA 反转录合成cDNA,进行实时荧光定量PCR。选用30 μL 的反转录体系,18 μL RNA mix(2 μg RNA + 1 μL OligodT + DEPC 水),70 ℃,5 min;再加入12 μL RT mix(6 μL 5 × RT buffer + 3 μL dNTP + 1.5 μL RNase Inhibitor + 1.5 μL RevertAid Reverse TranscriPtase),42 ℃,1 h。反转录完成后,选用20 μL 的qPCR 反应体系(1 μL cDNA + 7 μL DEPC水 + 各1 μL上、下游引物 +10 μL SYBR®Green master ),94 ℃,10 min;95 ℃,10 s;60 ℃,40 s;72 ℃,5 min; 40 个循环。以GAPDH为内参,使用2-ΔΔCT方法计算基因相对表达量。引物序列见表1。

表1 RT-qPCR引物序列
2.5 单细胞测序分析
取小鼠肺脏,制备单细胞悬液,经流式分选后收集目的细胞并检测其活性,通过微流控技术收集包裹Cell Barcode 的 bead 和细胞的液滴,裂解液滴中的细胞暴露出mRNA,使细胞标记Cell Barcode,形成 Single Cell GEMs,反转录出cDNA 的一条链,洗脱序列后,以此为模板通过PCR 合成第二条链,并继续扩增。获取原始数据后使用FastQC 软件进行质量评估,使用Cell Ranger软件进行质量统计,通过Seurat软件包,Single R数据包筛除质量较低的细胞数据,依据基因表达量对主要数据进行分析,鉴定Marker 基因,细胞类型等,结果使用Loupe Brower进行目的细胞特征基因分析。
2.6 统计学方法
使用GraPhPad Prism 8 软件统计数据,数据以均数 ± 标准差的形式表示,采用One Way-ANOVA 分析多组间数据、t检验分析两组间数据。P< 0.05 为差异具有统计学意义。
3 结果
3.1 生理状态下Th1细胞在肺脏的募集情况
3.1.1 生理状态下Th细胞在肺脏的募集情况比较
流式细胞术分析结果显示,与CTRL 组相比,小鼠经PD 灌胃处理后,肺脏CD45+细胞比例和数量均明显升高(P< 0.001)。进一步分析发现,NK细胞比例没有显著变化,NKT细胞比例呈下降趋势,但T细胞比例和数量上升(P< 0.001),其中,Th细胞比例和数量升高更为显著(P< 0.001),而CD8+Tc细胞比例相对下降,说明PD可优势促进Th细胞在肺脏的募集。见表2、图1。
表2 各组小鼠肺脏淋巴细胞比例及数量比较(±s)

表2 各组小鼠肺脏淋巴细胞比例及数量比较(±s)
注:与CTRL组比较,***P < 0.001。
组别CTRL组PD组Th cells/107 7.95 ± 0.47 12.81 ± 0.84***n6 6 CD45P cells/%55.90 ± 0.01 64.33 ± 2.10***CD45P cells/107 51.69 ± 1.66 69.53 ± 2.29***T cells/%22.60 ± 0.91 27.20 ± 1.29***T cells/107 20.85 ± 0.92 29.25 ± 1.33***Th cells/%38.00 ± 1.01 43.67 ± 1.28***
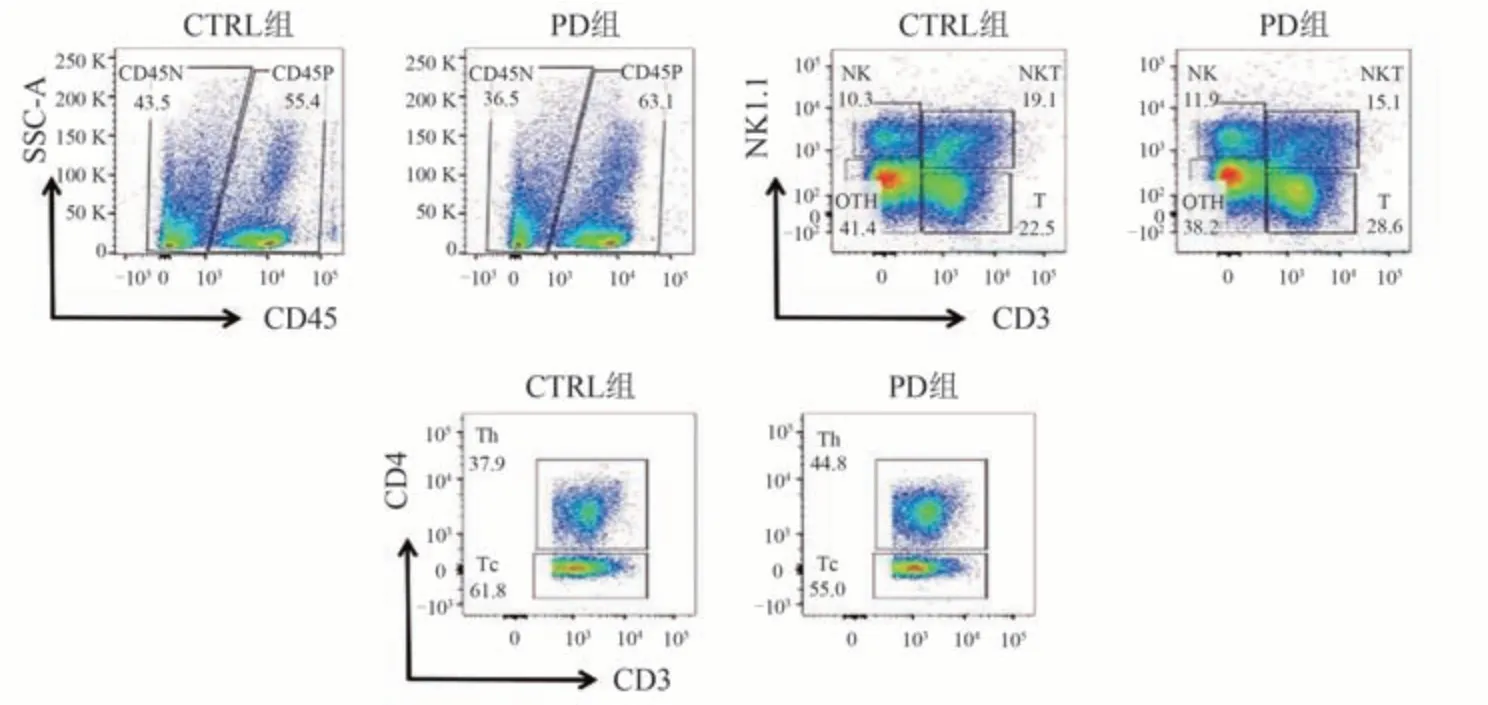
图1 各组小鼠肺脏淋巴细胞募集情况
3.1.2 生理状态下CXCR3+Th 和IFN-γ+Th 细胞在肺脏募集情况比较
CXCR3 是Th1 的标志性趋化因子受体,IFN-γ 是Th1细胞特异性功能因子。流式细胞术分析结果显示,与CTRL组相比,PD组小鼠肺脏Th细胞表达CXCR3的水平显著升高,CXCR3+Th细胞比例和数量均上升(P<0.001,P< 0.01);小鼠肺脏Th细胞表达IFN-γ的水平显著升高,IFN-γ+Th 细胞比例和数量均上升(P<0.01,P< 0.001)。说明PD可显著促进CXCR3+Th细胞和IFN-γ+Th细胞在肺脏的募集。见表3、图2。
表3 各组小鼠肺脏Th细胞CXCR3、IFN-γ表达变化(±s,n = 6)

表3 各组小鼠肺脏Th细胞CXCR3、IFN-γ表达变化(±s,n = 6)
注:与CTRL组比较,**P < 0.01,***P < 0.001。
组别CTRL组PD组IFN-γ+Th cells/107 0.51 ± 0.06 0.93 ± 0.06***CXCR3+Th cells/%5.52 ± 0.40 7.77 ± 0.34***CXCR3+Th cells/107 1.08 ± 0.31 1.73 ± 0.17**IFN-γ+Th cells/%6.37 ± 0.28 7.44 ± 0.52**
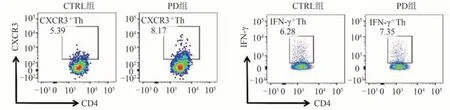
图2 各组小鼠肺脏Th细胞CXCR3、IFN-γ表达情况
3.1.3 生理状态下肺组织CXCL9、CCL5、IFN-γ、GZMB mRNA的表达情况比较
CXCL9、CCL5是Th1细胞趋化和迁移的重要趋化因子,IFN-γ、GZMB是Th1细胞的重要功能性因子。RTqPCR结果显示,与CTRL组相比,经PD灌胃处理后,小鼠肺脏CXCL9、CCL5、IFN-γ、GZMB mRNA表达水平均不同程度的升高(P< 0.001,P< 0.05,P< 0.01,P< 0.05),说明PD 可通过升高趋化因子CXCL9、CCL5,优势促进CXCR3+Th细胞在肺脏的分布,并且促进Th1标志性功能因子IFN-γ和GZMB在肺组织中高表达。见表4、图3。
表4 各组小鼠肺脏CXCL9、CCL5、IFN-γ、GZMB mRNA表达情况比较(±s,n = 6)
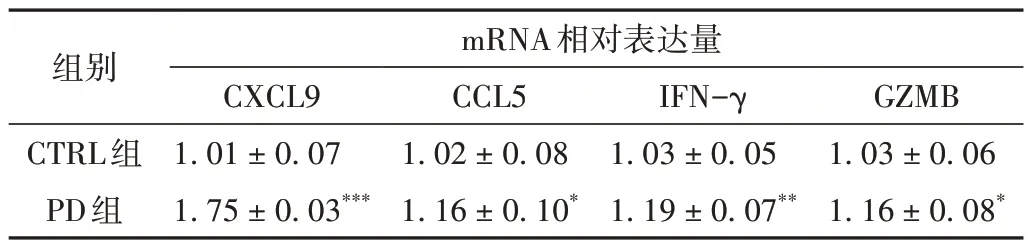
表4 各组小鼠肺脏CXCL9、CCL5、IFN-γ、GZMB mRNA表达情况比较(±s,n = 6)
注:与CTRL组比较,*P < 0.05,**P < 0.01,***P < 0.001。
组别CTRL组PD组mRNA相对表达量GZMB 1.03 ± 0.06 1.16 ± 0.08*CXCL9 1.01 ± 0.07 1.75 ± 0.03***CCL5 1.02 ± 0.08 1.16 ± 0.10*IFN-γ 1.03 ± 0.05 1.19 ± 0.07**
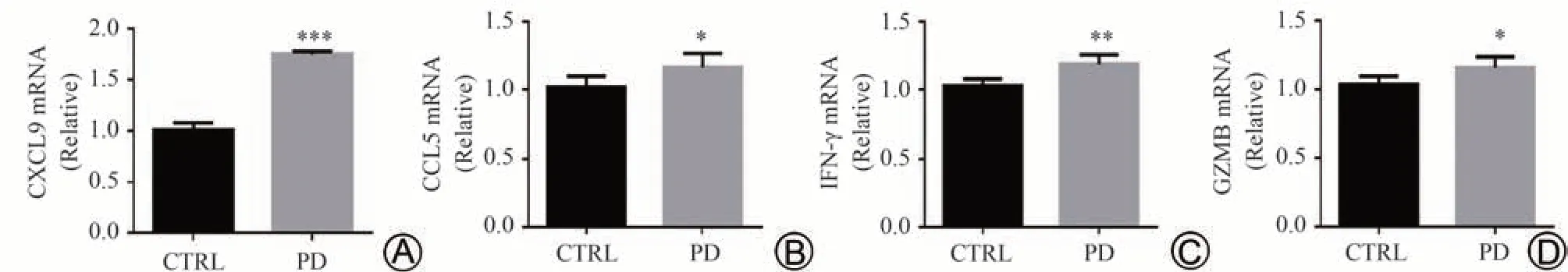
图3 各组小鼠肺组织CXCL9、CCL5、IFN-γ、GZMB mRNA表达情况
3.2 Th1 细胞在肺脏肿瘤微环境中分布并抑制B16黑色素瘤的肺转移情况
3.2.1 肺脏肿瘤微环境中Th细胞的募集情况比较
流式细胞术分析结果显示,与CTRL 组相比,B16模型小鼠肺脏Th 细胞比例和数量均下降(P< 0.001,P< 0.05),经PD 治疗后,Th细胞比例和数量均显著升高(P< 0.001,P< 0.001)。说明在肺脏肿瘤微环境中,PD可促进Th细胞的浸润或分布。见表5、图4。
表5 各组小鼠肺脏Th细胞比例及数量变化(±s,n = 6)

表5 各组小鼠肺脏Th细胞比例及数量变化(±s,n = 6)
注:与CTRL 组比较,*P < 0.05,***P < 0.001;与B16 组比较,###P <0.001。
Th cells/107 105.7 ± 10.83 90.70 ± 6.22*114.8 ± 7.63###组别CTRL组B16组B16 + PD组Th cells/%44.33 ± 1.45 38.58 ± 2.06***50.20 ± 1.02***###
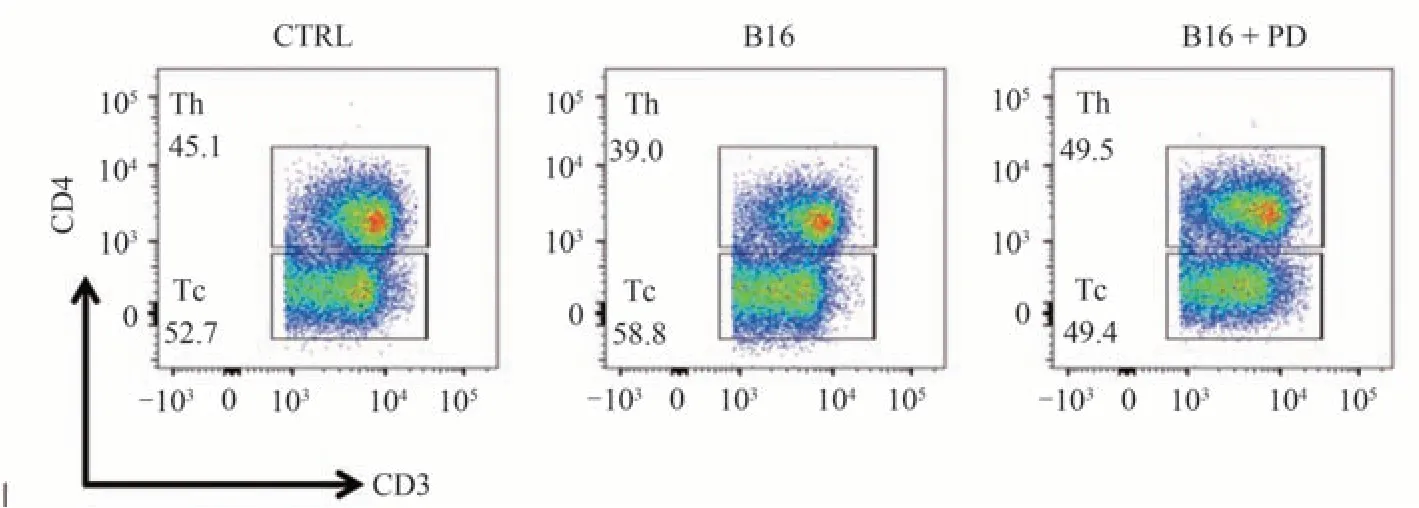
图4 各组小鼠肺脏Th细胞募集情况
3.2.2 CXCR3+Th 和IFN-γ+Th 细胞在肺脏肿瘤微环境中的募集情况比较
在B16黑色素瘤肺转移模型中,经PD治疗后,肺脏肿瘤克隆数明显减少(P< 0.01),PD对B16黑色素瘤肺转移具有显著的抑制作用。流式细胞术分析结果显示,与B16模型组相比,经PD治疗后,小鼠肺脏Th细胞高表达CXCR3 和IFN-γ,CXCR3+Th 细胞比例和数量均升高(P< 0.001,P< 0.01),IFN-γ+Th细胞比例和数量均升高(P< 0.001,P< 0.01)。说明在肺脏肿瘤微环境中,PD 可促进CXCR3+Th 和IFN-γ+Th 细胞在肺脏募集,使其成为肺脏抗肿瘤的重要效应细胞。见表6、图5。
表6 各组小鼠肺脏肿瘤克隆及Th细胞表达CXCR3、IFN-γ比较(±s)

表6 各组小鼠肺脏肿瘤克隆及Th细胞表达CXCR3、IFN-γ比较(±s)
注:与CTRL组比较,**P < 0.01,***P < 0.001;与B16组比较,##P < 0.01,###P < 0.001。
组别CTRL组B16组B16 + PD组IFN-γ+Th cells/107 3.59 ± 0.81 3.44 ± 0.86**##7.62 ± 1.39**##n 6 6 6肿瘤克隆—93.67 ± 12.69 69.33 ± 3.62##CXCR3+Th cells/%3.81 ± 0.28 10.95 ± 1.08***21.83 ± 1.267***###CXCR3+Th cells/107 4.45 ± 0.49 14.86 ± 3.27**23.54 ± 1.37***##IFN-γ+Th cells/%3.67 ± 0.24 3.20 ± 0.29 6.17 ± 0.99***###
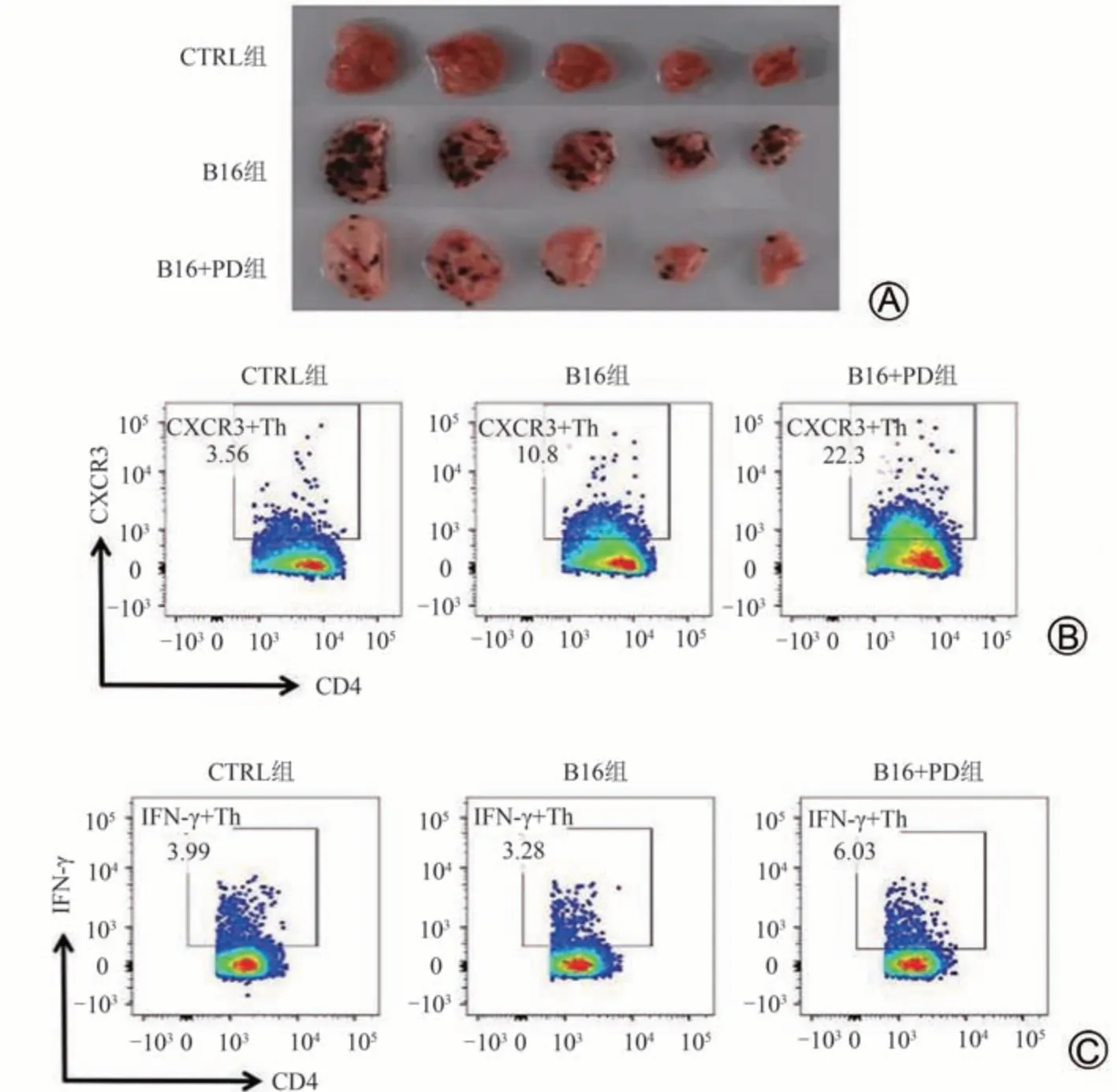
图5 各组小鼠肺脏肿瘤克隆及Th细胞CXCR3,IFN-γ表达情况
3.2.3 肺脏肿瘤微环境中CXCL9、CCL5、IFN-γ、GZMB基因的转录水平情况比较
单细胞测序分析发现,经PD 治疗后,小鼠肺脏肿瘤微环境中CXCL9,CCL5 基因转录水平显著升高,同时,小鼠肺脏Th1细胞数由59升高至89,并且Th1细胞中IFN-γ 和GZMB 基因转录水平也明显升高,说明在肺脏肿瘤微环境中,PD 可促进肺脏细胞高表达趋化因子CXCL9 和CCL5,促进Th1 细胞在局部募集,且高表达IFN-γ 和GZMB 等抗肿瘤效应因子,进而抑制B16黑色素瘤肺转移,发挥抗肿瘤作用。见图6。
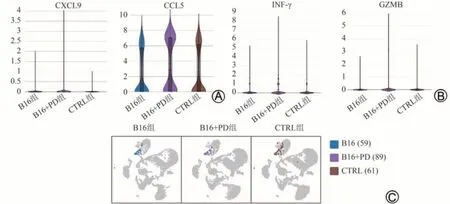
图6 各组小鼠肺脏肿瘤微环境中Th1细胞分布及CXCL9、CCL5、IFN-γ、GZMB基因转录水平变化
4 讨论
T 细胞是维持肺脏免疫微环境稳定的重要细胞群体,其中,Th 细胞因大量分泌多种细胞因子,成为维持免疫微环境稳定、肺脏局部免疫反应特异性和长效性的关键。目前对Th细胞亚群的认识越来越丰富,根据表型和细胞因子分泌特征可将Th 分为Th1、Th2、Th17、Treg、Th9 和Tfh 等多个细胞亚群。其中,Th1 细胞以大量分泌IFN-γ 为主要特征,广泛刺激天然免疫细胞和获得性免疫细胞的活化和增殖[7]。在先天免疫反应中,IFN-γ 促进巨噬细胞、Ⅰ型先天淋巴样细胞(ILC1s)和自然杀伤细胞(NK)的激活;可诱导抗原呈递细胞(APC)主要组织相容性复合体(MHC)Ⅰ类和Ⅱ类分子高表达;驱动树突状细胞(DC)的扩增,全面协调抗肿瘤先天免疫反应,在肿瘤发展早期作用尤为显著[8-10]。在适应性免疫过程中,IFN-γ 促进B 细胞产生抗体,加速Th1 极化,促进细胞毒性T 细胞(CTL)的激活和记忆T 细胞(Tm)的扩增,从而增强特异性和持久性抗肿瘤免疫[11-13]。近年来研究发现,Th1 的特异性转录因子T-bet 也可诱导Th1 细胞表达GZMB,PRF1 等杀伤性效应因子,实现MHC-Ⅱ限制性和抗原特异性杀伤功能,进一步强化了Th1 细胞的抗肿瘤效能[14],使Th1 成为抗肿瘤免疫反应的主力军和放大器。因此,优势促进Th1细胞在肺脏募集,是保持肺脏局部防御体系完整性、高效性和长效性的重要策略。
Th1 细胞表达CXCR3、CXCR4 和CCR5 趋化因子受体,可在CXCL9/10/11/12 和CCL5 等趋化因子的引导下进行组织分布。其中,Th1细胞优势表达CXCR3,CXCR3+Th1 细胞具有快速迁移、迅速识别病原信号和大量分泌IFN-γ、GZMB等效应因子的特性,是驻守肺脏门户的重要防御力量[15-17]。
本研究发现,无论是生理状态下还是肿瘤微环境中,PD 均可促进小鼠肺脏Th 细胞IFN-γ、CXCR3 表达,提示PD 可优势促进Th1 细胞在肺脏募集,这与PD上调肺脏基质细胞CXCL9、CCL5的表达密切相关。另外,PD 可增强Th1 对IFN-γ、GZMB 等效应因子的释放能力,而IFN-γ 可进一步促进CXCL9、CXCR3 的表达[18],循环放大了Th1免疫效应,逆转肿瘤微环境的免疫抑制状态。PD 治疗后肺脏肿瘤克隆数显著降低,同时Th1 细胞中IFN-γ 和GZMB 表达升高,这些结果为PD 靶向调控Th1 募集和活化,放大抗肿瘤效应提供了有力证据。B16 模型组小鼠肺脏CXCR3+Th 细胞比例也明显升高,但IFN-γ 分泌能力显著下降,其升高的CXCR3+Th 细胞主要来源于Th17 细胞(结果未展示)。进一步说明PD 可通过促进肺脏趋化因子CXCL9、CCL5 的表达,优势募集Th1 细胞,并大量分泌IFN-γ和GZMB,全面提高肺脏抗肿瘤免疫功能,抑制B16 黑色素瘤的肺转移,为PD抗肿瘤肺脏转移的临床应用提供了科学依据。
本研究的局限性在于针对PD 的药理研究没有进行剂量依赖性系统观察,虽然检测了PD中部分有效成分的含量,但仍需对这些成分开展细胞选择性和趋化因子靶向性的药理机制研究,为PD的临床应用提供更加精准的科学证据。
——辨别味之苦甜

