成人肝移植术后早期肝外脏器功能管理策略
邓羽霄,赵贤元,皋 源
(上海交通大学医学院附属仁济医院重症医学科,上海 200127)
20世纪90年代中、后期,中国肝移植开始蓬勃发展。中国肝移植注册网数据显示,2022年全国实施各种类型肝移植手术6 053例,2015-2022年术后1、2和3年的生存率分别为90.4%、87.7%和86.0%。2017年,上海交通大学医学院附属仁济医院肝移植团队实施各种类型肝移植手术803 例,刷新了单中心全年肝移植手术的世界纪录。这些数据标志着我国肝移植技术已日臻成熟,正进入国际先进行列。
术后重症监护水平的进步大大提高了肝移植手术的成功率。同时将肝移植的适应证向病情复杂、严重的病人扩大,这些病人除肝功能处于终末期外,通常还合并其他重要肝外器官的功能损伤。本文就心、肺、肾、脑等重要肝外脏器在成人肝移植术后早期的管理策略作详细论述。
1 肝移植术后循环系统异常
肝移植手术指征不同,病人术后早期循环系统会有不同表现。以末期肝病为手术指征的病人术后早期循环系统异常多表现为术后低血压。通常起始于术中无肝期并延续至术后第1 天。引起低血压的主要因素有术中失血、移植肝缺血再灌注损伤、边缘性供肝、肝肾综合征等,少见于术后感染、心血管事件[1]。其他循环系统异常的临床表现包括恶性心律失常、术后心力衰竭(心衰)以及术后高血压。术后早期高血压不多见,多由疼痛等引起。肝移植术后早期恶性心律失常是严重的并发症,发生机制目前尚不明确。
1.1 血流动力学监测
肝移植病人结束手术需继续进行血流动力学监测,根据低血压的严重程度可采取有创方式,以获得更多血流动力学参数。对前负荷、心肌收缩力及后负荷三个方面的评估有助于移植术后的精准液体治疗。对于合并门静脉性肺动脉高压以及其他需左、右心功能单独评价的病人,建议采用漂浮导管技术进行监测。由于手术创口以及操作者水平等因素,床旁超声技术应用受限,目前未进行临床推广。
1.2 液体治疗
除外失血情况,肝移植病人一般术后采取负性液体治疗。对于前负荷评估的最佳方式并无统一规定,对最佳前负荷状态仍存在争议。由于肝移植病人术前可能合并肝肾综合征、肝硬化性心肌病、门静脉性肺动脉高压等情况,因此,负性液体治疗的目标需个体化设定。
1.3 血管活性药物
肝硬化病人扩血管物质清除能力下降,血流动力学参数显示高排低阻的表型,血管活性药物通常选择去甲肾上腺素。研究发现,曲前列环素具有减少移植肝缺血再灌注损伤的作用,因此,有肝移植中心开始探索曲前列环素使用的临床效果[2]。
1.4 正性肌力药物
推荐等待受体术前常规进行心功能评估,明确是否存在冠状动脉疾病、瓣膜疾病、肝硬化性心肌病(cirrhotic cardiomyopathy,CCM)[3]以及门静脉性肺动脉高压。CCM 诊断标准包括收缩功能障碍和舒张功能障碍两部分,两部分相互独立。收缩功能障碍的诊断标准有2 条:①左心室射血分数≤50%;②收缩期峰值整体纵向应变绝对值<18%或>22%,满足其中1 条标准即可诊断。舒张功能障碍的诊断标准有4 条:①二尖瓣瓣环室间隔部早期舒张速度<7 cm/s;②舒张早期二尖瓣流入速度比值>15;③左心房容积>34 mL/m2;④二尖瓣反流速度>2.8 m/s,满足其中3 条标准即可诊断。指南以及专家共识目前不推荐左心室射血分数≤40%以及肺动脉平均压≥50 mmHg的病人接受肝移植手术[4-6]。文献报道肝移植术后出现新发心衰的情况较少,发生率为1.2%~14%[7]。肝移植围术期出现血流动力学变化时,建议先行血流动力学监测,出现左心室收缩功能下降的情况才推荐正性肌力药物。
2 肝移植术后呼吸系统异常
肝移植术后肺部并发症(post-liver transplantation pulmonary complication, PTPC)是导致肝移植病人入住重症监护病房时间延长的主要原因。PTPC的危险因素包括术前因素(如年龄、肝病严重程度和基础肺部疾病)和围术期因素(如术中液体平衡和出血量)[1]。PTPC病人多以急性低氧为临床表现,常见PTPC包括胸腔积液、肺水肿、肺不张和肺部感染。
2.1 影像学检查
肝移植是上腹部手术,肝移植病人结束手术需常规行肺部影像学检查。检查手段包括肺部CT、床旁胸片、电阻抗成像(electrical impedance tomography, EIT)以及床旁超声等。EIT 可同时床旁观察肺部通气和血流情况,在围术期早期PTPC 排查中具有广泛的临床应用前景[8]。
2.2 氧疗和氧合目标
早期研究认为肝移植术后存在移植肝缺血再灌注损伤,所以推荐术后早期进行氧疗,氧疗还可能减少围术期感染的发生。但最近进行的随机对照研究并未发现氧疗能减少围术期感染的发生[9]。术后氧合目标对于移植肝缺血再灌注损伤的影响,目前还缺乏临床数据支持。
2.3 机械通气
肝移植病人术前应常规排查是否存在肝肺综合征,肝肺综合征不是延长机械通气的原因。目前指南明确推荐术后早期拔管。轻度肺水肿不会导致机械通气时间、重症监护病房住院天数延长。高流量吸氧病人依从性较好,目前较多作为序贯手段,序贯无创通气可能使合并心功能异常病人获益[10]。术后中重度急性呼吸窘迫综合征的发生率为2%~5%,危险因素包括肺部感染、原发性移植物无功能以及移植物功能延迟恢复[11]。
3 肝移植术后泌尿系统异常
文献报道高达50%的肝移植病人发生术后急性肾损伤(acute kidney injury, AKI),危险因素包括肝移植术前并发症、供体和受体相关特征、围术期因素以及肝移植术后免疫抑制剂方案[12]。
3.1 AKI定义
目前采用改善全球肾脏病预后组织(Kidney Disease: Improving Global Outcomes, KDIGO)对AKI的定义。即48 h内血肌酐(serum creatinine, sCr)至少增加26.5 μmol/L(0.3 mg/dL),在过去7 d 内,sCr至少增加到基线sCr 的1.5 倍;或6 h 内尿量少于0.5 mL/(kg·h)[13]。根据发生事件的时间,AKI 分为早期和晚期,两者的危险因素不同。早期AKI发生在术后1周,而晚期AKI发生在术后2~4周[14]。
3.2 AKI预测指标
一些新型生物标志物可预测肝移植术后AKI,并区分功能性与结构性AKI。较有希望临床广泛应用的生物标志物包括中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL)、肾损伤分子1、肝脂肪酸结合蛋白、白细胞介素18 以及最近确定的组织抑制金属蛋白酶2 和结合蛋白[15-16]。本院肝移植术后监护团队发现术后第1天凝血功能可预测AKI 3期的发生[17]。
3.3 肾脏替代治疗及其启动时机
大多数AKI 病人为AKI 1 期或2 期,无需接受肾脏替代治疗(renal replacement therapy, RRT);约15%的病人需启动RRT[17]。目前尚无肝移植术后AKI 启动RRT 最佳时机的临床研究。多数肝移植中心的启动时机是出现容量过负荷、高钾血症以及酸中毒。
3.4 免疫抑制方案
肝移植术后免疫抑制方案目前以钙调磷酸酶抑制剂(calcineurin inhibitor, CNI)为主,而CNI 具有非剂量依赖性肾毒性。在肝移植术后早期免疫诱导阶段多采用两种策略。一种是早期增加多克隆或单克隆抗体,延迟CNI 的使用[18];另一种是采用包括麦考酚酯的四联方案,减少CNI 的剂量[19]。延迟CNI 使用策略降低术后早期AKI 发生风险,四联方案多用于明确有AKI 发生高风险或已有肾功能损伤的病人。
4 肝移植术后中枢神经系统异常
与其他实体器官移植相比,肝移植术后中枢神经系统异常的发生率较高,所以肝移植术后早期需常规监测神经系统体征。如发现有意识障碍或定位体征,应及时行影像学检查。其中肝性脑病(hepatic encephalopathy,HE)是最常见的合并症。HE是由肝功能不全和(或)门体分流引起的脑功能障碍,表现为广泛的神经或精神异常,从亚临床改变到昏迷[20]。HE 的诊断需根据分类、分期、诱因以及时长,制定不同的治疗方案。其中复发性和持续性HE是明确的肝移植指征,首次显性HE是考虑加入肝移植等待列表的指征[21]。
4.1 HE的分类、分期、诱因
根据不同的病因将HE 分为A、B 和C 型3 种类型。A 型为急性肝衰竭基础上发生;B 型为门体分流所致;C 型为肝硬化基础上发生。根据严重程度进行HE 分期(见表1)。近年来增加了轻微型HE(minimal HE, MHE)的定义,得到广泛认可,旨在将HE 的发现窗口前移,及时诊断并干预。近年提出ISHEN 分期,将MHE 和WHC 分期中的Ⅰ期HE 统称为隐匿性HE;WHC Ⅱ~Ⅳ期HE 为显性HE。HE的常见诱因有感染、炎症风暴、消化道出血、利尿剂过量、电解质紊乱、便秘等。6 个月或更短间隔出现的HE 发作为复发性HE。6 个月内HE 的症状未完全消失或进展为显性HE 定义为持续性HE。两次HE发作间隔>6个月,且期间症状完全消失,为间隔性HE[21]。
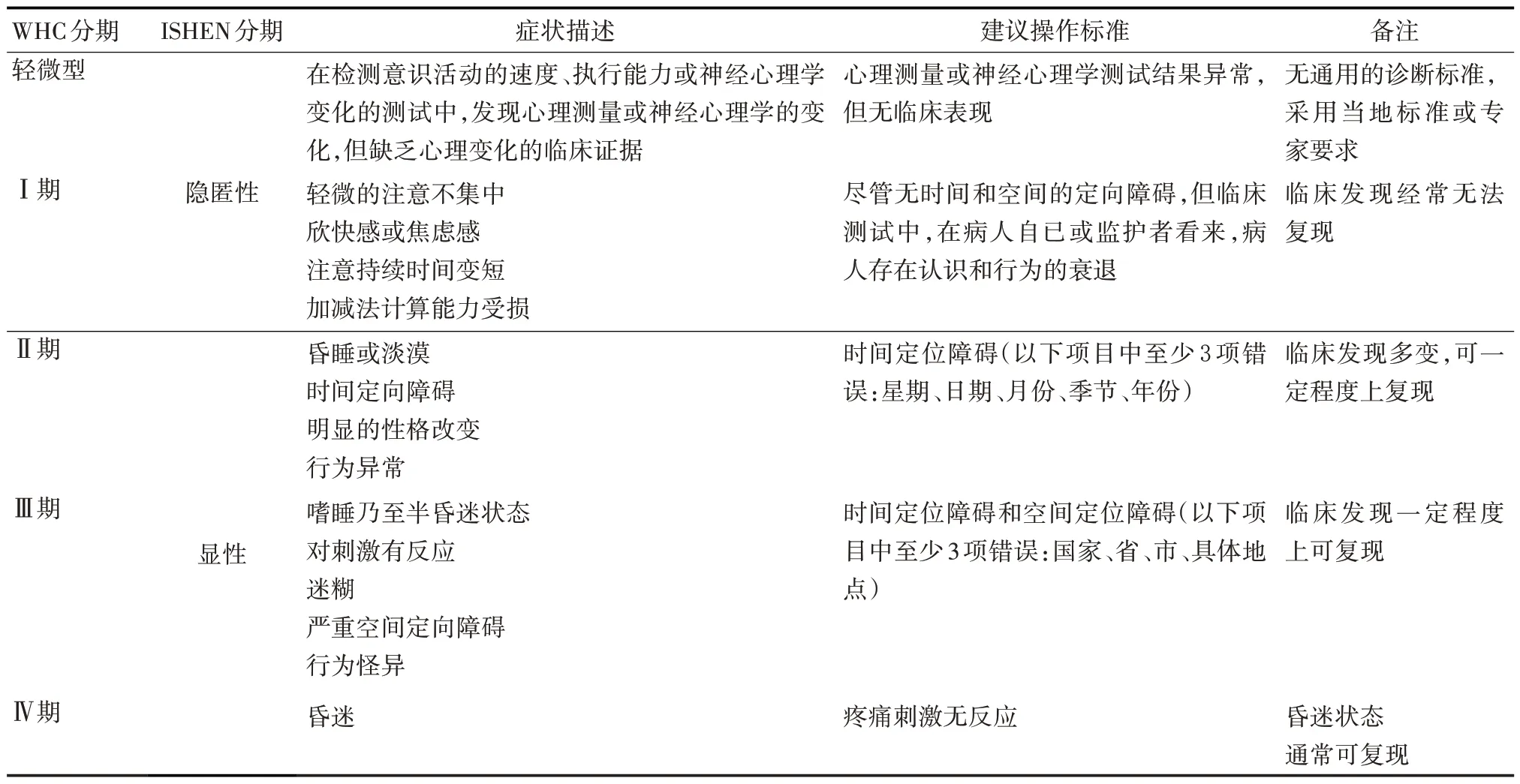
表1 HE的分期和临床表现Tab 1 Grade system for HE and clinical description
4.2 HE的治疗
肝移植被认为是HE 最有效的治疗手段。为了最大限度保护神经功能,HE 防治是肝移植前的维护重点。指南推荐非吸收双糖乳果糖和利福昔明联合用药,积极排查诱因并去除,血氨的绝对水平并非治疗重点。显性HE 病人治疗流程如图1,需要增加气道保护环节[21]。Ⅳ期HE 过去被认为是肝移植的绝对禁忌证,但目前已有文献报道成功案例[22-23]。肝移植术后应根据病情变化及时评估,继续HE的内科治疗方案[21]。

图1 显性HE住院病人管理流程Fig 1 Algorithm for the management of a hospitalised patient with overt HE
4.3 其他中枢神经系统异常
由于大多数凝血因子和抗凝因子由肝脏生成,肝移植术后早期存在低凝状态,也是颅内出血的高发时期。肝移植围术期发生颅内出血的高危因素有失血、移植肝缺血再灌注损伤、边缘性供肝以及颅内感染等。可逆性后部脑病综合征(posterior reversible encephalopathy syndrome, PRES)临床表现为头痛、意识障碍、癫痫,其发病可能与他克莫司的使用有关。文献报道,50%的肝移植等待病人存在不同程度的低钠血症,低钠血症的快速纠正是渗透性脱髓鞘综合征(osmotic demyelination syndrome,ODS)的明确病因。围术期保证血钠>125 mmol/L,维持血钠变化<6 mmol/L可减少ODS的发生率[24]。
总体而言,肝移植术后早期肝外脏器功能管理策略有助于肝移植病人早期快速康复,但目前很多尚未明确,有待解决。相信随着肝移植术后重症监护水平的不断提高,我国必将成为肝移植强国。

