LPS致家兔发热模型的建立及用于壮瑶药解热活性成分筛选
邓玲玉 朱华 许立拔 谢凤凤 罗静 平静云 农丽珍 李茵兰 曾艳芳 陈雅玲 岑思
摘要:通過静脉注射不同剂量内毒素(LPS),评价LPS所致家兔发热模型的最佳剂量。造模后1 h,所有提取物、壮瑶药活性单体进行给药。使用智能热原仪测量LPS家兔的肛温变化,并计算肛温增长值、变化率和每个时间点解热积分及各供试品的解热总积分。结果表明,注射LPS 1 h后,所有家兔肛温均比基础肛温升高0.8~3.0 ℃,模型组家兔在造模后肛温维持高温状态,未见明显改变。与模型组比较,7种壮瑶药的提取物均有1个或以上时间点肛温变化率显著降低,按解热总积分大小排序表现为蝙蝠草醇提物>旱田草水部位提取物>白子菜水提物>火炭母醇提物>旱田草石油醚部位提取物>拳卷地钱醇提物>兰香草水提物>旱田草正丁醇部位提取物>铁皮石斛榨汁。13种壮瑶药的活性单体均有1个或以上时间点肛温变化率显著降低,按解热总积分大小排序表现为山奈酚>川陈皮素>橙皮苷>异槲皮素>芹菜素>槲皮素>紫云英苷>没食子酸>醋酸洗必泰>鞣花酸>绿原酸>木犀草素>金合欢素。在本试验条件下,确定LPS复制家兔发热模型的最佳剂量为4.0 μg/kg;7种壮瑶药提取物和13种壮瑶药活性单体有良好的解热作用。
关键词:发热; 内毒素(LPS); 壮瑶药; 活性单体; 解热作用
中图分类号:R363;R285.6 文献标识码:A
文章编号:0439-8114(2023)12-0120-10
DOI:10.14088/j.cnki.issn0439-8114.2023.12.022 开放科学(资源服务)标识码(OSID):
Establishment of LPS-induced rabbit fever model and evaluation of antipyretic effects of Zhuang and Yao medicine ingredients
DENG Ling-yu, ZHU Hua, XU Li-ba, XIE Feng-feng, LUO Jing, PING Jing-yun, NONG Li-zhen,
LI Yin-lan, ZENG Yan-fang, CHEN Ya-ling, CEN Si
(Guangxi Scientific Research Center of Traditional Chinese Medicine, Guangxi University of Chinese Medicine, Nanning 530200, China)
Abstract: The optimal dose of replicating the fever model of endotoxin (LPS) in rabbits was evaluated using different doses of LPS intravenously. 1 h after modeling, all extracts and active monomers of Zhuang and Yao ethnic medicine were administered. The rectal temperature changes of LPS rabbits were measured by the intelligent pyrogen instrument, and the anal temperature growth value, change rate, antipyretic score at each time point and the total antipyretic score of each test sample were calculated. The results showed that after LPS injection for 1 h, the temperature of all rabbits increased by 0.8~3.0 ℃ compared with the basal rectal temperature, and the temperature of the model rabbits remained high after molding, and there was no significant change. Compared with the model group, the rectal temperature change rate of rabbits treated with 7 kinds of extracts from Zhuang and Yao ethnic medicine was significantly reduced in 1 or more time points, and the order of the total heat antipyretic score was as follows: Ethanolic extract of Christia vespertilionis (L. f.) Bahn. f.>water extract of Lindernia ruellioides (Colsm.) Pennell.>water extract of Gynura divaricata (Linn.)DC. >ethanolic extract of Polygonum chinense L.>petroleum ether extract of Lindernia ruellioides (Colsm.) Pennell.>ethanolic extract of Marchantia convluta Gao et Chang>water extract of Caryopteris incana (Thunb.)Miq.>n-butanol extract of Lindernia ruellioides (Colsm.) Pennell.>water extract of Dendrobium officinale Kimura et Migo. The change rate of rectal temperature of rabbits treated with 13 active monomers of Zhuang and Yao ethnic medicine decreased significantly at one or more time points. According to the total score of antipyretic effects, the order was as follows: Kaempferol > nobiletin > hesperidin > isoquercetin > apigenin > quercetin > astragalin > gallic acid > chlorhexidine acetate > ellagic acid > chlorogenic acid > luteolin > acacetin. Under the conditions of this experiment, the optimal dose of LPS replicating the fever model of rabbits was 4.0 μg/kg; the extracts obtained from 7 kinds of Zhuang and Yao ethnic medicine and 13 kinds of active monomers of Zhuang and Yao ethnic medicine had good antipyretic effects.
Key words: fever; endotoxin(LPS); Zhuang and Yao ethnic medicine; active monomer; antipyretic effects
发热,即体温升高超出正常范围,是一种机体警示多种因素所致疾病发生发展的重要信号,如组织损伤、感染、肿瘤或移植排斥等[1]。维持体温恒定可维持机体新陈代谢和正常生命活动,但人体高热状态下,不及时降温,易发生脑组织损伤、缺氧等,引发抽搐、脱水、昏厥等高危症候,危及生命[2-4]。婴幼儿大脑体温调节中枢尚未发育成熟,高温刺激易导致其损伤,出现危重症状或留下危重后遗症[2,3]。中医记载发热始见于《内经》《素问》等,记为“病热”“身热”,中医认为诱发发热病因众多,是机体正邪相争或阴阳失调的表现,发热类型有微热、壮热、潮热、骨蒸烦热、恶寒发热和往来寒热等[5]。
LPS是革兰阴性菌释放的脂多糖,是一种外源性致热源。LPS进入机体可导致多组织器官产生氧化应激、炎症反应和细胞凋亡,加速多种组织器官纤维化进程,如肺纤维化、肝纤维化等,刺激多种炎症因子水平升高,如前列腺素E2(PGE2),PGE2是刺激大脑体温调控中枢升高体温的主要因子[6,7]。
人体血液内LPS的主要来源是肠道,正常情况下,LPS不透过肠壁或稍有透过,透过肠道入血的少量LPS可与抗-LPS-抗体或高密度脂蛋白(HDL-C)形成复合物,或被肝、脾的单核巨噬细胞吞噬而清除。而高温、疾病等刺激诱发机体高温,可使肠道肠系膜通透性增加,肠源性LPS入血浓度增加,外源性致热源如内毒素(LPS)进入机体,直接或间接作用于单核细胞、巨噬细胞等,分泌内生致热原物质,刺激体温调节中枢调高体温调定点,引起发热[8,9]。血液LPS浓度过高,还会引发休克、弥散性血管内凝血(DIC)和多器官功能障碍综合征等[10]。高温是肠源性LPS入血的主要原因,故解热降温是相应治疗药物的直接药效指标之一。
解热试验常用的实验动物是家兔或大鼠,其中家兔對LPS敏感,易复制发热模型,且发热持续时间长,故解热试验首选家兔。通过检测体温变化可以简单评价疾病所致的机体病理学改变和预后[11]。但目前LPS复制家兔发热模型受试验环境的影响,满足试验要求的LPS造模浓度各不相同。
吕邵娃等[2]建立家兔发热模型,采用家兔耳缘静脉注入LPS溶液,浓度为20 μg/mL,剂量为20 μg/kg;郑晨等[12]、周彦希等[13]建立家兔发热模型,采用家兔耳缘静脉注入LPS溶液,浓度为2 μg/mL,剂量为2 μg/kg;周茜雅等[14]、徐志勇等[15]建立家兔发热模型,采用家兔耳缘静脉注入LPS溶液,浓度为0.2 μg/mL,剂量为0.2 μg/kg;马中女等[16]建立家兔发热模型,采用家兔耳缘静脉注入LPS溶液,浓度为0.5 μg/mL,剂量为0.5 μg/kg;巴图德力根等[17]建立家兔发热模型,采用家兔耳缘静脉注入 LPS溶液,浓度为0.75 μg/mL,剂量为0.75 μg/kg;李雪苓等[18]建立家兔发热模型,采用家兔耳缘静脉注入LPS溶液,浓度为2.5 μg/mL,剂量为3.75 μg/kg。可见,试验前探索适合本试验条件下LPS致家兔发热模型建立的LPS浓度非常有必要,成功的LPS致家兔发热模型应该满足体温在规定时间内升高到规定的体温,并具有可控性,即有合适的阳性对照药可以拮抗LPS的升温作用。只有模型方法认证成功才能用于药物的解热作用研究。
临床常用解热药物有阿司匹林、对乙酰氨基酚[19]、布洛芬、水杨酰胺、扑热息痛及非那西丁等[20],应用此类药进行治疗可达到解热的效果,但造成的副反应较多[19],如对血液系统产生不良影响,包括引起再生贫血、粒细胞及血小板计数减少等;对消化系统的不良影响包括恶心、呕吐、腹痛等;对泌尿系统产生最多的不良反应有血尿、急性肾功能衰竭等;产生过敏反应包括过敏性皮疹、哮喘以及过敏性休克,严重者可能造成患者死亡[21]。壮瑶医药是壮瑶族人民在漫长的生产生活及同疾病斗争中形成和发展起来的,是国内中医药的重要组成部分。壮瑶药狗肝菜具有清热、凉血、解毒作用[22];拳卷地钱清热利湿、解毒敛疮[23];铁皮石斛微寒,益胃生津,滋阴清热[24];白子菜清热解毒,凉血止血[25];火炭母清热解毒,利湿消滞[26];旱田草理气活血,解毒消肿[27];兰香草疏风解表,祛痰止咳,散瘀止痛[28];蝴蝶草清热凉血,消瘀肿[29,30]。咖啡酸、原儿茶酸、丁香酸、槲皮素、绿原酸、木犀草素、山奈酚为上述壮瑶药药材的活性成分,因此,本研究对壮瑶药单味药提取物或单体进行筛选,以期为壮瑶药解热药物研发提供试验及理论依据。
1 材料
1.1 实验动物和饲养环境
新西兰家兔45只,雄性,普通级,体重1.7~3.0 kg,购于广西广得生物科技有限公司,实验动物生产许可证号为SCXK桂2017-0001,饲养于广西中医药大学实验动物中心标准实验兔房,温度监控室为功能实验室热原室,符合普通级要求[31],实验动物使用许可证号为SYXK(桂)2019-0001。
1.2 药物及试剂
蝙蝠草(广西壮族自治区柳州市鹿寨县拉钩乡),为豆科蝙蝠草属植物蝙蝠草[Christia vespertilionis (L. f.) Bahn. f.]的干燥全草;火炭母(广西河池市大化县岩滩镇六甲村),为蓼科蓼属植物火炭母(Polygonum chinense L.)的干燥全草;兰香草(广西药用植物园),为马鞭草科莸属植物兰香草[Caryopterisincana (Thunb.)Miq.]的全草;旱田草(南宁市上林县),玄参科植物旱田草[Lindernia ruellioides (Colsm.) Pennell.]的全草;铁皮石斛(南宁市江南区苏圩镇广西弄峰山铁皮石斛种植基地),为兰科植物铁皮石斛(Dendrobium officinale Kimura et Migo)的茎;狗肝菜(南宁市青秀区药师山),为爵床科植物狗肝菜[Dicliptera chinensis(L.)Nees.]的全草;白子菜,菊科植物白背三七[Gynura divaricata (Linn.)DC.]的全草;拳卷地钱,地钱科地钱属植物拳卷地钱(Marchantia convoiuta Gao et Chang)的全草。以上植物经广西中医药大学滕建北教授鉴定为正品,所用提取物由广西壮瑶药重点实验室提供。
内毒素(LPS)(批号0000081275),美国Sigma公司;NaCl注射液(批号2020071911),江西东亚制药有限公司;羧甲基纤维素钠(CMC-Na)(批号20151215),国药集团化学试剂有限公司;医用乙醇(批号20150801),武汉市雪环医用消毒用品有限公司;咖啡酸(批号110885-200102)、原儿茶酸(批号110809-201906)、槲皮素(批号100081-201610)、没食子酸(批号110831-201906)、山奈酚(批号110861-202013)、木犀草素(批号111520-202006)、异槲皮苷(批号111809-201804)、茜草素(批号110884-201606)、橙皮苷(批号110721-202019)、对香豆酸(批号112037-201801)、川陈皮素(批号112055-202001)、甜菜碱(批号110894-201604)、醋酸氯已定(批号100183-201003),中国食品药品检定研究院;绿原酸(批号MUST-21070910),成都曼斯特生物科技有限公司;异绿原酸(批号RP190517),成都麦德生科技有限公司;丁香酸(批号17122703),成都菲尔德生物技术有限公司;金合欢素(批号20170612),上海诗丹德科技生物有限公司;紫云英苷(批号171205),成都瑞芬思生物科技有限公司。以上国家标准品纯度均大于98%。鞣花酸(批号G26J11L119602),上海源叶生物科技有限公司,经HPLC检测鞣花酸含量为96.0%;芹菜素(批号C12462383),上海麦克林生化科技有限公司,经高效液相色谱仪(HPLC)检测芹菜素含量≥95.0%。
1.3 仪器
MP100K型电子台秤,上海舜宇恒平科学仪器有限公司;ES 2220M型电子天平(感量:1 mg),瑞士PRECISA;ZRY-2D型智能热原仪,天津市天大天发科技有限公司;Direct-Q 5 UV-R型超纯水仪,美国Merck Millipore;DHG-9240A型鼓风干燥箱,上海一恒科学仪器有限公司。
2 方法
2.1 試验环境
使用空调控制家兔体温监控室和饲养室的室温差,不超过3 ℃,家兔体温监控室的室温控制在22~25 ℃,试验期间室温变化值不超过3 ℃。每1 h记录室温1次。
2.2 家兔的初筛
取家兔45只,适应性饲养7 d后,预编号,使用智能热原仪初筛,30 min记录肛温1次,共8次,肛温均在38.0~39.6 ℃,且温差不超过0.4 ℃被认定是合格家兔,经筛选,有43只家兔符合要求,用于试验。
2.3 LPS致家兔发热模型的建立
试验前禁食24 h,造模前测定家兔肛温2次,间隔1 h,取2次肛温的均值作为基础体温,淘汰肛温不在38.5~39.5 ℃或温差大于0.4 ℃的家兔。随机选取6只家兔编入正常组,按1 mL/kg于耳缘静脉注射无菌生理盐水,其余家兔按1 mL/kg于耳缘静脉注射LPS,LPS剂量设置分别为0.2、2.0、4.0、20.0 μg/kg,浓度分别为0.2、2.0、4.0、20.0 μg/mL,每浓度6只家兔[2,12-18]。记录造模后1、2、3、4、5 h的肛温,每1 h记录1次,共5次,记录各时间点肛温、肛温变化值(即肛温与基础体温差值)。①50%或以上家兔造模后1 h肛温升温≥0.8 ℃;②各时间点肛温、基础体温差值与正常对照组具有显著性差异(P<0.05);③无死亡。
模型可控性认证试验:取合格家兔6只,耳缘静脉注射符合①②③条件的LPS剂量及LPS浓度造模,造模后1 h,按0.5 mL/kg灌胃给予布洛芬药液(10 mg/kg)[32]后,记录给药后1、2、3、4 h的肛温,每1 h记录1次,共4次,应至少1个时间点肛温或基础体温差值与正常对照组具有显著性差异(P<0.05),均则认为该LPS剂量及LPS浓度适合用于药物筛选。
肛温变化率=100%×(造模后1 h肛温-给药后时间点肛温)/造模后1 h肛温增长量。
2.4 八种有解热功效壮瑶药的提取物对LPS致发热家兔影响的研究
2.4.1 剂量设计 8种有解热功效的壮瑶药提取物剂量均设定为200 mg/kg,按5 mL/kg给药。火炭母醇提物得膏率为11.26%,1 g浸膏=8.88 g原药材。蝙蝠草醇提物得膏率为9.88%,1 g相当于原药材10.12 g。兰香草水提物得膏率为14.33%,1 g相当于原药材6.98 g。旱田草4个部位提取物:石油醚部位得膏率为0.71%,1 g相当于原药材140.8 g;水部位得膏率为12.66%,1 g相当于原药材7.9 g;正丁醇部位得膏率为6.85%,1 g相当于原药材14.6 g;乙酸乙酯部位得膏率为2.04%,1 g相当于原药材49.0 g。铁皮石斛榨汁,直接用于试验。白子菜水提物得膏率为14.33%,1 g相当于原药材5.26 g。拳卷地钱醇提物得膏率为9.36%,1 g相当于原药材10.68 g。狗肝菜醇提物得膏率为10.29%,1 g相当于原药材9.71 g。
2.4.2 供试品的配制 火炭母醇提物,蝙蝠草醇提物,旱田草石油醚部位、水部位、正丁醇部位、乙酸乙酯部位提取物,拳卷地钱醇提物,狗肝菜醇提物,加0.5%羧甲基纤维素钠(0.5% CMC-Na)配制成40 mg/mL混悬液,用于灌胃。兰香草水提物、白子菜水提物加去离子水配制成40 mg/mL药液,用于灌胃。铁皮石斛榨汁,取新鲜铁皮石斛加去离子水榨汁,过滤成40 mg/mL榨汁液,用于灌胃。所用布洛芬混悬液,布洛芬的含量为20 mg/mL,故无需配制,按0.5 mL/kg直接用于灌胃,灌完后用2 mL去离子水将药液完全助推入胃内。
2.4.3 造模、分组及给药 试验前禁食24 h,造模前测定家兔肛温2次,间隔1 h,取2次肛温的均值作为基础体温,淘汰肛温不在38.5~39.5 ℃或温差大于0.4 ℃的家兔。合格家兔按1 mL/kg于耳缘静脉注射LPS(4 μg/kg)。LPS注射1 h后,选取肛温升温≥0.8 ℃的家兔13只,分为模型组、火炭母醇提物组、蝙蝠草醇提物组、旱田草4个部位组(石油醚部位、水部位、正丁醇部位、乙酸乙酯部位)提取物、拳卷地钱醇提物组、狗肝菜醇提物组、兰香草水提物组、白子菜水提物组、铁皮石斛榨汁组,所用供试品剂量均采用200 mg/kg,布洛芬组(10 mg/kg),每组1只。供试品不同浓度的相应药液按5 mL/kg灌胃给药,布洛芬混悬液按0.5 mL/kg灌胃给药。记录给药后1、2、3、4 h肛温,每1 h记录1次,共4次。记录各时间点肛温、肛温变化值,并计算肛温变化率和解热积分。
解热积分评判标准:肛温变化率下降<25%,计0分;25%≤肛温变化率下降<50%,计1分;50%≤肛温变化率下降<75%,计2分;75%≤肛温变化率下降<100%,计3分;100%≤肛温变化率下降,计4分。
2.5 有解热功效壮瑶药的20种活性单体对LPS致发热家兔的影响
2.5.1 剂量设计、供试品溶解度及给药途径的确定 18种有解热功效壮瑶药活性单体,为国家药品标准品,20 mg/瓶,统一使用NaCl注射液配制成 5 mL药液(4 mg/mL),按2 mL/kg腹腔注射或静脉注射,剂量为8 mg/kg。其中咖啡酸、原儿茶酸、丁香酸、槲皮素、木犀草素、山奈酚、异槲皮苷、茜草素、橙皮苷、金合欢素、醋酸氯已定、对香豆酸、紫云英苷、川陈皮素、异绿原酸不能完全溶解、微溶或不溶,不适合用于静脉注射,故采用腹腔注射给药(i.p);绿原酸、没食子酸、甜菜碱能完全溶解,故采用静脉注射给药(i.v);2种有解热功效壮瑶药化合物单体芹菜素和鞣花酸,量大,适合用于灌胃(i.g),芹菜素(20 mg/kg)和鞣花酸(50 mg/kg)按5 mL/kg给药。
2.5.2 造模、分组及给药 试验前禁食24 h,造模前测定家兔肛温2次,间隔1 h,取2次肛温均值作为基础体温,淘汰肛温不在38.5~39.5 ℃或温差大于0.4 ℃的家兔。合格家兔按1 mL/kg于耳缘静脉注射LPS(4 μg/kg)。LPS注射1 h后,选取肛温升温≥0.8 ℃的家兔22只,适合腹腔注射的标准品单体,按2 mL/kg腹腔注射;适合静脉注射的标准品单体按 2 mL/kg静脉注射;适合灌胃的单体按5 mL/kg灌胃给药。另设模型组、布洛芬组(10 mg/kg),每组1只。记录给药后1、2、3、4 h肛温,每1 h记录1次,共4次。记录各时间点肛温、肛温变化值,并计算肛温变化率和解热积分。解热积分评判标准同“2.4.3”,肛温变化率计算公式同“2.3”。
2.6 数据统计
采用SPSS 17.0软件进行数据分析,以x±s表示,P<0.05被认为具有统计学意义。计量数据需满足正态分布和方差齐性,整体数据先进行单因素方差分析(One-Way ANOVA Test),若无差异,则结束,若差异有统计学意义,下一步进行LSD Test分析;非正态数据或方差不齐的数据,先进行Kruskal-Wallis Test分析,若无差异,则结束,若差异有统计学意义,下一步进行Mann-Whitney U Test分析。肛温变化率采用卡方检验统计差异性。
3 结果与分析
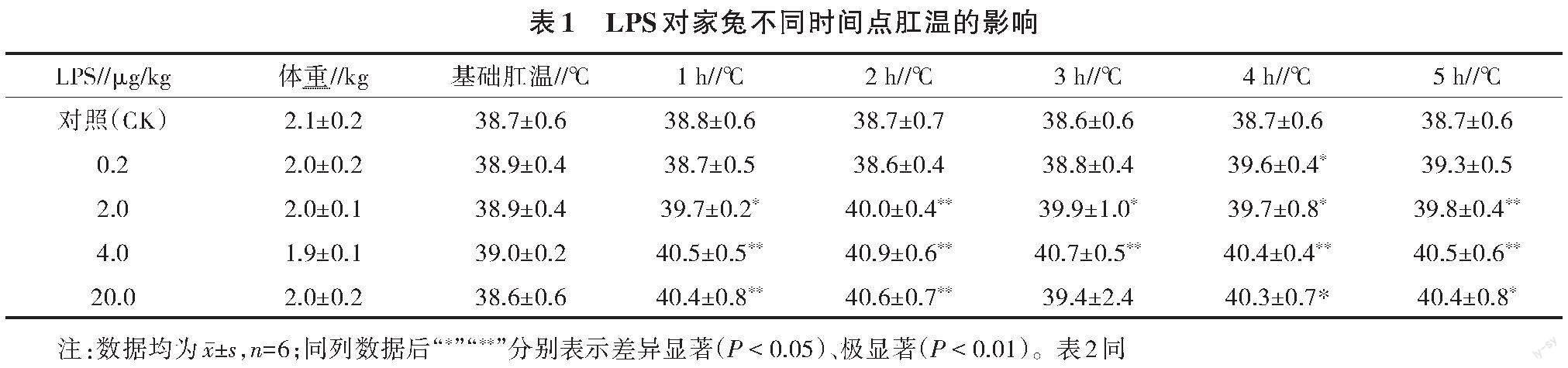
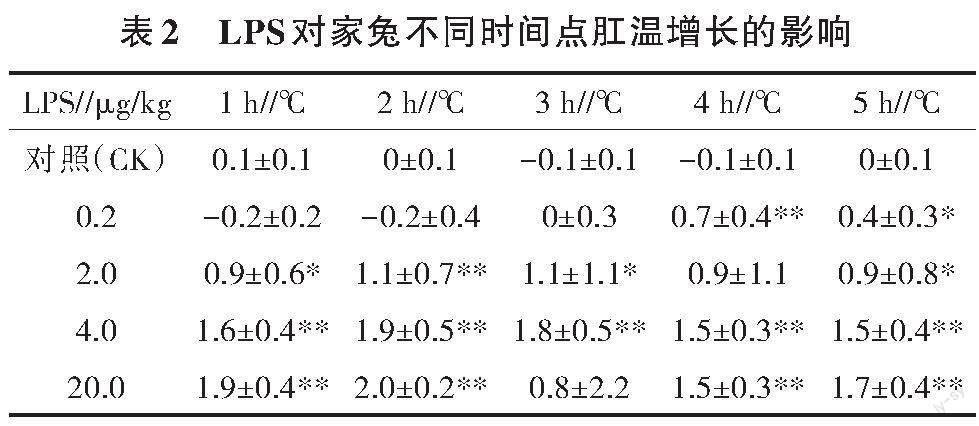
3.1 LPS不同时间点对家兔肛温的影响
由表1、表2可知,与对照组比较,LPS 0.2 μg/kg剂量组造模后4 h肛温显著增加,4 h和5 h肛温增长量差异显著或极显著;LPS 2.0 μg/kg剂量组造模后,除4 h肛温增长量差异不显著外,其余时间点肛温及肛温增长量差异均显著或极显著;LPS 4.0 μg/kg剂量组造模后,各时间点肛温及肛温增长量差异均极显著;LPS 20.0 μg/kg剂量组造模后,除3 h肛温和肛温增长量差异不顯著外,其余时间点肛温及肛温增长量差异均显著或极显著。LPS 2.0、4.0、20.0 μg/kg剂量组均可满足造模后1 h肛温增长量大于0.8 ℃的要求,但20.0 μg/kg剂量组3 h后出现2只家兔死亡,死亡率为33.33%,有死亡风险,不利于试验顺利进行,故不适合用于造模;LPS 2.0、4.0 μg/kg剂量组均适合用于试验,但4.0 μg/kg剂量组肛温及肛温增长更稳定,故每1 h记录肛温1次,共5次经模型可控性认证试验。
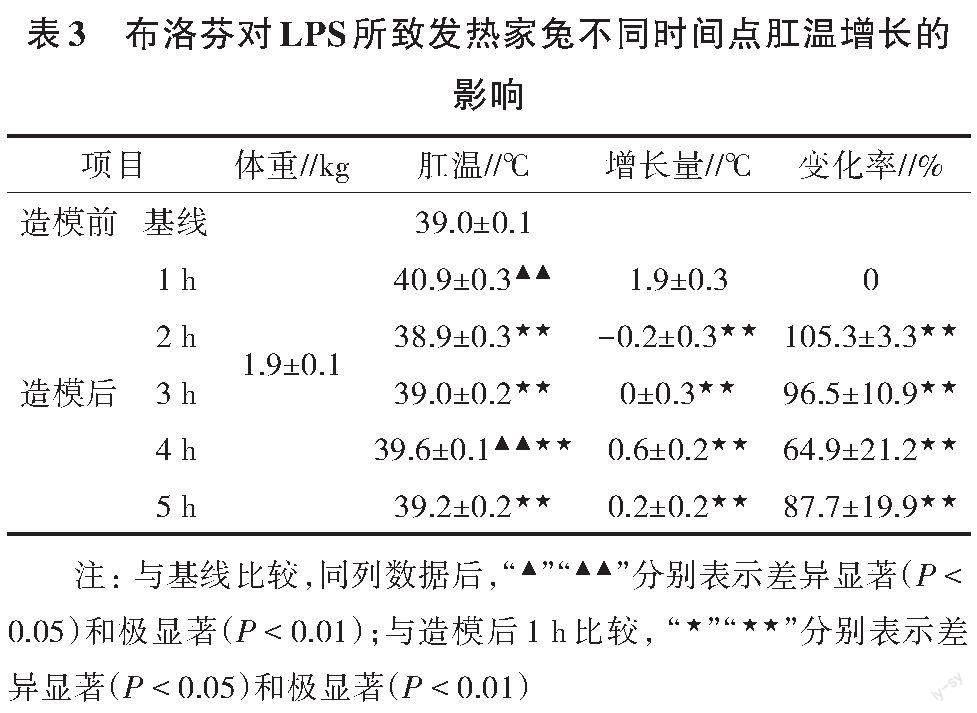
由表3可知,与基础肛温比较,造模1、4 h后,布洛芬组家兔肛温显著增加。给药后,降温效果维持2 h,3 h后出现升温,说明布洛芬给药后3 h可能对LPS抑制作用减弱;与造模后肛温及肛温增长比较,药后各时间点肛温及肛温增长均显著减少,说明LPS 4.0 μg/kg剂量适合用于造模,且具有可控性。
3.2 八种有解热功效壮瑶药的提取物对LPS致发热家兔的影响
由表4可知,造模后,模型组家兔肛温持续升高,且维持高温状态,未见明显降温趋势;而布洛芬组家兔给药后1 h肛温明显降低,与模型组比较,给药后1~4 h各时间点肛温变化率均极显著降低,最大肛温变化率为131.3%;给药后,除狗肝菜醇提物外,其余7种有解热功效壮瑶药的提取物均有1个或以上时间点肛温变化率均显著降低(P<0.05或P<0.01),按解热积分大小排序表现为蝙蝠草醇提物(11)>旱田草水部位提取物(10)>白子菜水提物(9)>火炭母醇提物(8)>旱田草石油醚部位提取物(7)>拳卷地钱醇提物(6)>兰香草水提物(4)>旱田草正丁醇部位提取物(2)>铁皮石斛榨汁(1)>旱田草乙酸乙酯部位提取物(0),狗肝菜醇提物(0),其中,给药后4 h内最大肛温变化率下降超50%的提取物有蝙蝠草醇提物、旱田草水部位提取物、白子菜水提物、火炭母醇提物、旱田草石油醚部位提取物、拳卷地钱醇提物、兰香草水提物,最大肛温变化率分别下降120.0%、112.5%、140.0%、83.3%、91.7%、84.6%、81.3%。
3.3 有解热功效壮瑶药的20种活性单体对LPS致发热家兔的影响
由表5可知,造模后,模型组家兔肛温持续升高,且维持高温状态;而布洛芬组家兔给药后1 h肛温明显降低,与模型组比较,给药后4 h内各时间点肛温变化率均极显著降低,最大肛温变化率为89.5%;给药后,除咖啡酸、原儿茶酸、丁香酸,异绿原酸外,其余16种有解热功效的壮瑶药活性单体均有1个或以上时间点肛温变化率显著降低(P<0.05或P<0.01),按解热积分大小排序表现为山奈酚(13)>川陈皮素(12)>橙皮苷(10)>异槲皮素(9)、芹菜素(9)>槲皮素(8)、紫云英苷(8)、没食子酸(8)>醋酸氯己定(7)、鞣花酸(7)>绿原酸(6)、木犀草素(6)、金合欢素(6)>茜草素(2)>对香豆酸(1)>咖啡酸(0)、原儿茶酸(0)、丁香酸(0)、异绿原酸(0)、甜菜碱(0),其中,给药后4 h内最大肛温变化率下降超50%的提取物有山奈酚、川陈皮素、橙皮苷、异槲皮素、芹菜素、槲皮素、紫云英苷、没食子酸、醋酸氯己定、鞣花酸、绿原酸、木犀草素、金合欢素,最大肛温变化率分别下降116.7%、100.0%、107.7%、100.0%、133.3%、77.8%、72.7%、80.0%、88.2%、145.5%、64.7%、58.3%、68.8%。
4 讨论
发热病病机复杂,最常见为外感发热。持续高热,特别是患儿的体温长期维持在38.5 ℃以上,易出现糖代谢障碍,甚至严重破坏血脑屏障[33]。且持续高热加快人体耗氧量和各种营养素的代谢,使机体抵抗力下降,增加感染机会[34]。
祖国医学早在五千年前就有了外感发热的记载,《素问》篇章《热论》《刺热》《评热病论》及《灵枢·热病》篇章《热病》中均有外感风热的描述,如《素问·热论》曰:“今肤热病,皆伤寒……人之伤于寒也,则为病热”。发热被壮医命名为“勒爷发得”,认为“病从毒起”,其中“毒”分为外生之毒和内生之毒,邪毒阻滞人体“三道两路”,使气血脏腑神经等功能紊乱而发病,故發热当以祛毒、调气为先[35,36]。
壮医认为“阴阳为本、三气同步”,蓄毒与祛毒均与“三道两路”相关,即“三道两路”皆可蓄毒与祛毒。“三道两路”又隐喻为“外道内路”。三道与自然相通,即谷道、水道、气道。谷道对应人体从自然获取和排泄营养精微的一切通道,不仅包括消化道和脏腑,如食道、胃肠和肝、胆、胰等;水道对应人体从自然获取和排泄滋阴物质(不只是水)的一切通道,不仅包括肾、膀胱,排泄滋阴物质也包括汗、尿等;气道对应人与自然交换和排泄与生命相关气体(不只是空气)的一切通道,不仅是肺、毛孔等;两路与人体生命活动相关,即龙路和火路,龙路又名血脉、龙脉,是人体内与生命相关物质运行的通道,包括血脉、淋巴管脉、体液脉络等;火路是人体内传递与生命相关信息的通道,如感觉、电波、音波、声波等[35-38]。壮医的“三道两路”区别于传统中医,即三道两路是无形的,是壮医药发展的信息集合体。
发热病从毒起,又分外生之毒和内生之毒,故发热当以祛毒为先。“外道祛毒”,即通过辨证论治,让毒通过三道而解。若毒生于谷道,即致热性营养精微摄入过多或排泄不畅,则应停止摄入或增加排泄;若毒生于水道,即滋阴性物质摄入不足或排泄过多,不足以满足阴阳平衡的生命运行状态,则应增加摄入或减少排泄;若毒生于气道,即六淫(风、寒、暑、湿、燥、火)之邪气和疫疬之气侵袭过盛,如天气过热而产生机体中暑,邪蕴体内而致病,当使用医学手段启动人体卫气、营气、元气,祛邪外出或灭邪于体内。“内路祛毒”,即通过辨证论治,让毒通过两路而解。若因龙路运行失调而导致毒蕴体内或排毒不畅,则应使用医学手段启动增强龙路运行,灭毒于体内或驱毒外出;若因火路传递信息受阻或传递异常信息而导致毒蕴体内或排毒不畅,则应疏通信息脉络(如针灸、泡浴等),向大脑中枢传递正确信息,利用三道和龙路灭毒于体内或驱毒外出[35-38]。
广西是少数民族集聚地,其中壮瑶药对广西人民身体健康影响深远。具有退热功效的壮瑶药是研发解热新药的宝库。有研究表明,壮药制剂香茅退热外洗方[39]、救必应颗粒[40]、童热清浴剂[41,42]、抗感清热颗粒[43]和瑶药“野葛花”[44]、美丽胡枝子[45]均具有良好的解热功效。在壮医理论的指导下,朱华等[30]编写了《中国壮药图鉴》,记载了狗肝菜、拳卷地钱、铁皮石斛、白子菜、火炭母、旱田草、兰香草、蝴蝶草等均具有解热功效,为本研究选取试材及其有效成分单体提供了实践和理论依据。
家兔是解热试验的首选动物,且对LPS敏感,但因环境不同发热强度及持续时间均不相同[11]。为了确定本试验条件下可以满足药物评价的稳定致热家兔模型,进行了LPS致家兔发热浓度及剂量考察,发现LPS浓度为4.0 μg/mL,剂量为4.0 μg/kg造模效果最佳,多次试验均可满足家兔造模后5 h内维持高温状态,且该升温作用可以被布洛芬所拮抗,满足动物模型复制临床症状特征和可控性的药物评价要求,说明LPS诱导的家兔发热模型复制成功。
本研究结果显示,以给药后4 h内肛温变化率超50%为解热效果阳性标准,8种壮瑶药有7种满足阳性结果评价要求,按解热积分由大到小排序依次为蝙蝠草醇提物、旱田草水部位提取物、白子菜水提物、火炭母醇提物、旱田草石油醚部位提取物、拳卷地钱醇提物、兰香草水提物、旱田草正丁醇部位提取物、铁皮石斛榨汁,而旱田草乙酸乙酯部位提取物和狗肝菜醇提物被认定为解热无效物质;20种单体物质有13种满足阳性结果评价要求,按解热积分由大到小排序依次为山奈酚、川陈皮素、橙皮苷、异槲皮素、芹菜素、槲皮素、紫云英苷、没食子酸、醋酸氯己定、鞣花酸、绿原酸、木犀草素、金合欢素,而7种单体被认定为解热无效物质,分别为茜草素、对香豆酸、咖啡酸、原儿茶酸、丁香酸、异绿原酸、甜菜碱。其中旱田草有解热作用的单体成分有芹菜素、木犀草素,无解热作用的单体有咖啡酸[46];白子菜有解热作用的单体成分有槲皮素、山奈酚、异槲皮素、紫云英苷,无解热作用的单体有对香豆酸[47];火炭母有解热作用的单体成分有槲皮素、异槲皮素、芹菜素、山奈酚、木犀草素、没食子酸、鞣花酸,无解热作用的单体有咖啡酸、原儿茶酸、丁香酸[48];拳卷地钱有解热作用的单体成分有芹菜素、槲皮素、木犀草素[49];兰香草有解热作用的单体成分有芹菜素、木犀草素、没食子酸,无解热作用的单体有原儿茶酸[50];铁皮石斛有解热作用的单体成分有芹菜素、槲皮素、异槲皮素、山奈酚[51]。其中芹菜素、木犀草素、槲皮素、山奈酚为多种解热壮瑶药所共有的有效成分单体。
综上,通过LPS复制家兔发热模型,用于评价壮瑶药提取物及其有效成分单体的解热作用,发现多种有解热作用的提取物和有效解热单体,但由于时间短、资金不足、且研究强度太大,每个供试品模型样本量仅为1,不能满足统计学要求,所得结果欠科学性,且所设置的供试品剂量和给药途径各不相同,不具有可比性,所用有效成分单体数量较少,不能代表所用壮瑶药的有效成分,所得结果仅供参考,更多解热作用模型和相关机制还有待于进一步研究发现;有部分有效单体不是本试验所用壮瑶药活性成分,因此后期可根据活性成分单体筛选出更多有解热作用的壮瑶药药材;筛选出的芹菜素、木犀草素、槲皮素、山奈酚4种共有的有效成分单体,下一步可以进行更深入的解热作用及机制研究。
5 小结
在本试验条件下,经剂量和浓度考察,LPS复制家兔发热模型的最佳浓度为4.0 μg/mL,最佳剂量为4.0 μg/kg,该发热模型用于壮瑶药提取物及有效成分单体筛选,发现有解热作用的有效提取物按解热积分由大到小排序依次为蝙蝠草醇提物、旱田草水部位提取物、白子菜水提物、火炭母醇提物、旱田草石油醚部位提取物、拳卷地钱醇提物、兰香草水提物、旱田草正丁醇部位提取物、铁皮石斛榨汁;有解热作用的有效成分单体按解热积分由大到小排序依次为山奈酚、川陈皮素、橙皮苷、异槲皮素、芹菜素、槲皮素、紫云英苷、没食子酸、醋酸氯己定、鞣花酸、绿原酸、木犀草素和金合欢素。
参考文献:
[1] HASSAN D A,YESMIN N,ISLAM M A,et al. Antipyretic activity of argyreia nervosa in yeast induced pyrexia[J].J Pharm Pharm Sci,2019,9(1):1358-1365.
[2] 呂邵娃,武印奇,李英鹏,等.白虎汤不同相态对发热模型家兔血清中TNF-α、IL-1β及IL-6水平的影响[J].国际药学研究杂志,2020,47(10):870-875.
[3] DUBEY A,TIWARI M,SINGH Y,et al. Investigation of anti-pyretic activity of Vinpocetine in Wistar Rat[J].Int J Pharmaceut Res,2020,12(2):1901-1906.
[4] AHMAD S,REHMAN T,ABBASI W M. In vivo evaluation of antipyretic effects of some homeopathic ultra-high dilutions on Bakers yeast-induced fever on similia principle[J].J Ayurveda Integr Me,2018,2018(9):177-182.
[5] 陈坚雄,邱仕君,刘成丽.邓铁涛中医发热病学学术构想分析[J].广州中医药大学学报,2012,29(6):716-718,724.
[6] YANG H H,HUA C,YANG X L,et al. Pterostilbene prevents LPS-induced early pulmonary fibrosis by suppressing oxidative stress, inflammation and apoptosis in vivo[J].Food Funct,2020(11):1-25.
[7] GEGE-ADEBAYO G I,BASSI A S,IGBOKWE V U,et al. Antipyretic effect of Ocimum gratissium on brewers yeast induced fever in wistar rats[J].J Med Sci,2013,4(6):247-251.
[8] OGOINA D. Fever, fever patterns and diseases called ‘fever-A review[J].J Infect Public Heal,2011,4(3):108-124.
[9] ZHANG X,WANG Y,LI S J,et al. The potential antipyretic mechanism of gardeniae fructus and its heat-processed products with plasma metabolomics using rats with yeast-induced fever[J].Front pharmacol,2019,2019(10):1-12.
[10] 周茜雅,陈 婧,范 莉,等.消炎退热颗粒清热解毒作用研究[J].中国医院药学杂志,2020,40(2):168-173.
[11] QIAN W J,SHAN J J,SHEN C S,et al. Brain metabolomics reveal the antipyretic effects of Jinxin oral liquid in young rats by using gas chromatography-mass spectrometry[J].Metabolites,2019, 9(6):1-11.
[12] 郑 晨,蒋春红,曾君南,等.喜炎平注射液对细菌内毒素脂多糖致热家兔的解热作用[J].药学学报,2020,55(8):1836-1840.
[13] 周彦希,彭 成,万 峰,等.广藿香油对家兔内毒素性发热的作用[J].中国病理生理杂志,2014,30(10):1883-1886.
[14] 周茜雅,陈 婧,范 莉,等.消炎退热颗粒清热解毒作用研究[J].中国医院药学杂志,2020,40(2):168-173.
[15] 徐志勇,李晓波,张红英,等.穿心莲软胶囊对脂多糖发热模型家兔解热作用及其机制研究[J].中药新药与临床药理,2019,30(6):692-694.
[16] 马中女,杨丽娟,蒋淑君,等.家兔发热过程中单核细胞热休克蛋白70表达与白细胞介素-1β、肿瘤坏死因子-αmRNA表达的关系[J].中国现代医学杂志,2014,24(3):16-19.
[17] 巴图德力根,韩志强,娜日苏,等.达如奇颗粒对感染性发热增盛热证的解热作用研究[J].中药药理与临床,2013,29(5):98-102.
[18] 李雪苓,韩宁林,徐桂琴,等.重连口服液对内毒素致热新西兰兔解热作用及对血清TNF-α、IL-1β、IL-6表达水平的影响[J].安徽中医药大学学报,2014,33(5):63-65.
[19] 王 莉.抗感冒药物的应用与不良反应浅析[J].世界最新医学信息文摘,2017,17(7):79.
[20] 滕荣仕.抗感冒药西药类成分临床应用新进展[J].世界最新医学信息文摘,2019,19(95):37-38.
[21] 帕提古丽·玉苏普.抗感冒药物的应用与不良反应浅析[J].世界最新医学信息文摘,2015,15(37):138.
[22] 陈遇春.青草药识别与应用图谱[M].北京:中国医药科技出版社,2020.107.
[23] 牛思琪.广西产拳卷地钱的化学成分及活性研究[D].南宁:广西民族大学,2019.
[24] 李文瑞,李秋贵,史学军.中药别名辞典[M].北京:中国科学技术出版社,1994.261.
[25] 林余霖,李葆莉.新编中草药全图鉴3[M].福州:福建科学技术出版社,2020.419.
[26] 林余霖,李葆莉.新编中草药全图鉴2[M].福州:福建科学技术出版社,2020.83.
[27] 郑小吉,饶 军,林伟波.岭南中草药图谱[M].北京:中国医药科技出版社,2016.212.
[28] 饶 军,郑小吉.江西常见中草药图谱[M].北京:中国医药科技出版社,2018.137.
[29] 钟 鸣,黄瑞松,梁启成.中国壮药学[M].南宁:广西民族出版社,2016.308-309.
[30] 朱 华,戴忠华.中国壮药图鉴(下)[M].南宁:广西科学技术出版社,2020.151.
[31] 郝光荣.实验动物学[M].第2版.上海:第二军医大学出版社,2002.276.
[32] JIA L L,LI R,MA J,et al. Effects of Bai-Hu decoction on fever induced by lipopolysaccharide[J].Kaohsiung J Med Sci,2013, 29(3):128-132.
[33] 刘 祺.对小儿急性高热惊厥患者进行细致化护理的效果评析[J].当代医药论丛,2017,15(10):144-145.
[34] 林若凡.退热药对小儿有不良影响吗[J].健康人生,2009(4):35.
[35] 张晓春,王媛媛,李志锋,等.壮医药线背穴点灸对小儿外感发热的退热疗效研究[J].世界中西医结合杂志,2015,10(5):651-653.
[36] 张晓春,王媛媛,李志锋,等.壮医药线背穴点灸治疗小儿外感发热100例[J].西部中医药,2015,28(6):67-68.
[37] 李俊婵,荣亮均,雷龙鸣,等.壮医药线点灸结合三字经派幼科推拿治疗小儿发热47例[J].中国针灸,2019,39(12):1299-1300.
[38] 蒙秋云,梁 艺,欧 桂.壮医滚蛋疗法治疗小儿外感发热的疗效观察及护理体会[J].中医外治杂志,2021,30(2):76-77.
[39] 叶渊渊,农志飞,韦 杏,等.壮药香茅退热外洗方治疗小儿外感发热临床疗效研究[J].辽宁中医药大学学报,2018,20(11):45-48.
[40] 邓海霞,贾 思,陀 鹏,等.壮药(救必应颗粒)辅助治疗急性上呼吸道感染(风热犯表证)的临床研究[J].蛇志,2019,31(4):501-503.
[41] 黄瑞松,王鉴钧,苏 青,等.壮药童热清浴剂治疗小儿外感发热疗效观察[J].中国民族民间医药杂志,1996(23):13-15.
[42] 郑 捷,黄瑞松,王鉴钧,等.壮药童热清浴剂的主要药效学研究[J].中国民族民间医药杂志,1997,1997(26):35-39.
[43] 曹富宁.壮药抗感清热颗粒治疗上呼吸道感染效果分析[J].内蒙古中医药,2017,36(20):49-50.
[44] 苏妙贤,李药兰,周艳晖,等.瑶药“野葛花”的抗病毒和抑菌活性[J].暨南大學学报(自然科学与医学版),2006,27(2):204-208,213.
[45] 傅 静,许立拔,张 莹,等.美丽胡枝子不同提取部位对酵母菌致热大鼠发热的影响[J].中国新药杂志,2020,29(14):1642-1647.
[46] 谢凤凤,苏 健,蔡 毅,等.基于UHPLC-QE-MS方法分析壮药旱田草化学成分[J].壮瑶药研究,2021,2021(1):71-78,184-185.
[47] 陈 剑,MANGELINCKX S,吕 寒,等.白子菜醋酸乙酯部位的化学成分研究[J].中草药,2013,44(5):524-527.
[48] 韦安达,戴忠华,林 思,等.壮药火炭母化学成分及药理作用的研究进展[J].壮瑶药研究,2020,2020(1):30-36.
[49] 朱 华,许立拔,梁 爽.广西产拳卷地钱化学成分研究[J].中药材,2019,42(4):798-801.
[50] 陈美安,林春花,梁 雪.兰香草乙酸乙酯部位化学成分的研究[J].中成药,2021,43(4):939-943.
[51] 奚航献,刘 晨,刘京晶,等.铁皮石斛化学成分、药理作用及其质量标志物(Q-marker)的预测分析[J].中草药,2020,51(11):3097-3109.

