额尔齐斯河中的高体雅罗鱼胚胎和仔鱼发育观察
韩豪祥,金洪宇,廉 杰,马 波*
(1.中国水产科学研究院黑龙江水产研究所,黑龙江哈尔滨 150070;2.上海海洋大学,上海 201306)
额尔齐斯河位于新疆维吾尔自治区阿尔泰地区东北部,发源于中蒙边境阿尔泰山脉西南。额尔齐斯河上游在中国境内,是中国唯一一条属于北冰洋水系的国际河流。额尔齐斯河的纬度较高,在特殊的寒冷气候条件下,特产哲罗鲑(Hucho timen)、细 鳞 鲑(Brachymystax lenok)、北 极 茴 鱼(Thymallus arcticus)和江鳕(Lota lota)等珍稀名贵冷水鱼类物种。额尔齐斯河是中国重要的冷水鱼种质资源库[1]。人类的过度捕捞、外来物种引入和水利工程建设活动等都对额尔齐斯河中的鱼类的生存产生了严重威胁,破坏了其栖息环境,使哲罗鲑、北极茴鱼、高体雅罗鱼(Leuciscus idus)等土著物种濒危,额尔齐斯河中的鱼类资源明显衰退[2-4]。
高体雅罗鱼隶属于鲤科(Cyprinidae)、雅罗鱼属(Leuciscus),在中国仅分布于额尔齐斯河水系[1],属于喜冷水鱼类,具有春季时由下游上溯至上游河道并在较低的水温下产卵繁殖的习性[5]。因为高体雅罗鱼的个体较大且肉质鲜美,所以其是当地重要的经济鱼类[6-7],但是,高体雅罗鱼种群资源已经处于濒危状态,被新疆维吾尔自治区列为二级保护鱼类[8-9]。目前,通过人工繁育和采取增殖放流等措施,对额尔齐斯河中的高体雅罗鱼的种群资源进行保护[10]。
鱼类胚胎发育的形态学观察既是鱼类生活史研究的重要内容,也是繁殖生物学研究的重要内容。对鱼类胚胎发育特征和发育时序的了解有助于在育苗生产中对受精卵孵化和鱼苗培育环节的把握,从而提高孵化率和鱼苗成活率[11]。在自然条件下,冷水性鱼类繁殖环境的水温较低,例如,秦岭细鳞鲑(Brachymystax lenok tsinlingensis)[12]、川陕哲罗鲑(Hucho bleekeri)[13]、乌苏里白鲑(Coregonus ussuriensis)[14]和北极茴鱼[15]等的胚胎发育具有发育时间长和积温高的特点,这也是对寒冷环境下的适应性发育特征。额尔齐斯河中的白斑狗鱼(Escox lucius)[16]、梭鲈(Sander lucioperca)[17]和河鲈(Perca fluvitills)[18]也是喜冷水性鱼类,与高体雅罗鱼具有相似的自然繁殖习性。通过开展这些鱼类物种的繁殖生态学研究,可以为额尔齐斯河中的鱼类资源的保护与管理提供理论依据。
本研究以从额尔齐斯河中捕捞的野生高体雅罗鱼为亲本,通过人工催产、授精,获得高体雅罗鱼的受精卵,在其胚胎发育的各个时期,对胚胎进行观察和拍照,详细描述和记录高体雅罗鱼胚胎发育的特征,旨在丰富高体雅罗鱼的早期发育的生物学资料,为高体雅罗鱼的人工繁育和种质资源保护提供基础数据和理论依据。
1 材料和方法
1.1 样本采集和处理
2021 年4 月初至中旬,在额尔齐斯河布尔津河段,采用拉网方式,捕获高体雅罗鱼样本200尾。利用高锰酸钾,给捕获到的高体雅罗鱼样本消毒;然后,将高体雅罗鱼样本混合放入水泥池中暂养,在每日的9时、15时和20时各投喂一次。高体雅罗鱼样本暂养和孵化用水都为从引水渠中引入的自然河水。4月底,当水温上升并稳定在8 ℃以上时,便可以对高体雅罗鱼进行人工催产。
挑选出健康、无伤且胸鳍或头部珠星明显的雄鱼10 尾和腹部松软膨大的雌鱼5 尾,分别置于不同的网箱中,等待注射催产针。用于催产的雄鱼的(平均体质量±标准误)为(660.79±148.75)g,雌鱼的(平均体质量±标准误)为(665.68±140.11)g。
1.2 催产方法和过程
对每千克雌鱼注射10 μg 促黄体素释放激素(LHRH-A2)和2 000 IU 绒毛膜促性腺激素(HCG),对每千克雄鱼的注射剂量减半。从鱼的胸鳍基部凹陷处注射,注射完成后,将雌鱼和雄鱼分开暂养。分别于注射后24 h 和48 h,用手轻压雄鱼和雌鱼腹部,若有白色精液和成熟卵子流出,便可以进行人工授精工作。
采用干法,对高体雅罗鱼进行人工授精。用准备好的干毛巾擦干鱼体,将卵子和精子先后挤入盆中,立即加入生理盐水,同时用羽毛搅拌5 min,使其充分受精;因为高体雅罗鱼的卵为黏性卵,因此,在受精结束后,需要立即倒入搅拌好的泥浆,对受精卵进行脱黏,以免受精卵在后续的发育过程中因粘连而缺氧死亡;静置10 min后,将受精卵倒入准备好的孵化槽中,并不定时地进行搅拌,以避免受精卵粘连,增加氧气含量,使其能够正常发育。若干天后,待鱼苗破膜完成度达到90%以上时,将鱼苗放入新的孵化框中,依然采用微流水刺激,让其进行下一步的发育。采用随用随取的方法,取用受精卵和鱼苗。在本次实验中,共采集鱼卵100 000 粒,受精率为85.22%,孵化成功率为32.85%。
1.3 观察方法
1.3.1 胚胎观察方法
参照对硬骨鱼类胚胎发育研究的结果[16],将高体雅罗鱼胚胎发育过程划分为受精卵期、卵裂期、囊胚期、原肠胚期、神经胚期、器官形成期和孵化期。
在受精结束后,立刻采集受精卵样品,进行观察、拍照和记录。为了更清楚地监测高体雅罗鱼胚胎发育的过程,在受精卵期和卵裂期,每10 min采样和观察一次;在囊胚期,每30 min采样和观察一次;在原肠胚期,每1 h采样和观察一次;在神经胚期、器官形成期和孵化期,每2 h 采样和观察一次。
每次采样,采集20~30 个受精卵样品,利用Leica S6D解剖镜,观察样品,并拍照和记录,当样品中超过60%受精卵已经发育至某个时期,便将此时间定为该时期的起始时间,从前一个时期到下一个时期的持续时间为该发育时期的间隔时间。
利用HOBO Water Temp Pro v2 测温仪,每15 min 测一次水环境温度,实时监测受精卵的发育温度,用于计算积温。受精卵每一个发育时期的积温(℃·h)等于每一个发育时期的平均温度(℃)乘以该发育时期所经历的时间(h)。
利用4%的甲醛溶液,固定保存各个发育时期的受精卵,以便查验。
1.3.2 仔鱼观察方法
当鱼苗的孵化率约为90%时,此时的鱼苗即被定为初孵仔鱼(0 d)。随机捞取2~3 条初孵仔鱼,对其全长、头部、卵黄囊进行观察、拍照和测量;之后,在每天的同一时间,采用同样的方法,进行观察、拍照和测量,记录的天数依次为0 d、1 d、2 d、3 d……,直至观察到鱼苗的卵黄囊消失、开口摄食为止。
鱼苗的卵黄囊体积的计算公式为:
公式(1)中,V为卵黄囊的体积;L为卵黄囊的长径;D为卵黄囊的短径。
1.4 数据处理方法
利用Excel 2019 软件,对所有实验数据进行统计处理。利用GraphPad Prism 8.4.0软件,绘图。
2 结果与分析
2.1 胚胎发育的过程
在水温为(13.34±0.14)℃条件下,高体雅罗鱼胚胎由受精卵发育到鱼苗出膜历时234 h 20 min,经历了受精卵期、卵裂期、囊胚期、原肠胚期、神经胚期、器官形成期和孵化期,共需积温3 136.36 ℃·h(表1)。
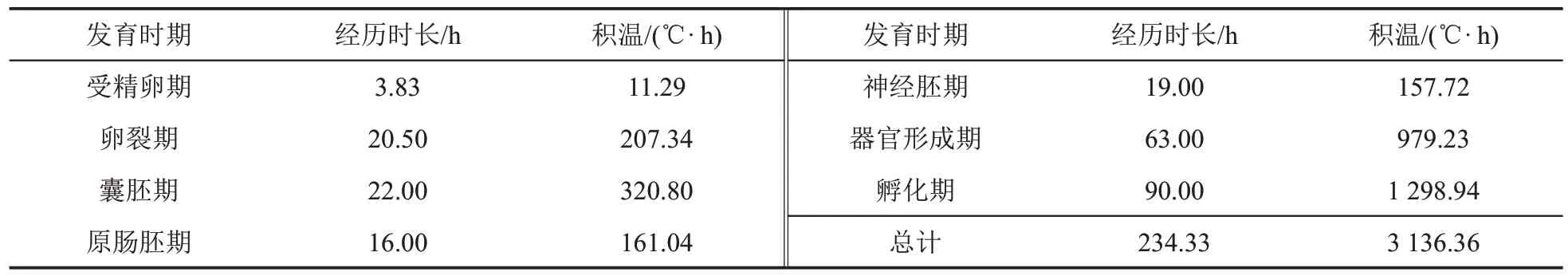
表1 高体雅罗鱼胚胎发育各时期时长和积温Table 1 Durations and accumulative temperatures at different stages of embryonic development of Leuciscus idus
在受精卵期,高体雅罗鱼的卵呈暗黄色,不透明,吸水后发生膨胀,卵受精后,原生质向动物极移动(图1a)。卵受精50 min 后,由于原生质的移动、聚集,动物极已经出现与卵黄囊有明显分层的隆起,即胚盘隆起(图1b)。

图1 高体雅罗鱼胚胎发育各时期的形态的照片(a:受精卵;b:胚盘隆起;c:2细胞期;d:4细胞期;e:8细胞期;f:16细胞期;g:32细胞期;h:64细胞期;i:128细胞期;j:桑葚胚;k:高囊胚期;l:低囊胚期;m:原肠早期;n:原肠中期;o:原肠晚期;p:神经胚期;q:胚孔封闭期;r:眼基出现期;s:眼囊出现期;t:耳囊出现期;u:尾芽出现期;v:尾鳍出现期;w:晶体出现期;x:耳石期;y:将孵期;z:孵化期)Fig.1 Photographs of the morphology of different stages of embryonic development of Leuciscus idus(a:fertilized eggs;b:blastoderm stage;c:2-cell stage;d:4-cell stage;e:8-cell stage;f:16-cell stage;g:32-cell stage;h:64-cell stage;i:128-cell stage;j:morula phase;k:high blastuta stage;l:Low blastuta stage;m:early gastrula stage;n:mid-gastrula stage;o:late gastrula stage;p:neurula stage;q:blastopore closing stage;r:eye base appears period;s:visual sac formation stage;t:Otocyst stage;u:fail bud apperance;v:rudiment of tail fin;w:crystal stage of eyes;x:appearance of statolith;y:Hatching stage;z:newly hatched larvae)
在卵裂期,高体雅罗鱼卵进行盘状分裂,受精后3 h 50 min,在隆起的胚盘中央出现明显裂痕,胚盘分裂为两个大小基本相等的分裂球,自此进入2 细胞期(图1c)。卵受精4 h 50 min 后,胚盘隆起不再明显,此时出现了一条与第一条裂痕垂直的裂痕,将胚盘分为了4份,4个分裂球基本等大,进入4 细胞期(图1d)。卵受精5 h 50 min 后,在两条裂痕的基础上出现了两条新的裂痕,平行于第一条,垂直于第二条,将胚盘分为了8个分裂球,中间的4 个分裂球比四周的4 个分裂球略大(图1e)。卵受精6 h 20 min 后,胚盘进一步分裂,胚盘被分为16细胞,细胞形状变小,分为四排排列在一个平面上(图1f)。卵受精8 h 20 min 后,胚盘在原有的基础上被分成了32个细胞,细胞进一步变小,此时细胞仍处于同一平面(图1g)。卵受精10 h 20 min后,胚盘继续分裂,细胞变得更小,而且因为不断地分裂而堆积,此时细胞已经耸立在卵黄囊上方,通过计数,可以发现受精卵进入了64 细胞期(图1h)。卵受精12 h 20 min 后,胚盘进一步分裂,帽状分裂球开始往两边堆积,胚盘比前一个时期略宽,此时细胞之间的界限仍然清楚,进入128 细胞期(图1i)。卵受精16 h 20 min 后,胚盘继续分裂,此时细胞更小、数量更多,而且细胞之间的界限已经出现模糊感,无法计数,形成的分裂球堆积在一起,呈帽状高举在卵黄囊上,达到最高点,而且胚盘和卵黄囊有一条清晰的界线,此时的胚盘称为桑葚胚(图1j)。
在囊胚期,卵受精24 h 20 min后,胚层由高耸的帽状结构逐渐变低、变平,此时胚层细胞之间的界限彻底消失,胚层已经有向下包裹的趋势(图1k);卵受精40 h 20 min后,胚层继续下陷,变的更加扁平,囊胚层的细胞已经向下包裹至1/3 处,此时进入低囊胚期(图1l)。
在原肠胚期,卵受精46 h 20 min后,囊胚层继续下包,由于受到卵黄囊的阻挡,致使在下包的前端形成了一周略厚的胚环,此时已经下包至1/2处,进入原肠早期(图1m);卵受精50 h 20 min 后,囊胚层继续向植物极下包至2/3处,此时由于卵黄囊的阻挡和囊胚层的堆积,形成了一个特殊的结构——胚盾,标志着受精卵进入了原肠中期(图1n);卵受精52 h 20 min 后,胚环下包至3/4 处,由于囊胚层的包裹、挤压,卵黄囊在植物极由未被包裹的卵黄囊形成了卵黄栓,胚环则继续下包封闭,形成胚孔,同时胚盾也进一步延伸、膨大,后续将发育为脑部的重要结构(图1o)。
在神经胚期,受精后62 h 20 min,胚环已下包至4/5 处,在植物极形成一圆形胚孔,此时胚体已经清晰可见,与卵黄囊有明显的颜色差异,界限清晰,并且可以看到胚体两端并不等大,较膨大的一端将发育为头部(图1p);卵受精64 h 20 min后,胚体膨大的一端出现明显凸起,出现了头部的雏形,同时囊胚层下包至100%处,胚孔封闭,标志着受精卵进入胚孔封闭期(图1q)。
在器官形成期,卵受精81 h 20 min后,胚体绕至卵黄囊5/6 处,头部两侧出现对称的肾性突起,为眼的原基,颜色也比头部的颜色略深,这一时期称为眼基出现期(图1r);卵受精86 h 20 min 后,眼基继续发育,已经没有了前一时期凸出,开始下陷,同时形成了椭圆形的眼囊(图1s);卵受精92 h 20 min 后,头部开始分化,头顶向上凸出,与躯体产生了明显层次感,同时在胚体前端、眼囊后缘出现了一个透明空腔,称为耳囊,这一时期称为耳囊出现期(图1t);卵受精98 h 20 min 后,胚体继续发育,此时胚体已环绕至卵黄囊6/7 处,尾部明显凸出,高于卵黄囊,呈圆钝形,但是仍贴合于卵黄囊(图1u);卵受精108 h 20 min 后,眼睛由椭圆形逐渐变为圆形,并开始内陷,尾部继续延伸,已经不再贴合于卵黄囊,呈游离状态(图1v);卵受精126 h 50 min后,胚体绕卵黄囊约一周,头部分化更加明显,尾鳍和胚体腹部几乎一半的胚体已经完全游离,并开始做无规律抽动,但是频率极低,卵黄囊也由之前的圆形转变为近似圆柱形,同时在内陷的眼囊中,开始出现黑色素和晶体,标志着进入了晶体出现期(图1w);卵受精138 h 20 min 后,头部发育完全,在耳囊里面出现了一对明亮的钙状颗粒,尾鳍的抽动频率也略有增加,但是频率仍然很低(图1x)。
在孵化期,卵受精144 h 20 min 后,此时胚体已经绕卵黄囊一周多,甚至可以达到眼部后缘,胚体转动频率增加,扭动幅度加大,等待出膜(图1y);卵受精234 h 20 min后,胚体比前期扭动地更加剧烈,开始破膜,破膜的仔鱼大多数为头部先出,也有的尾部先出,刚破膜的仔鱼的卵黄囊呈长条状附着在仔鱼的胸腹部(图1z)。
根据高体雅罗鱼胚胎发育过程的不同形态特征,可以将其胚胎发育过程进一步细分为26 个时期,其各项指标值详见表2。
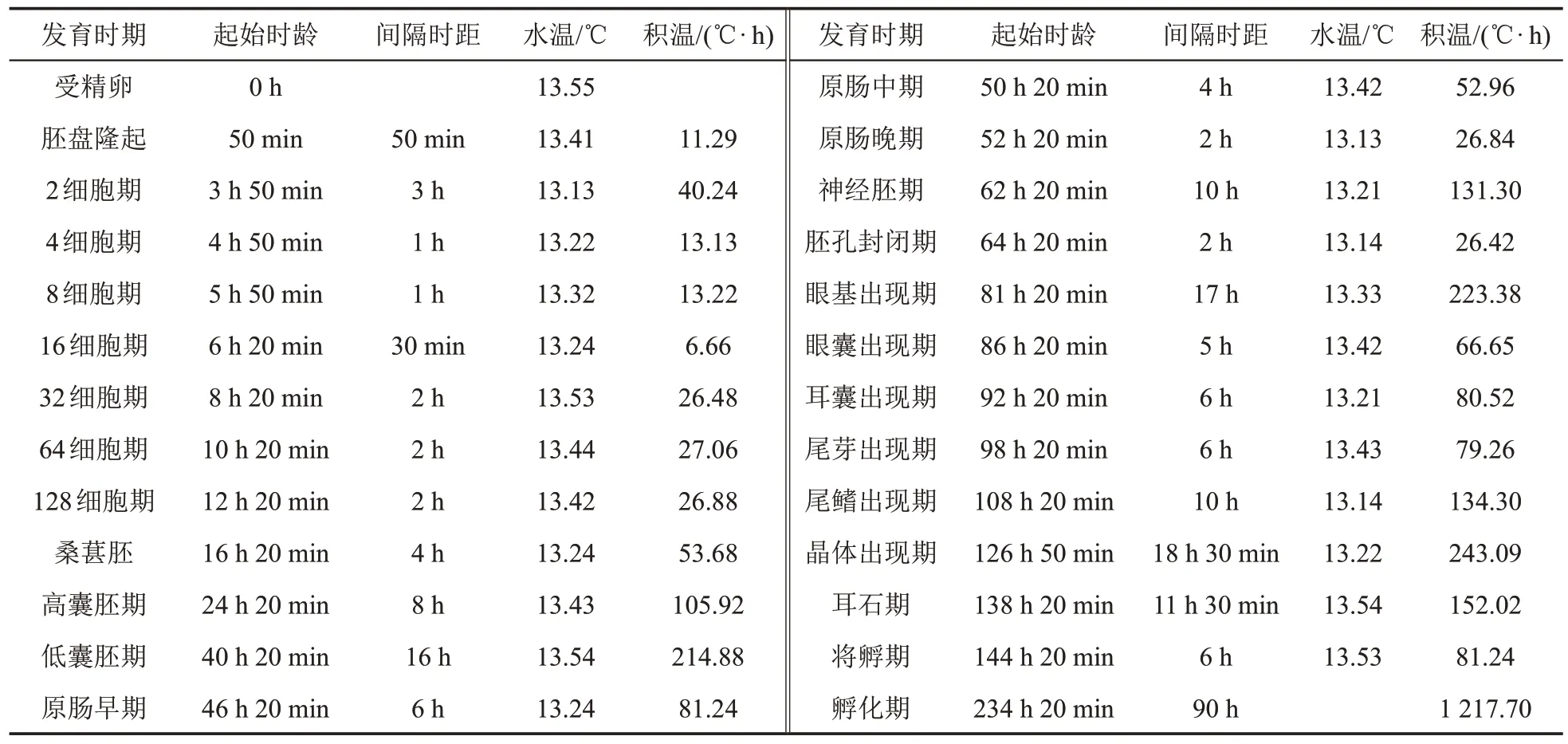
表2 高体雅罗鱼胚胎发育过程中的各项指标值Table 2 The value of each index in the process of embryonic development of Leuciscus idus
2.2 仔鱼发育的过程
出膜0 d 的仔鱼的卵黄囊饱满,鳃盖尚未形成,通过解剖镜观察不到肠道,泄殖腔处呈现钝形,处于封闭状态,鱼鳔未出现,但是在卵黄囊左上方有一条暗黑色的条带,为鱼鳔原基,在心脏位置和泄殖腔左上方可以看到有血液,但是在脊柱下方不易观察到血管(图2a、图2b和图2c)。
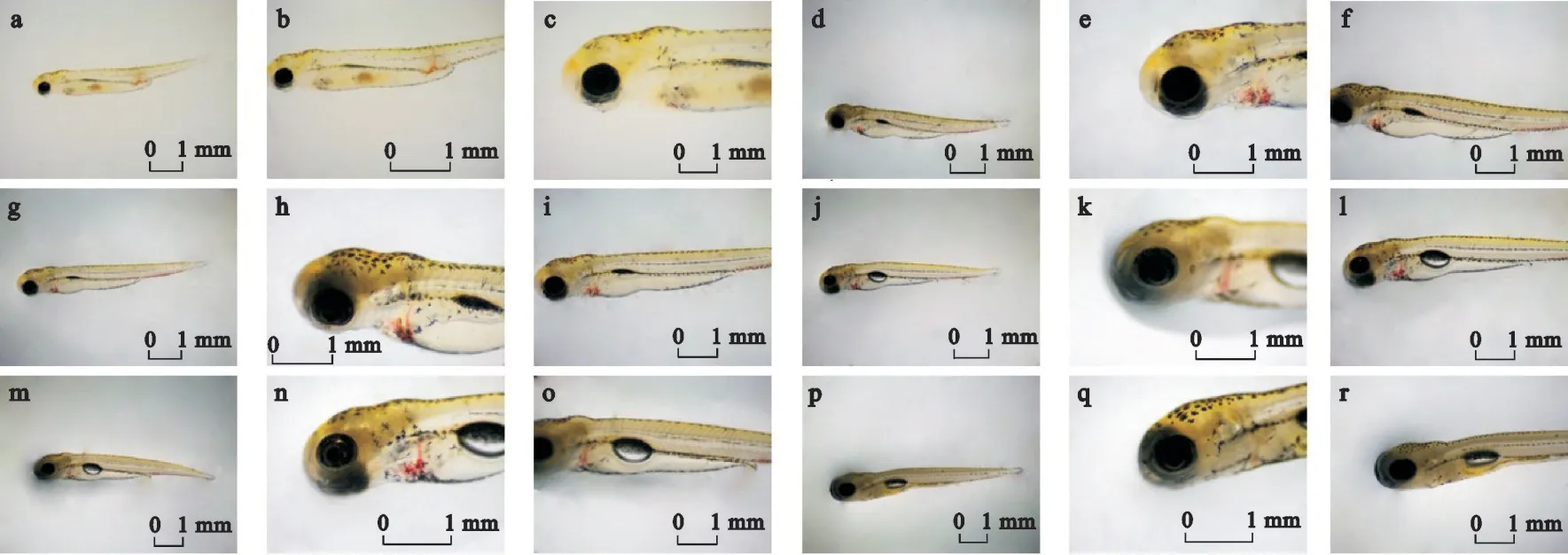
图2 高体雅罗鱼仔鱼出膜后5 d内发育状况的照片(a:出膜后0 d全长;b:出膜后0 d眼径;c:出膜后0 d卵黄囊;d:出膜后1 d全长;e:出膜后1 d眼径;f:出膜后1 d卵黄囊;g:出膜后2 d全长;h:出膜后2 d眼径;i:出膜后3 d卵黄囊;j:出膜后3 d全长;k:出膜后3 d眼径;l:出膜后3 d卵黄囊;m:出膜后4 d全长;n:出膜后4 d眼径;o:出膜后4 d卵黄囊;p:出膜后5 d全长;q:出膜后5 d眼径;r:出膜后5 d卵黄囊)Fig.2 Photographs of development status of larvae of Leuciscus idus within 5 days after filming(a:total length 0 day after filming;b:eye diameter 0 day after filming;c:yolk sac 0 day after emergence;d:total length 1 day after filming;e:eye diameter 1 day after filming;f:yolk sac 1day after emergence;g:total length 2 day after filming;h:eye diameter 2 day after filming;i:yolk sac 2 day after emergence;j Total length 3 day after filming;k:Eye diameter 3 day after filming;l:Yolk sac 3 day after emergence;m:Total length 4 day after filming;n:Eye diameter 4 day after filming;o:Yolk sac 4 day after emergence;p:Total length 5 day after filming;q:Eye diameter 5 day after filming;r:Yolk sac 5 day after emergence)
出膜1 d 的仔鱼的卵黄囊前部和中部因为吸收出现凹陷,鳃盖出现层次感,头部上方出现星状黑色素斑点,一直延伸背部,鱼鳔原基颜色进一步加深,并从条带状变为扁椭圆形,可以清楚地看到肠道,此时仔鱼仍然在吸收卵黄囊,并未开口摄食,肠道为透明色,并且因为鱼鳔未完全形成,未对肠道产生压迫,此时肠道为一条直线,心脏处血液明显,可以看到心脏的大致形态,同时在脊柱下方已经出现一条清晰的血管,也可以依稀看到另外一条血管的走向(图2d、图2e和图2f)。
出膜2 d的仔鱼的卵黄囊的凹陷更加明显,头部上方星状斑点颜色加深,鳃盖层次感更加明显,鱼鳔进一步增长,黑色阴影下面已经出现鱼鳔轮廓,而且肠道因为鱼鳔的挤压已经出现轻微弯曲,可以明显观察到肛突,随着仔鱼的发育,两条血管都可以被看见,基本可以看清血液循环的路径(图2g和图2h)。
出膜3 d 的仔鱼的卵黄囊的后半部分因为吸收已经与凹陷持平,鳃盖进一步生长发育,并且已经出现横向的纹路,此时鱼鳔形成,呈现上黑下白的颜色,肠道因为鱼鳔的挤压,弯曲为凹形,而且仍然透明,并且肛突更加明显,鱼鳔上面的血管也因为挤压而微微弯曲、变形,随着时间的推移,心脏处的血液颜色更加鲜艳、明显(图2i、图2j、图2k和图2l)。
出膜4 d 的仔鱼的卵黄囊的前半部分已经与后半部分在同一水平上,鳃盖已经发育完全,但是其开合不太明显,鱼鳔比第4天时更加饱满,肠道的前2/3 部分仍然呈现透明色,但是后1/3 部分里面已经出现黑色粪便,血管也因为鱼体颜色的加深而观察不到(图2m、图2n和图2o)。
出膜5 d的仔鱼的鳃盖能明显开合,卵黄囊已经被吸收干净,在仔鱼的肠道中,已经充满了黑色粪便,肠道不再透明(图2p、图2q和图2r)。
高体雅罗鱼仔鱼的卵黄囊体积(V)与仔鱼出膜后的天数(x)的拟合方程式为V=0.0013x4-0.026x3+0.1977x2-0.6858x+1.0357(n=7,R2=0.993)。
高体雅罗鱼仔鱼的全长(TL)与仔鱼出膜后的天数(x)的拟合方程式为TL=-0.0031x4+0.0461x3-0.2112x2+0.4539x+6.4317(n=6,R2=0.995)。
高体雅罗鱼仔鱼的眼径(EL)与仔鱼出膜后的天数(x)的拟合方程式为EL=-0.0004x4+0.0053x3-0.0212x2+0.0459x+0.46(n=6,R2=0.989)。
3 讨 论
高体雅罗鱼成熟的受精卵呈暗黄色,属黏性卵,其比同水域中的白斑狗鱼、鲤(Cyprinus carpio)和鲫(Carassius auratus)的卵的黏性都大,而且其受精卵的卵黄大、胚盘较小、卵膜较厚、透光性差,透过卵膜不容易观察到卵的内部结构,因此需要剥膜观察。另外,高体雅罗鱼的受精卵遇水后便发生膨胀,卵周隙增大。鱼类受精卵的卵周隙增大可以为胚胎建立一个更好的生存环境,当鱼卵受到来自外界的冲击时,能更好地保护胚体,提高受精卵的成活率[19-20]。
在本研究中,将高体雅罗鱼的胚胎发育过程划分为受精卵期、卵裂期、囊胚期、原肠期、神经胚期、器官形成期和出膜期共7 个时期,并将7 个时期进一步细分为26 个时期;高体雅罗鱼的卵裂方式和胚胎发育时序与大多数硬骨鱼类相似,大致遵循“卵裂—胚体形成—器官分化—孵出”的顺序[21]。鲤科鱼类物种间的胚胎各发育时期的划分存在明显差异。例如,拉萨裂腹鱼(Schizathorax waltoni)[22]的胚胎发育过程被划分为8个时期(进一步细分为33 个时期)。细鳞裂腹鱼(Schizothorax chongi)[23]的胚胎发育过程被划分为6个时期(进一步细分为25 个时期)。与高体雅罗鱼同在额尔齐斯河中生存的白斑狗鱼[16]的胚胎发育过程被划分为6个时期(进一步细分为33个时期);梭鲈[17]的胚胎发育过程被划分为6 个时期(进一步细分为24个时期),而河鲈[18]的胚胎发育过程仅被划分为16个时期,并未对发育时期进行详细的划分。由此可见,鱼类的胚胎发育并不是仅受单一因素的影响,而是其自身的遗传特性和周围环境共同作用的结果。因此,在亲缘关系较近的同科鱼类之间和生活在同一水环境中的鱼类之间的胚胎发育都存在较大差异。
处于胚胎发育前期的鱼类对周围环境非常敏感[24]。高体雅罗鱼的受精卵有很大的黏性,在高体雅罗鱼的胚胎发育过程中,如果水中的杂质和泥沙过多,就会黏附在受精卵上,阻碍其正常的新陈代谢,卵粒之间也会因粘连而极易导致缺氧、发霉,从而导致受精卵死亡,影响孵化率。为了减少受精卵的损失,一般会将原肠中期之后的受精卵放入洗卵机,通过冲洗,将霉卵、水中杂质和有害物质去除,从而提高孵化率。可以看出,发育至原肠中期之后的高体雅罗鱼的受精卵处于相对稳定状态,对于环境变化的敏感度降低,抗逆能力大大增强。
水温是影响鱼类胚胎发育的重要环境因素[25]。水温过高或者过低都会影响鱼类胚胎的正常发育。水温过高容易使鱼类胚胎畸形,水温过低则会增加鱼类胚胎发育的时间。在合适的水温范围内,鱼类胚胎发育的速率与水温正相关[9]。适当地提高鱼类胚胎的孵化温度,可以提高鱼类生产的效率,减少因疾病、感染等因素造成的胚胎死亡数量。
由表3可知,高体雅罗鱼受精卵孵化所需时间比拟赤梢鱼(Pseudaspius leptocephalus)[26]、拉萨裂腹鱼、细鳞裂腹鱼和白斑狗鱼的都长,但是比川陕哲罗鲑和秦岭细鳞鲑的短,由此推测,鱼类胚胎孵化时间的长短是由物种的差异和孵化温度决定的;除了秦岭细鳞鲑和川陕哲罗鲑以外,高体雅罗鱼胚胎孵化所需的总积温大于拟赤梢鱼、拉萨裂腹鱼、细鳞裂腹鱼和白斑狗鱼,但是,高体雅罗鱼的初孵仔鱼全长仅大于拟赤梢鱼而小于其他5 种物种,表明初孵仔鱼身体的长短与受精卵孵化所需积温的关系并不密切。贝加尔雅罗鱼(Leuciscus baicalensis)受精卵孵化所需积温约为10 545 ℃·h,其与高体雅罗鱼都为雅罗鱼属物种,二者有高度的亲缘关系,但是贝加尔雅罗鱼受精卵孵化所需的积温却是高体雅罗鱼的数倍[27],而成年的高体雅罗鱼个体的全长则远大于贝加尔雅罗鱼。由此可见,鱼类受精卵孵化所需积温与鱼类个体的大小无必然关系,但是鱼类体长与积温之间的潜在关系有待进一步研究。在与其他鱼类受精卵孵化温度的对比中发现,高体雅罗鱼受精卵孵化的温度仅高于秦岭细鳞鲑、川陕哲罗鲑和白斑狗鱼,而秦岭细鳞鲑和川陕哲罗鲑为典型的冷水性鱼类,白斑狗鱼也是新疆当地重要的冷水性鱼类,这进一步印证了高体雅罗鱼是冷水性鱼类以及其喜冷水的特性。
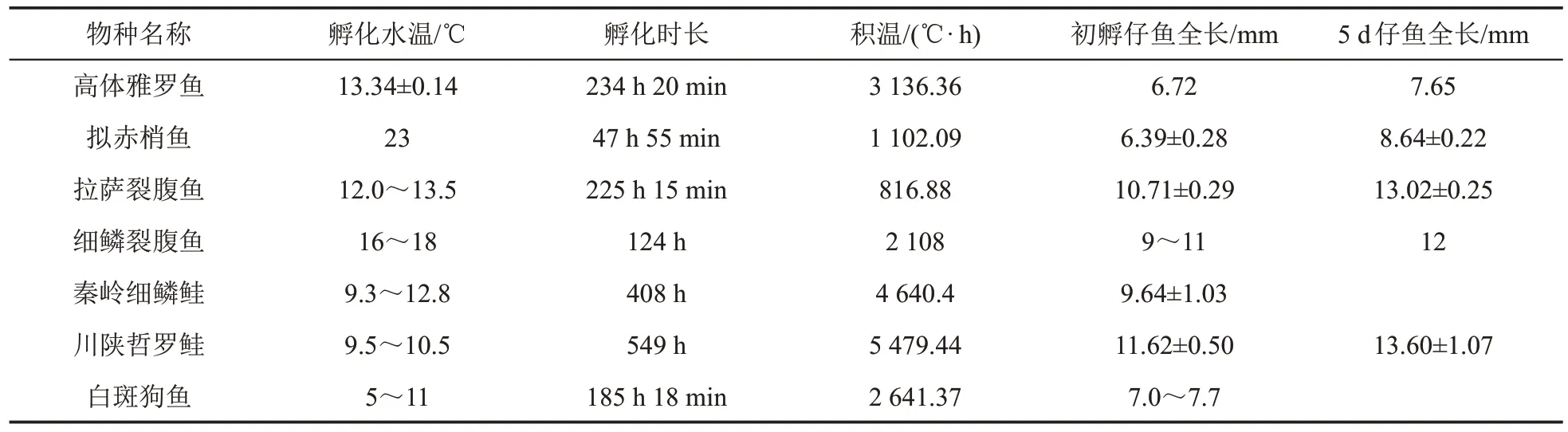
表3 高体雅罗鱼与其他鱼类物种受精卵孵化指标的比较Table 3 Comparison of hatching indexes of fertilized eggs of Leuciscus idus with other fish species
一般将鱼类的早期生活史划分为胚胎、仔鱼和稚鱼3 个阶段[28]。仔鱼阶段是指从鱼类的孵出期开始一直延续到鳞片开始出现。仔鱼阶段又可以分为早期仔鱼阶段和晚期仔鱼阶段。早期仔鱼阶段是指仔鱼孵化出膜至其卵黄囊即将被完全吸收阶段;晚期仔鱼阶段是指仔鱼的卵黄囊被完全吸收至鳞片开始出现阶段[16]。本研究的重点是仔鱼孵化出膜至其卵黄囊吸收完毕阶段。
与其他鲤科物种相比,初孵的高体雅罗仔鱼全长略长于鲤、青鱼(Mylopharyngodon piceus)、拟赤梢鱼,而短于拉萨裂腹鱼、细鳞裂腹鱼和略短于鳙(Aristichthys nobilis)[29],这说明高体雅罗鱼初孵仔鱼全长处于中等水平。高体雅罗鱼胚后发育的主要特点包括出膜后24 h 鳃盖雏形出现、72 h 鳃盖便发育完全、可以清楚地观察到鳃盖上的条纹;高体雅罗鱼初孵仔鱼发育5 d 后,其全长仅增加了0.93 mm,小于拉萨裂腹鱼、细鳞裂腹鱼在出膜后5 d 生长的长度;在出膜后第4 天,高体雅罗鱼仔鱼肠道中便出现了黑色食糜,但是卵黄囊直至第5天才被吸收殆尽,证明仔鱼在前3 d进行内源性的卵黄囊吸收,第4天已经开口摄食,开始了内源性和外源性营养混合吸收的方式,直至第5 天完全转变为外源性营养吸收。虽然高体雅罗生长得较慢,但是,其食物营养较早地转变为外源性营养,很快地长出鳃盖,其吻部也很快地前突成吻,能更快地适应环境,以提高自身的成活率。
4 结 论
在水温为13.34 ℃条件下,高体雅罗鱼胚胎由受精卵发育到鱼苗出膜经历了受精卵期、卵裂期、囊胚期、原肠胚期、神经胚期、器官形成期和孵化期,历时234 h 20 min。
高体雅罗鱼的仔鱼能够通过食物来源的快速转变和器官的快速发育等生理变化,增强自身对环境的适应能力,提高自身的成活率。

