结直肠幼年性息肉临床诊治现状及研究进展
李 艳,冯 洁,杨丽虹,黄晓俊,2
1兰州大学第二医院消化内科,兰州 730030 2甘肃省消化内镜质量控制中心 甘肃省医学工程研发中心,兰州 730030
结直肠息肉是指高于周围结直肠黏膜并凸向肠腔的局部隆起性病变,在组织学上可分为普通型腺瘤、锯齿状病变、炎性息肉和错构瘤性息肉[1]。错构瘤性息肉由正常存在于特定区域的细胞和组织的异常混合物组成,其结构明显扭曲,被认为是发育错误[2]。幼年性息肉(juvenile polyp,JP)属于错构瘤性息肉,是儿童最常见的结直肠息肉病理类型,在成人中发病较少。近年来随着电子结肠镜检查技术的广泛应用,结直肠JP的检出率有逐渐上升趋势[3]。通常认为JP为良性、非肿瘤性病变,预后良好,但也可引起下消化道大出血、贫血、肠套叠、肠梗阻等并发症,且国内外文献中均有JP转化为腺瘤甚至癌变的报道,因此需要提高对该疾病的认识,实现早期诊治。本文就JP的临床诊治现状及研究进展作一综述。
定义及流行病学特征
JP的概念最早于1957年提出,用来描述一种非腺瘤性息肉。JP内可见腺体及间质成分的增生,通常伴有明显的血管分布和不同数量的炎症细胞浸润,部分腺体呈囊状扩张、黏液潴留之特征,又称为潴留性息肉[4]。儿童JP的发病率为1%~2%,占结直肠息肉的80%~90%,发病高峰为2~5岁,男性为主。术语JP指一种特殊的组织学类型,而并非患者的发病年龄,JP只是少见于成年人群,在所有检出的大肠息肉中占比不足1%[3]。一项成人结直肠JP的研究显示,患者平均发病年龄为43.2岁,男性和女性的比例为1.6∶1[5]。
病因和发病机制
JP的病因和发病机制尚不完全清楚,目前有以下几种理论:(1)错构瘤学说:错构瘤性息肉由解剖部位原有上皮和间叶组织过生长形成,有学者认为JP源于消化道黏膜固有层腺体和结缔组织成分的错构瘤畸形,是黏膜结构重排的结果,目前这一假说被广泛接受[1,6]。(2)炎性起源学说:在慢性炎症及粪块等因素长期刺激、机械性摩擦损伤肠黏膜作用下,黏膜充血水肿、糜烂,肉芽组织增生,封闭了黏液腺管开口,阻塞的腺体扩张,形成囊状结构,逐渐增大成息肉[7];有研究观察到JP组织内有大量中性粒细胞和嗜酸性粒细胞浸润,且促炎症细胞因子白细胞介素-1β和髓系细胞触发受体1的mRNA表达升高,表明JP处于炎症状态[8]。(3)过敏:陈涣等[9]检测64例JP患者食物过敏原血清特异性IgE的阳性率为57.81%,显著高于对照组,且在其中37例息肉的间质内发现嗜酸性粒细胞明显增多,而对照组肠黏膜未发现嗜酸性粒细胞或仅有少量浸润,认为过敏食物对肠道的刺激与JP的形成相关。(4)病毒感染:Wang等[7]在76例患者的JP中发现人类腺病毒DNA检出率为43.4%,但仅有15.2%的标本检出腺病毒mRNA,表明人类腺病毒在JP组织中大多处于潜伏感染状态;张莉娜等[10]报告JC病毒DNA片段在35例儿童JP中的检出率为31.4%,病毒T抗原蛋白的阳性表达率为22.9%,较正常结直肠黏膜组明显升高,推测JC病毒感染可能是JP发生的危险因素之一。(5)分子生物学异常:Iwamoto等[11]的实验显示β-连环蛋白在JP组织中普遍表达,主要定位于息肉腺上皮细胞质及细胞核内,而正常结肠黏膜内β-连环蛋白阳性染色仅局限于细胞膜;金美芳等[12]亦发现JP内β-连环蛋白的表达水平明显上调,且在细胞内的分布发生改变;当β-连环蛋白在细胞质内过度积聚后,即转移到细胞核中,作为T细胞因子依赖的基因转录激动剂,激活一系列促增殖靶基因的转录,使肠干细胞过度增殖、分化,扰乱肠上皮细胞的增殖和凋亡平衡,导致息肉形成[13];β-连环蛋白在细胞核内积聚可能是JP发展的最早步骤之一,但β-连环蛋白导致相关细胞信号转导通路异常的机制还需进一步研究。
临床表现
结直肠JP的临床表现是非特异性的,常见的症状是无痛、间歇性便血,多为成形大便表面带少量鲜红色血丝,不与粪便相混,也可表现为便后滴血,少数便血严重者还会发生贫血,或因长期慢性失血而出现小细胞低色素性贫血,下消化道大出血导致低血容量性休克少见[14]。患者也可表现为腹痛、腹泻、黏液便等不适,较大的息肉可发生肠套叠、肠梗阻等急腹症,但在成人中罕见[15]。部分成年患者没有临床症状,仅在结肠镜检查中才发现JP[5]。部分患儿排便时有息肉脱出肛门外,多见于低位、长蒂息肉,偶有息肉自然离断脱落,可随粪便排出,一般这种情况便血也会逐渐停止,患者大都可自愈。JP通常对儿童的生长发育影响不大,但若患儿息肉数量多、病程长、出血量多、症状重,则可能继发营养不良,甚至生长发育迟缓。
诊断方法
直肠指检直肠指检在JP的初步诊断和鉴别诊断中具有不可忽视的作用,其操作简单、易于实施,对距离肛门7~8 cm以内低位直肠息肉的检出率较高,然而对于高位息肉、小息肉、平坦型息肉或配合欠佳的患者,则难以达到满意的诊断效果。
非侵入性生物标志物
粪便钙卫蛋白:粪便钙卫蛋白(fecal calprotectin,FC)是一种相对分子质量为36 000的钙锌结合蛋白,属于S100蛋白家族(S100 A8/A9),在中性粒细胞和单核细胞中含量丰富[16]。肠道炎症期间中性粒细胞的激活、迁移和脱颗粒导致钙卫蛋白的释放,通过粪便排出,因此FC被视为肠道炎症的有效标志物。近年来有学者提出FC可用于结直肠JP的筛查。Zysset等[8]发现JP组织内聚集大量中性粒细胞和嗜酸性粒细胞,且钙卫蛋白亚基S100 A8/A9的mRNA表达明显增高。Olafsdottir等[17]在对266名儿童的回顾性分析中发现,JP患者的FC水平(中位数844 mg/kg)与活动性炎症性肠病患者无显著差异(中位数962 mg/kg),但明显高于结肠镜检查正常的儿童(中位数130 mg/kg),在息肉切除术后3个月,75%的JP患儿FC恢复正常(FC<50 mg/kg)。其他研究也得出了类似的结论[18-19],且Das等[19]研究还发现多发JP患者的FC值显著高于单发息肉者。FC的测量具备无创、简单、快速的优点,在诊断JP上有相应优势。FC是胃肠道炎症性疾病的敏感标志物,但特异性较低,在坏死性小肠结肠炎、结直肠癌等情况下也升高,且受到饮食、药物等影响,因此FC异常并不能直接诊断JP[16]。
尿基质金属蛋白酶:JP是高度血管化的组织,黏膜微循环增加。基质金属蛋白酶(matrix metalloproteinases,MMP)是一类锌依赖酶家族,可降解细胞外基质中的各种蛋白成分,在血管生成、组织修复等过程中发挥重要作用。Manfredi等[20]发现JP患者尿液中MMP-2、MMP-9和高分子量MMP阳性表达百分比明显高于正常对照组;免疫组织化学分析显示,息肉上皮和固有层中MMP-2、MMP-9等的表达显著增加,且固有层微血管密度增高,推测JP中MMP的表达上调是由于这种息肉的富血管性质,以及伴随息肉生长的细胞外基质的重构。MMP存在于JP患者的组织和尿液中,可能与JP的形成呈正相关,尿MMP有望成为JP生长的非侵入性标志物,但MMP与大多数炎症、自身免疫和病原体介导的疾病也有关,且参与癌症侵袭和转移等过程,因此其诊断JP的特异性不高,还需进一步研究MMP在JP发病过程中的作用[21]。
影像学检查各种影像学技术如X线气钡双重对比造影、腹部CT、超声检查等已被用于评估结直肠息肉。与单纯钡剂造影相比,气钡双重对比造影对于肠壁细微病变显示更为清晰,可以发现较小的息肉,从而提高诊断率,但检查前肠道清洁准备要求高,操作相对复杂、耗时等会限制临床应用[22]。JP的CT平扫图像显示为肠管内结节样软组织密度影,增强后呈辐轮状中度强化,这种特征性表现可作为与其他肠道病变进行鉴别的重要依据[23]。CT检查具有安全、快捷等优点,但相对会有更多的辐射暴露。
经腹超声检查JP声像图特征表现为肠腔内圆形或椭圆形低回声肿块,内可测及散在大小不等的无回声区,多有蒂样结构与肠壁相连。彩色多普勒血流显像易见由肠壁向肿块延伸的条束状蒂部血流信号,进入肿块后自中心向四周放射,具有血流信号丰富的特点[24]。Qu等[25]比较了行开塞露灌肠的肠道准备前后超声检查对儿童结直肠息肉的诊断率,发现肠道准备后超声检出息肉的比例显著增加,其灵敏性和特异性分别为94.79%和100%。超声检查简便、易行、经济,可作为JP患者的常规检查方法,然而一些因素会影响超声诊断结果,如肠道内容物和气体的干扰、病变位于盆腔深处难以探查、操作者经验欠缺等,此外超声在准确识别多发性息肉的数量和位置方面也有局限性。
电子结肠镜结肠镜检查可以清楚地观察到息肉的位置、大小、形态、数量、表面情况等,还可进行组织活检以明确息肉的病理性质,是诊断JP最直接、准确的方法。JP发病以直肠、乙状结肠居多,但有1/3位于结肠脾曲近端,且多发性息肉可分布于结直肠任何部位,因此所有疑似JP或反复下消化道出血的患者都应接受完整的结肠镜检查,以免漏诊[26]。随着结肠镜设备的改进,可通过染色内镜、窄带成像技术、放大内镜、细胞内镜等提高大肠息肉的检出率及对息肉性质的判断,但在儿科领域尚未广泛开展[27]。结肠镜属于侵入性检查,由于儿童对肠道清洁的依从性和耐受性较差、肠腔小且肠壁较成人薄嫩等,儿童肠镜操作难度增加,需要更高水平的内镜技术,无法配合检查的患儿则需全身麻醉或深度镇静。目前结肠镜在儿童中应用的安全性和有效性已得到证实,一项对多个儿科中心7792次结肠镜检查数据的回顾分析显示,儿童肠镜检查的并发症发生率与成人相当[28-29]。
内镜表现及病理特征
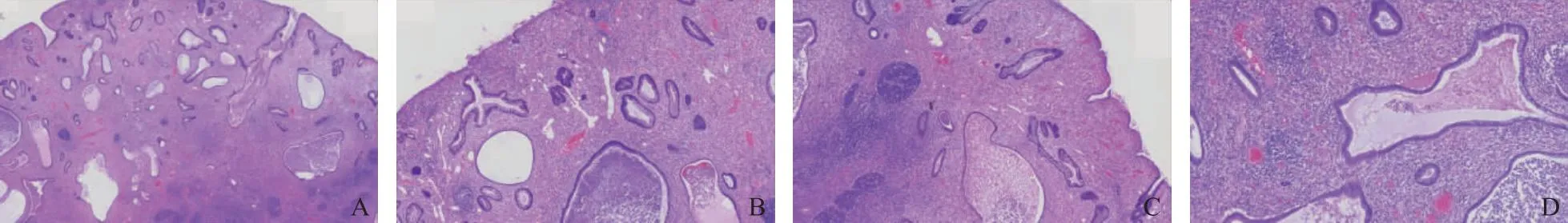
内镜下JP主要位于直肠、乙状结肠,大多数为孤立性息肉,亦有多发者,外观呈球形、卵圆形,少有分叶状,直径从0.5~5 cm不等,以直径1~2 cm最常见,根据内镜下肠息肉的巴黎形态学分型,JP多为有蒂型(0-Ip型)[5]。息肉表面光滑或颗粒状,呈充血发红或暗红色,部分表面糜烂、附着黏稠白苔。结肠镜检查时,在JP基底部、蒂部或周围肠黏膜可观察到白色、淡黄色颗粒状改变,称为鸡皮样黏膜,在结肠远端的大息肉附近更常见,而远离息肉的肠黏膜则没有发现(图1)[30]。

A.有蒂息肉;B.亚蒂息肉;C.无蒂息肉;D.箭头所指为鸡皮样黏膜
A.×40;B.×100;C.×100;D.×200
JP的病理特点为切面可见大小不一的囊状间隙,其内充满清亮液体或灰黄色脓性分泌物,显微镜下息肉表面上皮坏死脱落,有肉芽组织帽覆盖,固有层黏液腺排列疏密不均,腺体呈不同程度的囊性扩张,腔内黏液潴留,腺上皮分化成熟无异型性,纤维间质疏松水肿、血管扩张充血,伴较多中性粒细胞、嗜酸性粒细胞、淋巴细胞、浆细胞等炎症细胞浸润,其中也含有极少量平滑肌纤维(图2)[1]。组织学上,鸡皮样黏膜固有层可见充满脂质的泡沫状巨噬细胞簇,免疫染色示细胞复制标志物Ki-67和恶性转化标志物p53表达阴性,因而这种内镜下表现被认为是由息肉的机械牵拉、摩擦引起的局部黏膜损伤及炎性反应,而不是癌前病变[5,30]。
诊 断
JP的诊断需结合患者的病史、临床症状、实验室及影像学检查、内镜表现、病理特点等,其中结肠镜联合病理学是诊断的金标准。当结直肠内有多个JP时,应警惕JP病综合征(juvenile polyposis syndrome,JPS)的存在。JPS是一种罕见的常染色体显性遗传性疾病,发病率介于1/160 000~1/100 000,其特征是胃肠道多发幼年性错构瘤性息肉,数量可达数百枚,大部分位于结直肠,胃及小肠少见[31]。JPS患者发病年龄差异较大,中位诊断年龄为18.5岁,除了便血、腹泻、腹痛、息肉脱垂、蛋白丢失性肠病等消化道症状外,还可合并脑积水、唇腭裂、先天性心脏病、隐睾等发育异常[26]。在没有符合Cowden综合征或Bannayan-Riley-Ruvalcaba综合征肠外表现的情况下,具备以下标准之一即可诊断JPS:(1)结直肠有5个及以上的JP;(2)除结直肠外的胃肠道发现任意数量的JP;(3)任意数量的JP并有1个或多个患有JPS的一级亲属[2]。60%的JPS患者有SMAD4或BMPR1A基因的致病性胚系突变,满足临床诊断标准的个体应接受基因检测和遗传咨询。JPS患者发生胃肠道恶性肿瘤的终生风险为11%~55%,因此区分多发性JP与JPS至关重要。
治 疗
结直肠JP的治疗原则是在安全可行的情况下早期切除所有病灶,以减少息肉导致的相关并发症,如肠出血、肠套叠等,并通过病理检查评估证实其为JP。对继发严重贫血的患者,应辅以输血、改善营养状况等对症处理。内镜下圈套器高频电凝电切术是治疗JP最常用的方法之一,适用于各种大小的有蒂息肉,切除前应充分暴露蒂部,避免接触肠壁,单独切割,特别是血供丰富的JP,会引起息肉切除术后出血,可采用凝切混合,边凝边切,以凝为主,使组织脱水干燥,中心血管收缩凝固,切割息肉时可减少出血风险,但应防止过度电凝,导致组织深度热损伤、穿孔或电凝综合征[32]。对于粗蒂或大型息肉(直径≥2 cm),圈套切除前可应用金属止血夹或尼龙绳结扎阻断息肉蒂部滋养血供,提高治疗安全性。
近年来,研究发现冷圈套息肉切除术具有很高的完全切除率、足够的组织学取样,避免了电热烧灼相关不良事件,并发症少见,而且比热圈套息肉切除的手术时间更短、术后延迟出血发生率更低,因此对于微小息肉(直径≤5 mm)和直径6~9 mm的无蒂息肉,指南推荐首选冷圈套切除术,而不建议使用冷/热活检钳法[33-34]。内镜下黏膜切除术是热圈套息肉切除联合黏膜下注射的技术,适用于直径10~20 mm的宽基底、无蒂或亚蒂息肉,可增加病变的隆起高度,减少电切时热量传导及肠壁全层损伤。对直径>20mm广基底息肉且需一次性整块切除的病变,可选择内镜黏膜下层剥离术,但目前在JP临床治疗中的相关报道较少。
癌变风险
通常认为JP是一种肠道良性错构瘤性病变,但国内外仍有研究资料显示JP会出现不典型增生、腺瘤样改变甚至癌变。Gupta等[35]报道了1例儿童乙状结肠JP内伴有腺瘤样改变和原位腺癌。Ibrahimi等[36]发现190例JP患儿中23例有腺瘤病灶,腺瘤样变在单发、多发JP中分别占12.3%和11.5%。Teoh等[37]在1例18岁患者的直肠肛管交界处发现巨大的带蒂息肉状肿块,病理证实为JP伴高度不典型增生。Kim等[6]在1例成人乙状结肠JP中观察到局限于黏膜层的印戒细胞癌。Vanoli[38]等也报道了在成年患者横结肠JP内发现中分化腺癌灶,但未见血管侵犯。Dong等[5]对成人散发性JP患者的研究报告了107枚息肉有6.5%的低度上皮内瘤变率和0.9%的癌变率,发现1例高分化腺癌。这些数据表明,无论儿童还是成年患者,孤立或散发的JP均有极低的恶性潜能,但目前JP癌变的机制尚不清楚,有研究推测腺瘤样病灶是在JP局部异型增生基础上生成的,JP癌变过程与JPS相似,即错构瘤-腺瘤-癌的模式[39]。
复发与随访
结直肠JP切除或自然脱落后复发相对少见。Ibrahimi等[36]表示JP的复发与息肉数目呈显著正相关,52例多发性息肉患者的复发率为19.2%,而孤立性息肉均无复发。Fox等[4]报告18例孤立性JP患者在息肉切除后平均间隔15个月复查结肠镜显示有3例复发(16.7%),而其中1例患者5年后又检出5枚息肉,这一结果对仅根据息肉数量诊断JPS的可靠性提出了质疑,尤其在未发现胚系基因突变或家族史阴性的患者中。
关于JP患者的随访尚无统一标准。Fox等[4]主张对于单个或多发JP的患者,在息肉切除后1~3年内复查结肠镜,并根据息肉数量和是否存在异型增生来调整随访间期。欧洲指南建议单个JP切除后,若患者没有异常的组织学病变和胃肠道息肉病、癌症等家族史,出院后一般不需要随访和结肠镜复查,但推荐等级弱,证据质量低;当首次结肠镜检查发现2~4个JP时,因不确定是否会发展为JPS,建议在息肉切除5年后复查结肠镜,若患者再次出现便血等症状,则及时行结肠镜检查[26]。
展 望
目前结肠镜检查是诊断JP的最佳方法,且可即时行息肉切除。尽管有研究表明一些生物标志物如FC、尿MPP等在JP患者的水平升高,但目前研究队列的规模太小,这些生物标志物的诊断灵敏度、特异度和预测性能未得到很好的证实,需要更大型的前瞻性研究来评估这些生物标志物是否可作为JP的筛查技术,以及在监测息肉复发、随访方面的应用价值。此外,现有的文献资料中关于JP复发、癌变风险的数据仍然有限,且JP恶变的机制及诱发肿瘤形成的危险因素亦不明确,有待分子、细胞及组织学等方面的深入探索,更需长时间、大规模、多中心的研究来进一步评价JP的远期预后。

