川芎嗪对胶质瘤干细胞裸鼠皮下移植瘤生长、TGF-β 信号通路和上皮-间质转化的影响
何 涛, 李振江, 丁炳谦
(河南大学淮河医院神经外科, 河南 开封 475000)
胶质母细胞瘤(glioblastoma,GBM) 是最常见的原发性颅内肿瘤,具有侵袭性。采用放疗和替莫唑胺标准治疗的GBM 患者中位总生存期仅为15.6 个月,预后极差[1]。胶质瘤干细胞 (glioma stem cells,GSCs)是一种以自我更新和致瘤性为特征的罕见亚群,又称肿瘤起始细胞,GSCs 的增殖与对药物、辐射和细胞应激的抵抗力增强有关,被认为是GBM 患者肿瘤复发和治疗抵抗的根本原因[2-3]。研究[4]显示:GSCs 可分化为间充质亚型,上皮-间质转化(epithelial-mesenchymal transition,EMT) 与该过程有关。 转化生长因子 β(transforming growth factor-β, TGF-β) 是参与EMT 的关键细胞因子,研究[5]显示:TGF-β1 可在肿瘤进展和转移过程中诱导EMT 并增强GSCs干性,提示其可作为胶质瘤临床治疗的分子靶点。川芎嗪是中草药川芎的生物碱成分,主要应用于缺血性心血管疾病中。研究[6]显示:川芎嗪可抑制三阴乳腺癌的增殖、侵袭和EMT,对卵巢癌和肾透明细胞癌的恶性表型也具有积极的干预作用[7-8]。本研究探讨川芎嗪调控TGF-β 信号通路介导GSCs恶性进展,构建GSCs 荷瘤裸鼠模型,给予不同剂量川芎嗪进行干预,观察药物对肿瘤进展的影响,以期为胶质瘤临床治疗药物的选择提供参考。
1 材料与方法
1.1 实验动物、细胞、主要试剂和仪器40 只雌性BALB/c 裸鼠,4 周龄,体质量(18±3)g,购自四川省人民医院实验动物研究所,实验动物生产许可证号:SCXK(川) 2018-15。裸鼠饲养于温度(24±2)℃、相对湿度50%~60%环境下,自由饮食,12 h 光-暗交替,适应性饲养1 周,本研究符合一般动物实验伦理学原则。人脑胶质瘤细胞系U87细胞购自美国ATCC细胞库。表皮生长因子(100-15)和碱性成纤维细胞生长因子(100-18B)购自美国Peprotech 公司,B-27 补充剂(17504-044)购自美国 Invitrogen 公司, 川芎嗪 ( 纯度≥98%)(DC0032)购自成都德思特生物技术有限公司,母亲 DPP 同 源 物 2/3 (small mother against decapentaplegic homolog 2/3,Smad2/3)(ABP52462)购自武汉艾美捷生物科技有限公司,TGF-β1 (YT763) 和 磷 酸 化 Smad2/3(phosphorylated Smad2/3,p-Smad2/3)(K25210)抗体购自北京百奥莱博生物科技有限公司,TGF-β受体Ⅰ(TGF-β receptor Ⅰ,TβRⅠ)(ENT4627)抗体购自武汉伊莱瑞特生物科技股份有限公司,TWIST 家族bHLH 转录因子1 (TWIST family bHLH transcription factor 1,TWIST1)(abs131127)抗体购自上海爱必信生物科技有限公司,波形蛋白(Vimentin)(bs-8533R) 抗体购自北京博奥森生物科技有限公司,E-钙黏蛋白(E-cadherin)(ab181296) 和锌指蛋白(Snail)(ab216347) 抗体购自美国Abcam 公司。7500HT型实时荧光定量PCR (real-time fluorescence quantitative PCR,RT-qPCR) 仪购自美国ABI 公司,550 型全自动酶标仪、PowerPac 电泳仪和CheniDoc XRS 化学发光成像分析系统购自美国Bio-Rad 公司。
1.2 GSCs 分离、富集和免疫荧光鉴定接种U87细胞至含10% 胎牛血清和1% 青-链霉素的DMEM/F12 培养液中,于37 ℃、5% CO2的加湿培养箱内培养24 h。后将培养液更换为无血清神经干细胞DMEM/F12 培养液(含1%青-链霉素、40 μg·L-1人表皮生长因子、40 μg·L-1人成纤维细胞生长因子和体积分数为2%的B-27 补充剂)。具有自我更新能力的GSCs 形成肿瘤球,分离并消化肿瘤球为单细胞悬液,高密度接种至6 孔细胞培养板中继续培养以富集GSCs。取富集后的GSCs,于4%多聚甲醛中固定30 min,Triton X-100 透核膜15 min, 5% 牛血清白蛋白封闭2 h, 4 ℃CD133 一抗(1∶400)内孵育过夜,室温下荧光二抗避光孵育1 h,4′,6-二脒基-2-苯基吲哚染核10 min,光学显微镜下观察细胞形态表现,荧光显微镜下检测干细胞标志物CD133 的表达并拍照。
1.3 裸鼠皮下移植瘤制备和实验分组经鉴定所富集细胞为GSCs。取对数生长期GSCs 并将其密度调整为1×104L-1,统一于裸鼠颈背部皮下接种200 μL 单细胞悬液,待皮下出现圆形结节,卡尺测量肿瘤直径,当肿瘤直径约为1 cm 时开始治疗试验。将GSCs 皮下移植瘤裸鼠随机分为模型组和低、中及高剂量川芎嗪组,每组10 只。其中模型组裸鼠仅给予等量生理盐水,低、中和高剂量川芎嗪组裸鼠分别腹腔注射川芎嗪1.5、 3.0 和6.0 mg·kg-1,每3 d 给药1 次,连续15 d。
1.4 测量各组裸鼠移植瘤体积、称瘤质量及计算瘤质量抑制率开始给药后,于第1、4、8、12 和15 天测量移植瘤体积,绘制移植瘤体积变化曲线。末次给药3 d 后,颈椎脱臼处死各组裸鼠并解剖剥离瘤体,清理并擦拭表面液体后称瘤质量并计算瘤质量抑制率。移植瘤体积(cm3) =1/2× 最长径(cm)×最短径(cm)2。瘤质量抑制率=[模型组平均瘤质量(mg)-给药组平均瘤质量(mg)]/模型组平均瘤质量(mg)×100%。
1.5 HE 染色观察各组裸鼠肿瘤组织病理形态表现取各组裸鼠部分肿瘤组织保存于4%多聚甲醛固定过夜,制备4 μm 厚度石蜡切片,按照HE 染色试剂盒说明书进行染色,光镜下观察各组裸鼠肿瘤组织病理形态表现并采集图片。
1.6 RT-qPCR 法检测各组裸鼠肿瘤组织中TGF-β1和TβRⅠmRNA 表达水平取各组裸鼠肿瘤组织提取总RNA,琼脂糖凝胶电泳检测RNA 完整性并将其反转录为cDNA。制备RT-qPCR 反应体系,于RT-qPCR 仪内进行定量检测,热循环条件:50°C、2 min,95 ℃、10 min,95℃、15 s,60 ℃、1 min,共40个循环。引物序列:TGF-β1 上游引物5′-GGATACCAACTATTGCTTCAGCTCC-3′,TGF- β1 下游引物5′-AGGCTCCAAATATAGGGGCAGGGTC-3′; TβR Ⅰ上游引物5′-GGCCAAATATCCCAAACAGAT-3′,TβR Ⅰ下游引物5′-AATCCAACTCCTTTGCCCTTA-3′; β -actin上游引物5′-AGCGGGAAATCGTGCGTGAC-3′,β-actin 下游引物5′-ACATCTGCTGGAAGGTGGAC-3′。以β-actin 为内参,采用2-ΔΔCt法计算各组裸鼠肿瘤组织中TGF-β1 和TβRⅠ mRNA 表达水平。
1.7 Western blotting 法检测各组裸鼠肿瘤组织中相关蛋白表达水平取各组裸鼠肿瘤组织提取全蛋白,BCA 蛋白质测定试剂盒测定蛋白浓度,加热变性。于十二烷基硫酸钠-聚丙烯酰胺凝胶电泳上分离等量蛋白质,并转移至聚偏二氟乙烯膜上,含5% 脱脂奶粉的TBST 缓冲液中37 ℃封闭2 h,Vimentin、E-cadherin、Snail、TWIST1、TGF-β1、TβRⅠ、Smad2/3、p-Smad2/3 蛋白和β-actin 一抗(均以1∶1 000 稀释)4 ℃孵育过夜,洗膜,辣根过氧化物酶偶联的二抗(1∶10 000 稀释)室温孵育2 h,洗膜,ECL Plus 发光试剂显影,凝胶成像系统成像并记录,采用Image J 软件分析蛋白条带灰度值,以β-actin 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.8 统计学分析采用SPSS 26.0 统计软件进行统计学分析, Graphpad prism9.5.1 软件绘制肿瘤体积变化曲线。各组GSCs 裸鼠皮下移植瘤体积、瘤质量和瘤质量抑制率,移植瘤组织中TGF-β1 和TβRⅠ mRNA 表达水平及相关蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 GSCs 免疫荧光鉴定U87 细胞在有血清的DMEM/F12 培养基中贴壁生长,经无血清神经干细胞培养液培养后,可见GSCs 球体非贴壁呈悬浮样生长,经富集培养后,细胞球体明显增大。免疫荧光染色可见干细胞标志物CD133 阳性表达。提示分离和富集的细胞为GSCs,且具有成瘤能力,可用于后续试验。见图1 和2。
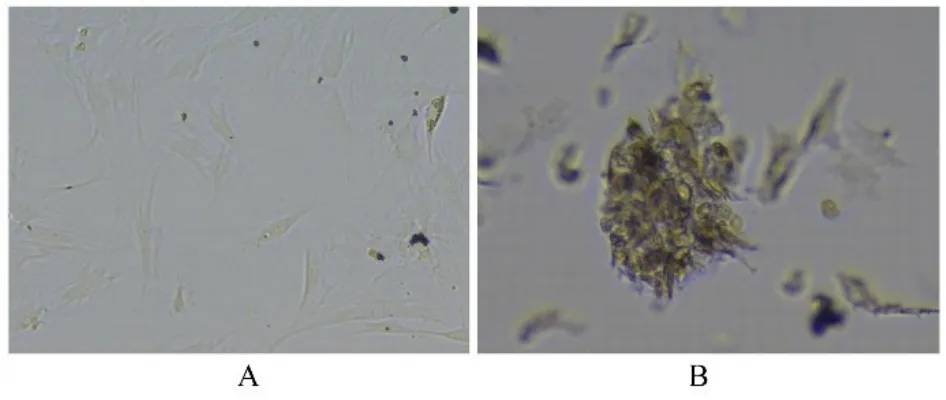
图1 光学显微镜下观察U87 细胞(A)和GSCs(B)形态表现(×100)Fig. 1 Morphology of U87 cells(A)and GSCs(B) observed by optical microscope(×100)
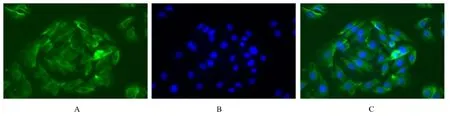
图2 免疫荧光鉴定GSCs 中CD133 表达(×200)Fig. 2 Expression of CD133 in GSCs identified by immunofluorescence (×200)
2.2 各组裸鼠移植瘤体积变化与模型组比较,低、中和高剂量川芎嗪组裸鼠皮下移植瘤体积均减小(P<0.05),且呈剂量依赖性。见图3。
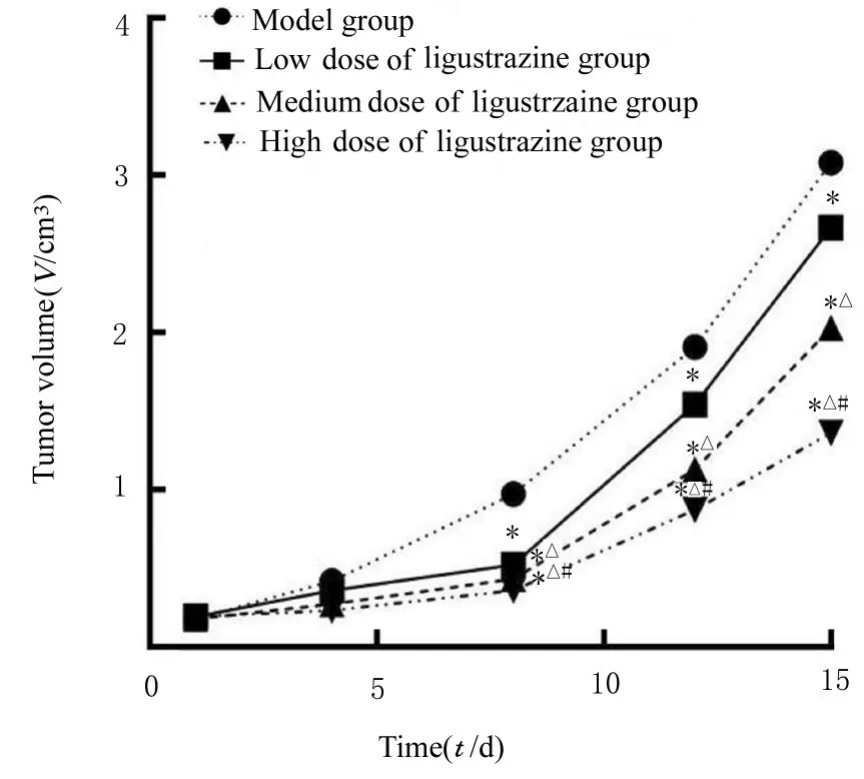
图3 各组裸鼠移植瘤生长曲线Fig. 3 Growth curves of transplanted tumors of nude mice in various groups
2.3 各组裸鼠移植瘤质量和瘤质量抑制率与模型组比较,低、中和高剂量川芎嗪组裸鼠移植瘤瘤质量均降低(P<0.05),且呈剂量依赖性。低、中和高剂量川芎嗪组瘤质量抑制率逐渐增大(P<0.05),分别为12.72%、 39.90% 和55.36%。见图4 和表1。

表1 各组裸鼠瘤质量和瘤质量抑制率Tab. 1 Tumor weights and inhibitory rates of tumor weights of nude mice in various groups(n=10)
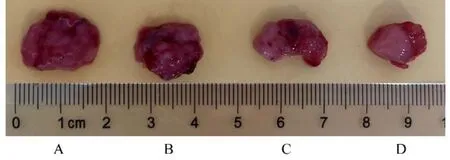
图4 各组裸鼠移植瘤大体形态Fig. 4 Gross morphology of transplanted tumor of nude mice in various groups
2.4 各组裸鼠移植瘤组织病理形态表现模型组裸鼠肿瘤组织细胞形态良好,连接紧密,生长密度高,核异型性明显;低、中和高剂量川芎嗪组裸鼠肿瘤组织结构紊乱,细胞密度逐渐降低,核固缩和核裂解逐渐明显,组织坏死区逐渐增大,且随着川芎嗪剂量的增加,上述改善逐渐明显。见图5。
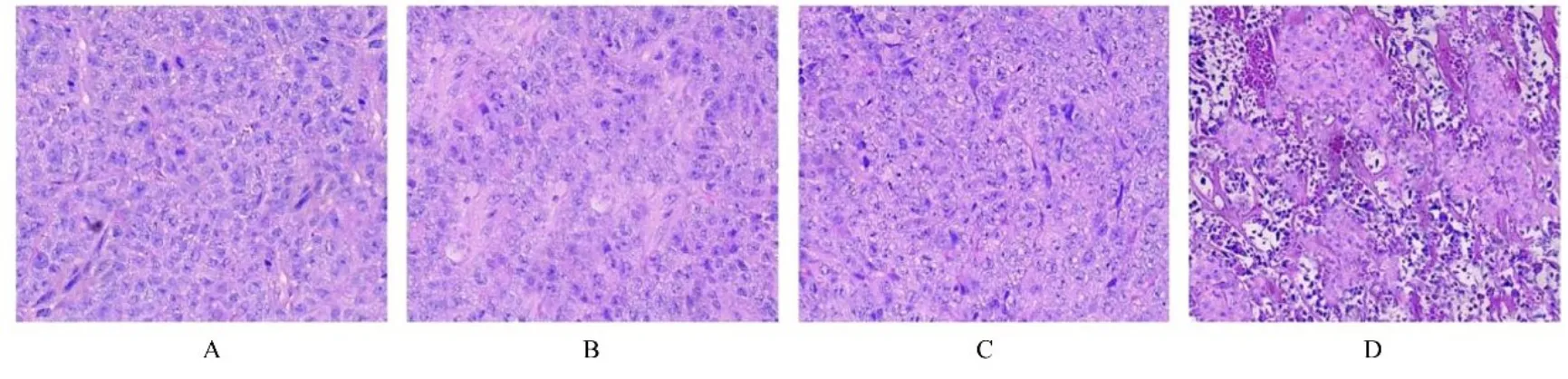
图5 各组裸鼠移植瘤组织病理形态表现(HE,×200)Fig. 5 Pathomorphology of transplanted tumor tissue of nude mice in various groups (HE,×200)
2.5 各组裸鼠移植瘤组织中TGF-β1 和TβRⅠmRNA 表达水平与模型组比较,低、中和高剂量川芎嗪组裸鼠移植瘤组织中TGF-β1 和TβRⅠmRNA 表达水平均降低(P<0.05),且呈剂量依赖性。见表2。

表2 各组裸鼠移植瘤组织中TGF-β1 和TβRⅠ mRNA 表达水平Tab. 2 Expression levels of TGF-β1 and TβR Ⅰ mRNA in transplanted tumor tissue of nude mice in various groups(n=10,x±s)
2.6 各组裸鼠移植瘤组织中 E-cadherin、Vimentin、Snail 和TWIST1 蛋白表达水平与模型组比较,低、中和高剂量川芎嗪组裸鼠皮下移植瘤组织中E-cadherin 蛋白表达水平均升高(P<0.05),TWIST1、Vimentin 和Snail 蛋白表达水平均降低(P<0.05),且呈剂量依赖性。见图6和表3。

表3 各组裸鼠移植瘤组织中EMT 相关蛋白表达水平Tab.3 Expression levels of EMT-related proteins in transplanted tumor tissue of nude mice in various groups (n=10,x±s)
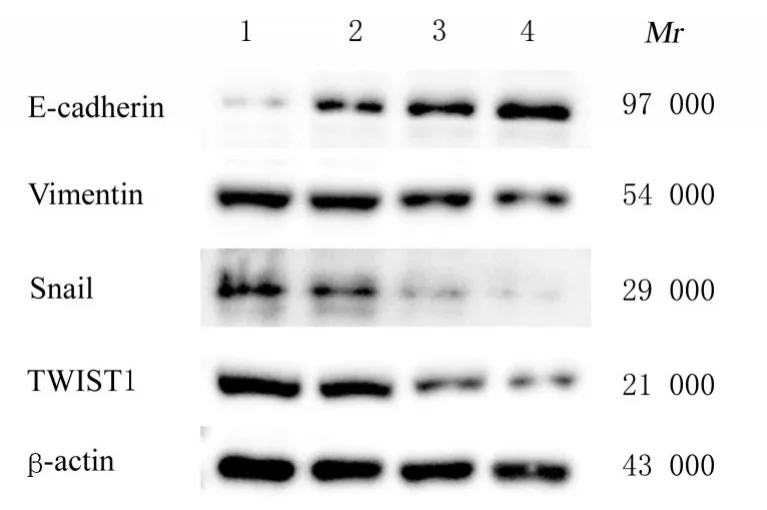
图6 Western blotting 法检测各组裸鼠移植瘤组织中EMT 相关蛋白表达电泳图Fig. 6 Electrophoregram of expressions of EMTrelated proteins in tumor tissue of nude mice in various groups detected by Western blotting method
2.7 各组裸鼠移植瘤组织中TGF-β1、TβRⅠ、Smad2/3 和p-Smad2/3 蛋白表达水平与模型组比较,低、中和高剂量川芎嗪组裸鼠移植瘤组织中TGF-β1、TβRⅠ和p-Smad2/3 蛋白表达水平均降低(P<0.05),且呈剂量依赖性。各组裸鼠移植瘤组织中Smad2/3 蛋白表达水平比较差异无统计学意义(P>0.05)。见图7 和表4。

表4 各组裸鼠移植瘤组织中TGF-β 信号通路蛋白表达水平Tab.4 Expression levels of TGF-β signaling pathway proteins in transplanted tumor tissue of nude mice in various groups(n=10,x±s)
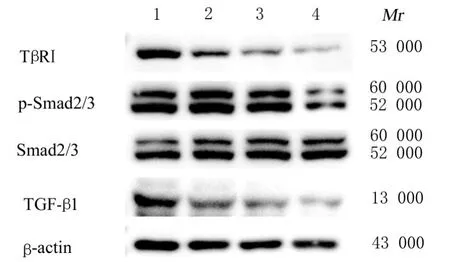
图7 Western blotting 法检测各组裸鼠移植瘤组织中TGF-β 信号通路蛋白表达电泳图Fig. 7 Electrophoregram of expressions of TGF-β signaling pathway proteins in tumor tissue of nude mice in various groups detected by Western blotting method
3 讨 论
WHO 根据胶质瘤的病理类型分为4 个等级,其中Ⅰ级和Ⅱ级为低级别胶质瘤,Ⅲ级和Ⅳ级为高级别胶质瘤,GBM 为Ⅳ级胶质瘤,倾向于在复发时将GBM 亚型由原神经型转化为间充质型,间充质型GBM 最具侵袭性和稳定性[9]。在EMT 激活的肿瘤转移过程中,部分GBM 细胞表现出类似于干细胞的自我更新能力,提示调控GSCs 中EMT进展可作为临床开发新的治疗策略靶点[10]。
研究[11]显示:无血清培养基可促进GSCs 由GBM 中分离并保持干性特征,并可通过干细胞表面标志物表达、球体形成和异体移植等方法鉴定。CD133 是应用于GSCs 分离最常见的标志,与肿瘤血管生成和细胞增殖有关,CD133 阴性GSCs 缺乏自我更新和体外形成球体的能力[12]。本研究结果显示:经无血清神经干细胞培养液培养后,贴壁生长的U87 细胞中可见悬浮球体样细胞团,经分离和富集后,球体细胞团增殖明显,经免疫荧光鉴定后,所得细胞CD133 阳性表达,且在异种移植后可形成瘤组织,提示本研究所分离和富集的细胞为GSCs,且具有成瘤能力,可用于后续试验。近年来,有研究[13-14]评估了传统药物作为癌症替代疗法的效果,发现川芎嗪除具有抗炎、抗纤维化和抗氧化活性外,还具有显著的抑癌活性。DONG 等[15]发现:川芎嗪可干扰肺癌细胞增殖和侵袭,并可抑制体内肿瘤形成。CHEN 等[16]研究显示:川芎嗪可明显降低裸鼠体内结肠肿瘤质量。本研究构建GSCs 裸鼠皮下移植瘤模型,并给予不同剂量川芎嗪治疗后发现,给药组裸鼠皮下移植瘤体积和瘤质量明显降低,同时低、中和高剂量川芎嗪组瘤质量抑制率逐渐升高,提示川芎嗪可呈剂量依赖性抑制GSCs 裸鼠移植瘤生长。这可能与川芎嗪可诱导肿瘤细胞发生病理损伤并破坏肿瘤组织结构从而导致移植瘤生长受限有关,同时表明川芎嗪具有作为新型抗胶质瘤药物的潜力。
EMT 为细胞迁移、侵袭和转移的先决条件,其生物学特性主要包括促进肿瘤细胞恶性增殖、减少细胞凋亡、衰老及促进免疫抑制等,目前已被广泛报道为促进胶质瘤迁移、侵袭和肿瘤进展的关键机制[17]。TWIST1、Snail 和Slug 等蛋白为EMT诱导转录因子,可通过不同的信号级联直接或间接参与癌症细胞转移,上述因子过表达时可促进EMT,最终将导致E-cadherin 表达下调,转移蛋白如Vimentin、N-钙黏蛋白和基质金属蛋白酶-2 表达上调[18]。研究[19-20]显示:Snail 可促进胚胎或上皮源性肿瘤中的EMT,在GBM 中,Snail 促进肿瘤入侵,通过下调TWIST1 和Snail 表达可抑制GSCs 中EMT 程序的激活,进而抑制GSCs 在脑组织中的弥漫性浸润。E-cadherin 是一种跨膜糖蛋白,在正常细胞中发挥抑制肿瘤的作用,其表达和细胞极性的丧失是EMT 的关键步骤,E-cadherin 表达下调通常表明各种癌症患者的预后和存活率较差。与EMT 期间E-cadherin 功能丧失比较,Vimentin和N-钙黏蛋白作为间充质标志物表达上调,可促进细胞迁移或转移至靶器官[2]。本研究结果显示:与模型组比较,川芎嗪可有效降低GSCs 肿瘤组织中TWIST1、Snail 和Vimentin 蛋白表达水平,升高E-cadherin 蛋白表达水平,提示川芎嗪可能通过抑制GSCs 中EMT 诱导而抑制癌细胞向间充质亚型转化,进而发挥对肿瘤恶性进展的干扰作用,对GBM 患者预后及生存率具有积极意义。
TGF-β 信号通路可介导调节EMT 过程,TGF-β1 通过与其受体TGF-β 受体结合形成跨膜复合物,下游Smad2/3 蛋白被磷酸化并与Smad4 结合形成相对稳定的三聚体复合物易位至细胞核,进而调节EMT 靶基因的转录[21]。研究[22]显示:TGF-β1 可通过Smad2/3 在各种上皮细胞和转基因小鼠中诱导EMT,同时诱导E-cadherin 蛋白表达水平降低,Vimentin 和Snail 蛋白表达水平升高,并提高癌细胞的迁移和侵袭能力。另有研究[23]显示:TGF-β1 在低级别和高级别胶质瘤中表达均较正常脑组织明显上调,TGF-β/Smad 信号激活可促进胶质瘤干细胞样特性、血管化和治疗耐药等恶性行为,对胶质瘤间充质转化具有积极诱导作用。本研究结果显示:与模型组比较,给药组裸鼠皮下移植瘤组织中TGF-β1 和TβRⅠ mRNA 及蛋白表达水平均降低,同时p-Smad2/3 蛋白表达被抑制,提示川芎嗪可能通过抑制TGF-β1/Smad2/3 信号通路激活,干扰EMT 相关基因转录,抑制GSCs 的间充质样转化,进而影响GSCs 荷瘤裸鼠的肿瘤恶性进展。
综上所述,川芎嗪可降低GSCs 裸鼠皮下移植瘤体积及瘤质量,促进肿瘤组织和细胞发生病理性损伤,同时还可抑制TGF-β1/Smad2/3 信号通路激活及EMT 诱导。

