核桃花粉活力测定方法的选择及花粉特性的研究
刘诚诚, 彭建勇, 李 恒, 蔺雨阳, 宋长勇, 张春花
(1.攀枝花市农林科学研究院, 四川 攀枝花 617061;2.攀枝花市金沙林场同德管护站, 四川 攀枝花 617007)
花粉活力的高低由植物本身的基因型、花粉类型和遗传特性所决定,其次还受温度、湿度、光照等环境因子影响[1]。花粉活力的检测方法主要有离体萌发法、授粉法、染色法等。因离体萌发法操作较复杂,花费时间长,不适宜花粉活力的快速检测[2];而授粉法受环境因子影响大,近年来研究人员少有采用;染色法因具有快速简便的优点,被广泛采用。
在核桃的杂交育种工作中,父本的花粉活力直接影响杂交试验的成败。肖真真等[3]和张焕玲等[4]都选用了TTC、I2-KI、MTT染色剂测定核桃花粉活力,认为MTT更适宜快检;但是在胡青等[5]、赵建建等[6]的核桃花粉活力研究中,TTC染色剂更为有效。因此,不同品种的核桃其花粉活力对染色剂的反应不尽相同,参与杂交育种的品种,需要与之配套的花粉活力快检方法。本地圆核桃是项目组长期跟踪观测的优良品种,具有果面光滑,缝合线不紧密,果仁饱满,仁色米白,遗传性状稳定等优点。是甄选出来供杂交育种的优良亲本,潜在育种价值高,掌握其花粉特性,摸索出花粉活力规律迫在眉睫。本试验通过本地圆核桃花粉活力的测定方法及花粉特性的研究,遴选花粉活力简便、准确的测定方法,并探寻花粉活力变化规律和储存方法。
1 材料和方法
1.1 试验材料及采集方法
试验材料为攀枝花本地优良核桃,本地称为圆核桃,树龄10年,2018年开始结果,现处于盛果期,位于攀枝花市仁和区啊喇乡起查那村。花粉采集选在无风的早上,采集试验所需的雄花序,装入硫酸纸袋中,放入保温箱中迅速带回实验室阴干,待花药自然开裂散粉后,收集于棕色小药瓶中待测。
1.2 试验方法
1.2.1花粉活力测定方法的筛选
取少量收集到的花粉置于烘箱中,100 ℃烘干24 h,至花粉失活作为ck。另取收集到的新鲜花粉,选用醋酸洋红染色法[7]、氯化三苯基四氮唑(TTC)法[8]、MTT染色法[9]、碘-碘化钾(I2-KI)[10]染色法分别对花粉进行活力测定后筛选出适宜检测该花粉活力的方法。
1.2.2不同采集时期花粉活力测定
选择散粉始期、散粉盛期、散粉末期采集花序,阴干后抖落收集花粉进行活力测定。
1.2.3不同储存方式花粉活力测定
将采集到的花粉分成两份,一份置于常温中存储,另一份置于冰箱中冷藏,定时对两份花粉进行活力测定。
1.2.4花粉泡水活力测定
取少量花粉模拟泡水喷施处理,将花粉混入清水中,并加入少量白糖,分别在0 min、5 min、10 min、15 min、20 min测定泡水后的花粉活力。
1.2.5自然散粉活力测定
收集树下掉落的核桃雄花序,常温保存,定时对其进行活力测定。
1.3 数据统计
花粉活力测定时,每处理设置3个重复,每个重复在显微镜下随机选取3个视野,每个视野观察的花粉数不低于50粒。
花粉活力/%=(有活力的花粉数量/总花粉数量)×100%。
1.4 数据处理
采用单因素方差分析(one-way ANOVA)和最小显著差异法(LSD)进行多重比较。采用SPSS22.0软件完成数据分析,Excel2019软件完成制图。
2 结果与分析
2.1 花粉活力测定染色剂的比较与选择
如图1所示,醋酸洋红对花粉染色后,视野内活力花粉和失活花粉均呈橙红色,活力花粉染色较深,失活花粉染色较浅,不能很好区分花粉是否具有活力;TTC对花粉染色后,视野内的活力花粉染色情况不理想,大部分活力花粉不能染色,失活花粉都不能染色,且多次试验结果不稳定,时常出现活力花粉染色失败,花粉均无法染色的情况;碘-碘化钾对花粉染色后,视野内的活力花粉和失活花粉均呈红棕色,不能区分花粉是否具有活力;MTT对花粉进行染色后,活力花粉呈玫红色,失活花粉呈黄色或浅粉色,能很好区分活力花粉和失活花粉。比较四种染色法对花粉的染色情况MTT法最佳,醋酸洋红法次之,再次为TTC法,最后为碘-碘化钾。因此,可采用MTT染色法对该品种花粉进行活力测定。
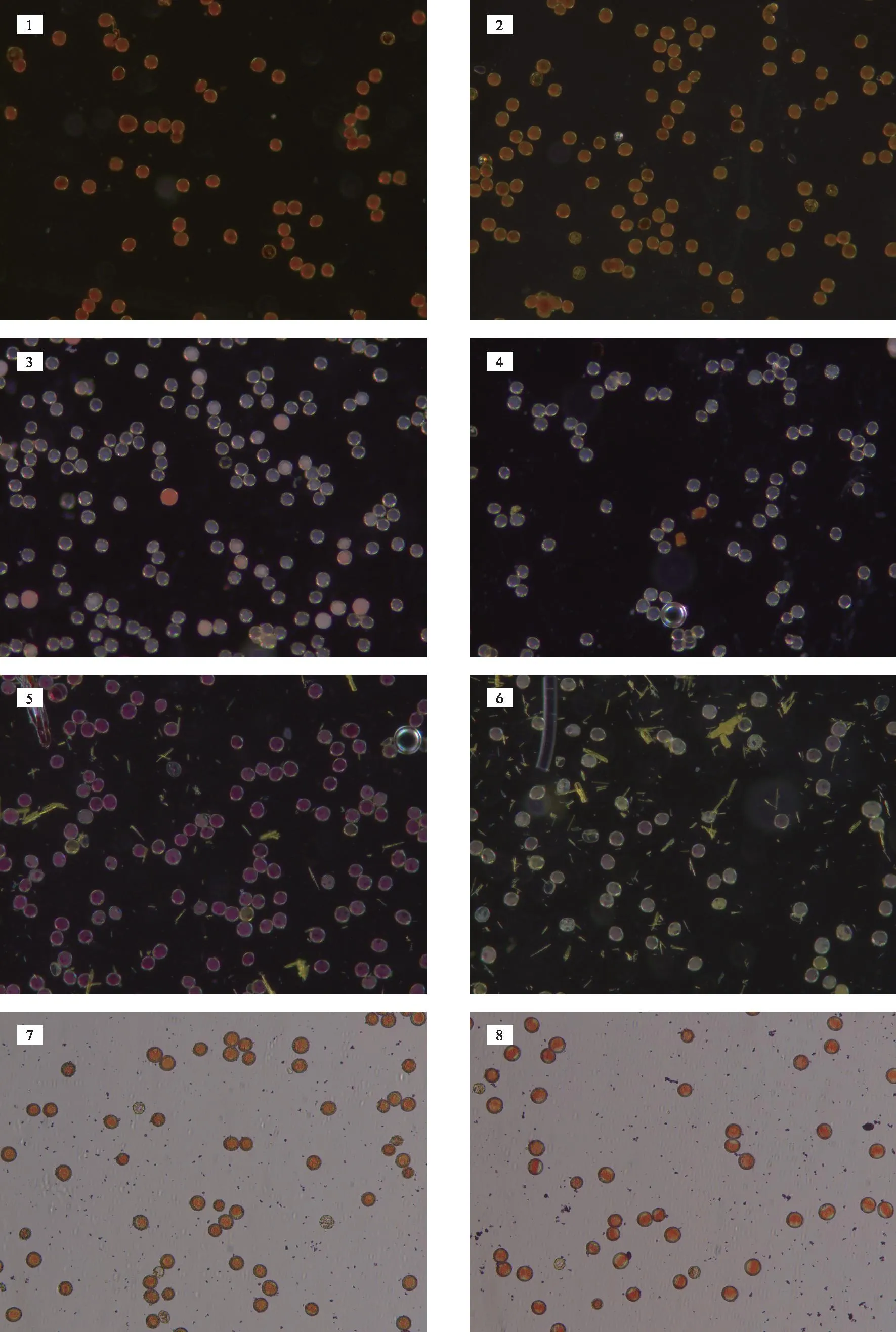
注:1号为活力花粉被I2-KI染色,2号为失活花粉被I2-KI染色,3号为活力花粉被TTC染色,4号为失活花粉被TTC染色,5号为活力花粉被MTT染色,6号为失活花粉被MTT染色,7号为活力花粉被醋酸洋红染色,8号为失活花粉被醋酸洋红染色。图1 4种染色法对花粉的染色情况
2.2 不同采集时期花粉活力
结果如表1所示,花粉活力在散粉始期较低,为48.442%,在散粉盛期和散粉末期较高,分别为96.136%,93.606%。经方差分析显示,散粉始期花粉活力与散粉盛期、散粉末期在0.05水平上差异显著。

表1 不同采集时期花粉活力
2.3 不同存储方式花粉活力
图2表明,花粉活力随时间的延长呈下降趋势,但是冷藏保存的花粉活力下降速度较常温保存缓慢。花粉在刚采收时,活力为93.849%,在冷藏5 d内,花粉活力为96.285%,差异不显著,冷藏31 d内,花粉活力在0.05水平上差异显著,下降趋势不明显,冷藏31 d后,花粉活力差异显著,下降趋势明显;常温储藏花粉,花粉活力差异显著,活力下降趋势明显,在储藏10 d后,花粉活力为0。
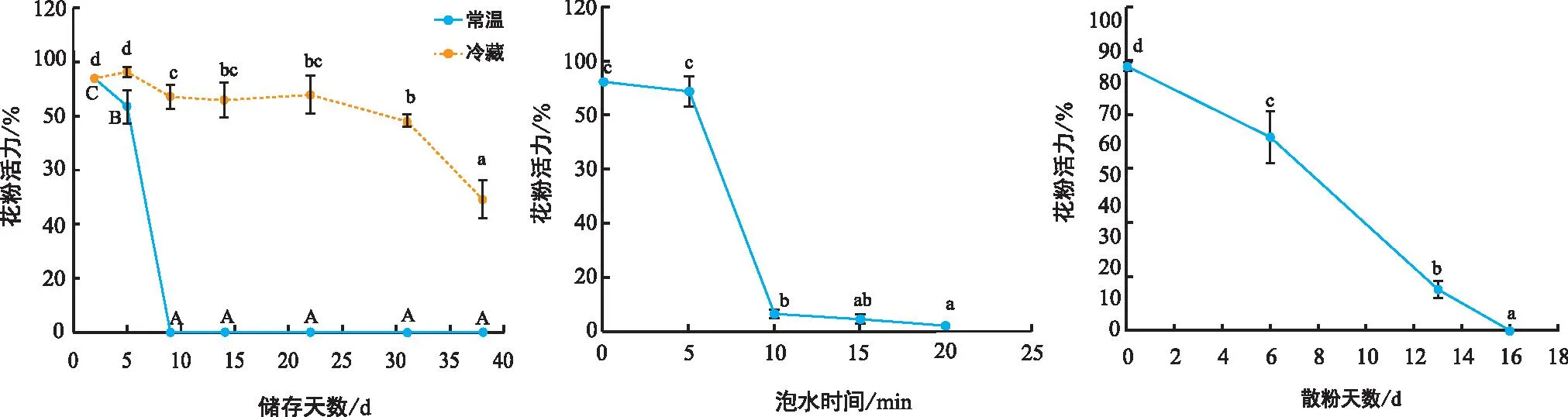
注:图中数值为平均值,不同大、小写字母表示不同处理间差异显著(p<0.05)。A为不同储存方式花粉活力变化;B为泡水后花粉活力变化;C为自然散粉花粉活力变化。图2 不同处理的花粉活力
2.4 花粉泡水活力变化
如图2所示,花粉初始活力为93.606%,在泡水后花粉活力下降,且在0.05水平上差异显著。泡水前5 min,花粉活力下降缓慢,下降至89.935%;泡水10 min,花粉活力迅速下降至6.859%;泡水15 min,花粉活力下降至1.854%;泡水20 min,花粉活力下降至0.518%。
2.5 自然散粉的花粉活力变化
如图2所示,自然散粉的花粉活力为85.862%,自然储藏后花粉活力下降,且在0.05水平上差异显著。在自然储藏13 d后,花粉活力下降至13.32%,16 d后花粉活力为0。
3 结论与讨论
3.1 讨 论
3.1.1核桃花粉活力测定的选择
被子植物的有性生殖过程须经活力花粉传到可授性柱头完成授精[11],因而了解品种花粉活力对于核桃杂交育种愈发关键。本研究选用的4种染色剂检测花粉活力,并将失活花粉作为对照,能够直观区分活力花粉和失活花粉的染色情况,准确筛选出检测方法。本研究中,MTT染色法能快速有效的检测本地圆核桃花粉活力,而醋酸洋红染色法、氯化三苯基四氮唑(TTC)法、碘-碘化钾(I2-KI)不能稳定准确测定其花粉活力。
在本研究中,核桃活力花粉和失活花粉均可被I2-KI染成红棕色,活力花粉着色较深,失活花粉则较浅。该方法通过花粉内淀粉染色情况来判断花粉活力,活的花粉有淀粉积累,被I2-KI染成蓝色,而发育不良的花粉不积累淀粉,用I2-KI染色时不显蓝色,另外,其着色程度由花粉壁的薄厚和花粉内支链淀粉和直链淀粉比例高低决定,且直链淀粉显蓝色,支链淀粉为红棕色[12]。本研究中,花粉被I2-KI染色后呈红棕色,这可能是由于该品种内支链淀粉占主导,直链淀粉较少,因而I2-KI染色后呈红棕色,该颜色与溶液自身颜色相似,故染色后的活力花粉与失活花粉无法区分。另外,该花粉被I2-KI染色不明显,可能是因为该品种花粉壁通过性不好,本研究中TTC法不能对花粉进行染色,也进一步说明这一论证,也有学者提出TTC染色法对花粉要求较高,难以准确测定花粉活力[13]。在前人的研究中,漾濞大炮[5]、绿岭[6]、川早1号[14]等品种的花粉可以被TTC染色,而新新2号[3]、云新14号[15]、清香[16]等品种花粉只能被MTT染色。
3.1.2花粉的处理、储藏与花粉活力关系
通过将花粉泡水后检测其活力,圆核桃花粉经泡水处理后5 min几乎完全失活,孔令通[17]在对薄壳山核桃的花粉进行研究时,发现泡水喷施花粉液坐果率低,可佐证核桃特定品种的花粉不宜采用泡水喷施的方法授粉。花粉活力在散粉盛期最强,末期稍差,初期最弱(图2),花粉的自然成熟散粉是品种在漫长进化后的时机选择,与特定雌蕊的花期进行适配,来保证品种下品系多样性的最优策略。不适宜的人工方法和时机干预会表现为花粉活力的“固执现象”(以快速失活或累积不够为主要表现)。这种花粉活力的“固执现象”,是收集花粉进行人工授粉或杂交育种中需要注意或设法利用的参考。刘天凤等[15]对不同时期的花粉活力进行了研究,其结果与本研究不同,说明不同品种的核桃花粉活力特性不同,在杂交育种以及配置授粉树等工作中,花粉活力的研究显得尤为重要。
3.2 结 论
本地圆核桃花粉活力可采用MTT染色法快速、有效检测其活力,冷藏处理有利于延缓花粉失活,泡水处理可能加速花粉失活,在核桃授粉中应谨慎使用;本研究模拟了自然条件下花粉活力的变化,研究表明,在自然条件下,自然散粉的核桃花粉参考寿命为16 d,可为核桃选择授粉树配置提供理论指导。

