储油罐用碳钢在模拟海水中的缓蚀剂研究
陈 诚
(常熟市恒达能源科技有限公司,江苏 常熟 215500)
我国沿海地区海水资源丰富,考虑用海水替代淡水作为大型储油罐或者LNG储罐试压用水[1]。但是海水含盐量高且成分复杂,其电导率比淡水一般高出两个数量级,罐体内部表面浸没在海水中将受到海水的腐蚀。因此研究并采取有效的防护措施,是采用海水试压的前提,其中投加缓蚀剂是一种较好的防腐蚀方法[2-6],其加入量甚微,同时也不需要改变原有的设备和工艺,且效率高,操作简单,在保护资源、减少材料损失方面起着重要的作用。因此研究开发适用于海水介质中的缓蚀剂必将是一种高效快捷的途径[7-12]。
1 试 验
1.1 材料与试剂
实验所用材料为储油罐用碳钢,模拟海水主要成分见表1。将葡萄糖酸钠;硫酸锌;HEDP三种按一定比例溶于水中配制缓蚀剂。实验温度25 ℃。
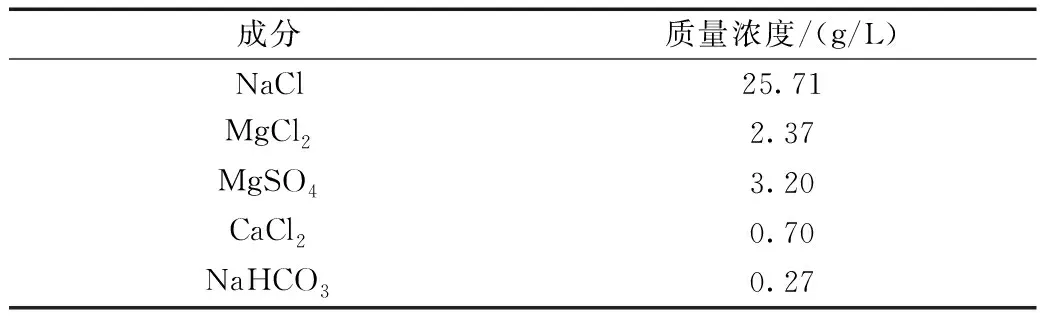
表1 模拟海水成分Table 1 Composition of simulated seawater
1.2 试验方法
1.2.1 失重法
失重法参照 GB10124-88[13]和ASTM G31-72(2004)[14]等方法进行实验。本研究采用经典的静态全浸悬挂法,每组实验选用三个平行试样测定缓蚀效率。试样经称重后,挂入溶液中浸泡一定时间,取出的试样按GB/T 16545-1996[15]、ASTM G1-90[16]方法进行处理、称重,由试片在实验前后的质量损失计算出腐蚀率和缓蚀率,同时观察试片的表面形貌。
1.2.2 极化曲线法
试验在电化学工作站上进行。测试时待体系的自然腐蚀电位稳定后,记下自然腐蚀电位Ec,然后进行阴极和阳极扫描,扫描速度为1 mV/s。根据加入和不加入缓蚀剂时所测得的腐蚀电流计算缓蚀剂的缓蚀效率[17]。
2 结果与讨论
2.1 缓蚀剂配方的优化
选定葡萄糖酸钠、硫酸锌、HEDP组成3元缓蚀剂。根据实验的因素水平数,选择L16(45)正交表作正交实验。测定各实验编号的极化曲线,求出缓蚀率。最终确定以上3组分的最佳复配比为:葡萄糖酸钠:硫酸锌:HEDP=15:20:4。按此比例得到不同浓度时的极化曲线如图1所示。
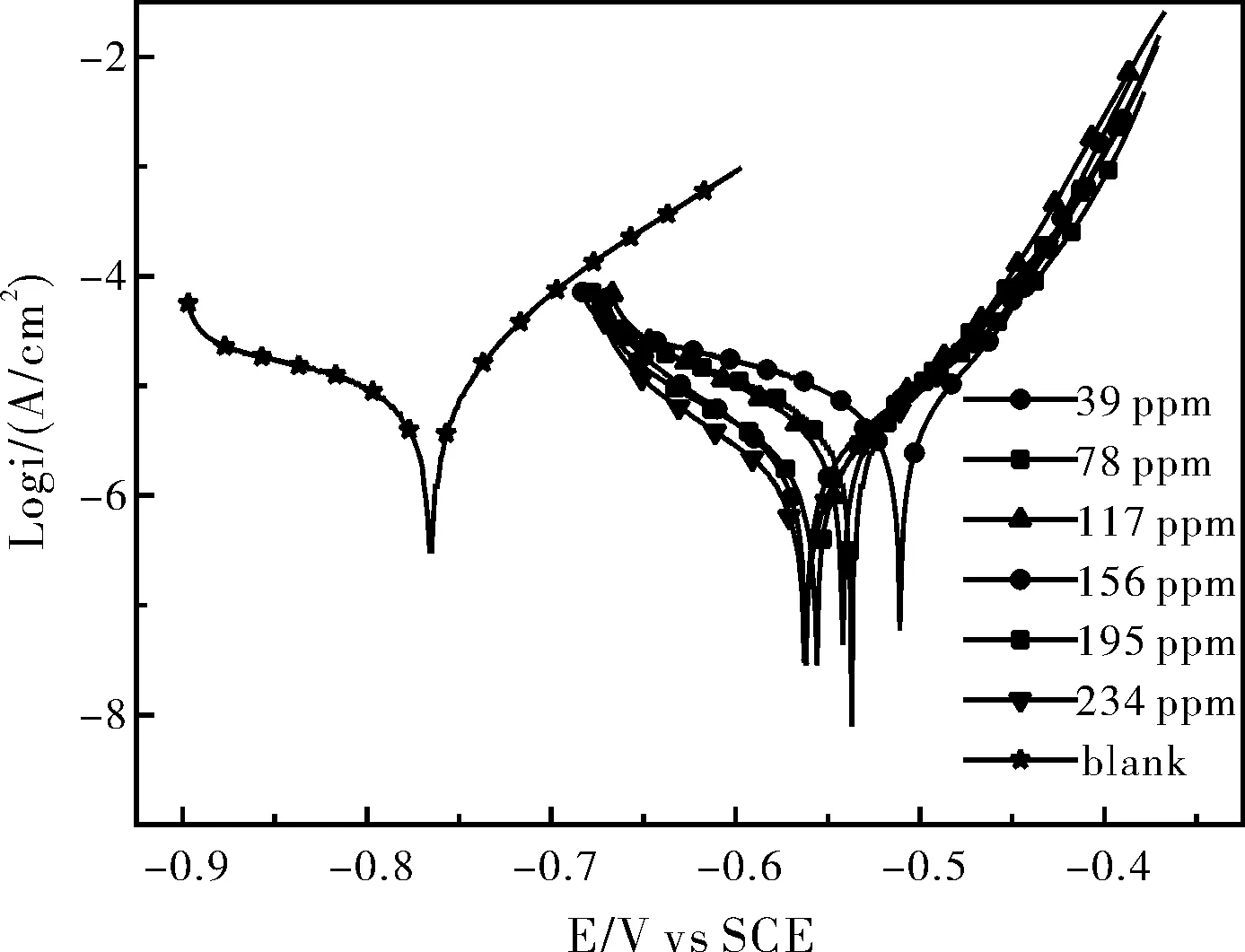
图1 不同3元缓蚀剂浓度的极化曲线Fig.1 Polarization curves of carbon steel in simulated seawater with three-compound inhibitor at different concentrations
根据图1的极化曲线进行拟合,得到表2,随着3元缓蚀剂添加浓度的增加,缓蚀效率上升,在加入量为234 ppm时,缓蚀效率达到92.1%。
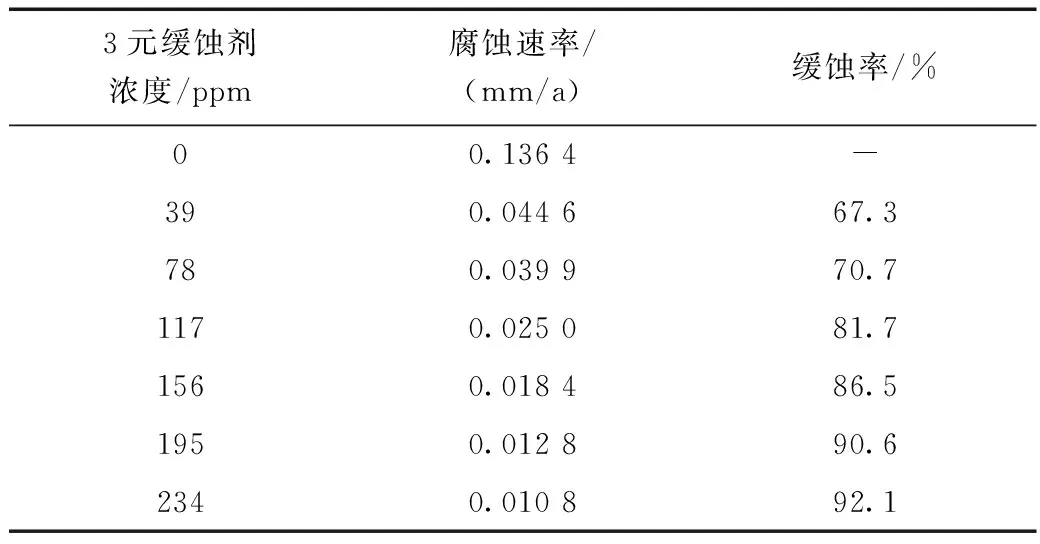
表2 碳钢在不同3元缓蚀剂浓度时的极化曲线参数拟合结果表Table 2 The fitting values of kinetic parameters of polarization curves
把表2中的缓蚀率变化绘制成图,如图2所示。由图2可以看出低于117 ppm时3元缓蚀剂缓蚀率较低(<80%),当添加浓度继续增大时,缓蚀率提高趋缓,直到195 ppm时缓蚀率才达90%以上,可以确定其临界浓度为195 ppm。
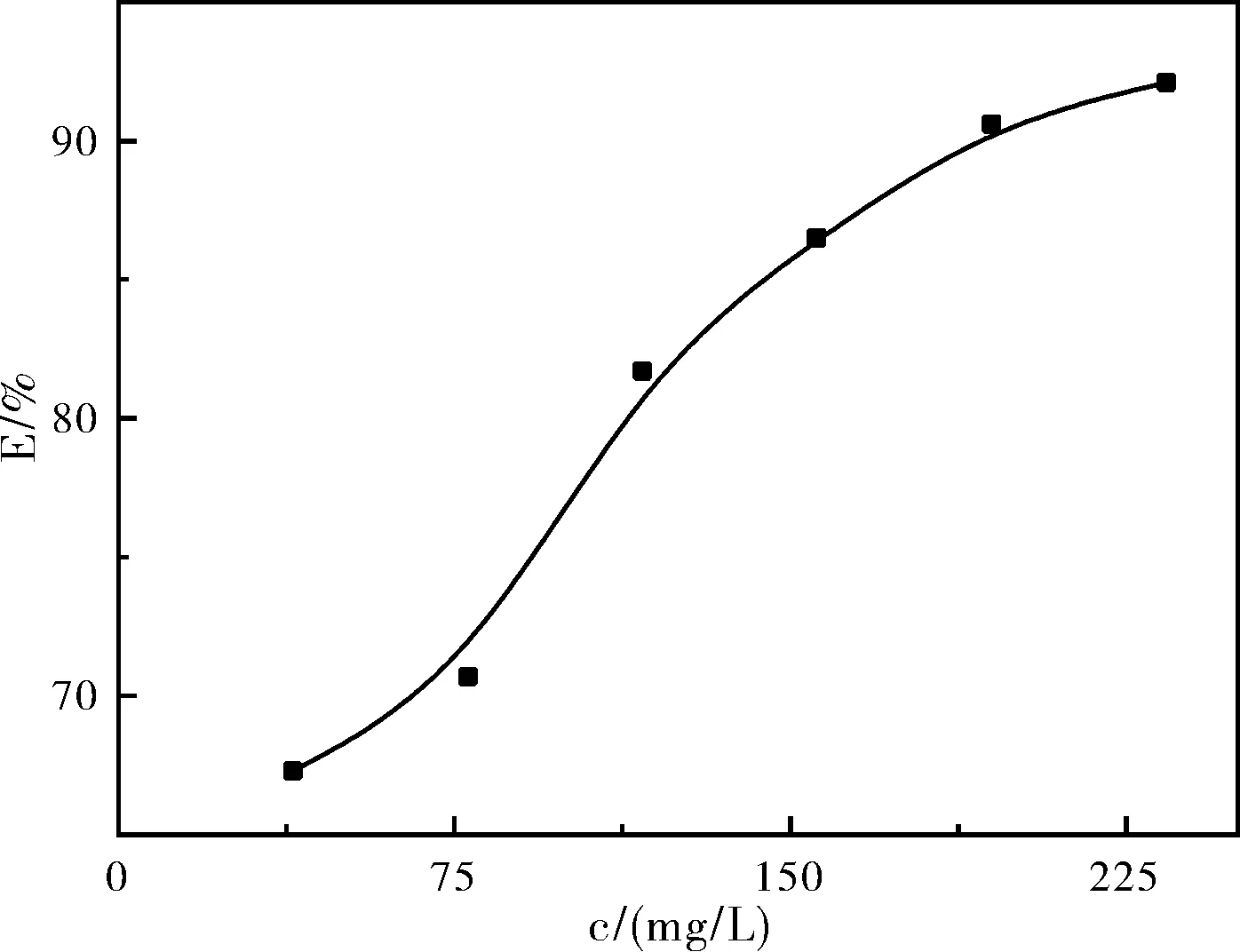
图2 缓蚀率随浓度的变化关系Fig.2 Variation of inhibition efficiency with concentration
2.2 模拟海水中失重结果与分析
从表3可以看出,在模拟海水中加入3元缓蚀剂,缓蚀效率为98.1%。根据文献[18]对碳钢在海水中的腐蚀数据及规律的研究结果表明:所有碳钢的腐蚀速度在(0.07~0.18)mm/a之间。因此在模拟海水中的室内失重结果与文献报道中的腐蚀速率基本一致。
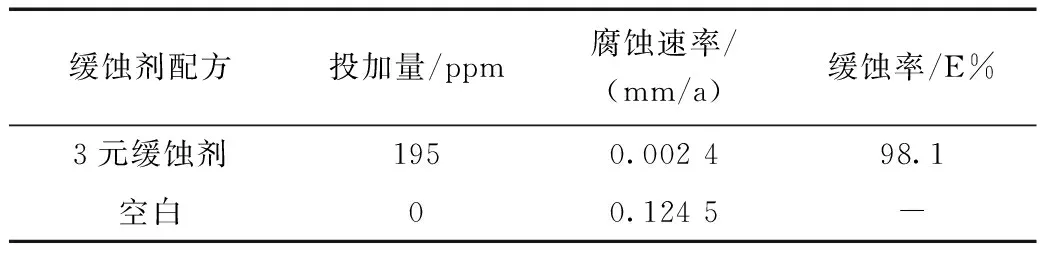
表3 碳钢在模拟海水中使用3元缓蚀剂挂片14天的实验结果Table 3 Corrosion rate of carbon steel after 14 days in simulated seawater with three-compound inhibitor
2.3 表面形貌分析
从图3可以看出空白试片(205)腐蚀产物表层为黄褐色,用自来水冲洗,易清除;表面发生全面腐蚀,无点蚀发生;而加入缓蚀剂配方的试片(201)表面有一层膜,无点蚀发生。

图3 碳钢在模拟海水中使用3元缓蚀剂挂片14天酸洗前后的表面形貌。Fig.3 Surface morphology of carbon steel after 14 days in simulated seawater with three-compound inhibitor
2.4 机理分析
碳钢在海水中腐蚀过程的本质是电化学反应,反应过程如下:
(1)阳极区发生铁的氧化溶解反应:Fe-2e-→Fe2+。
(2)阴极区发生氧的还原反应:O2+2H2O+4e-→ 4OH-。
在强极化区,将阳极、阴极极化曲线的Tafel线性区外推得到的交点所对应的横坐标即为腐蚀电流密度的对数,以此可以得到腐蚀电流密度,由未加和加有缓蚀剂的腐蚀电流密度计算缓蚀率;同时根据加药前后腐蚀电位和极化曲线形状的改变确定缓蚀剂的作用类型[19]。Tafel参数值的变化,也可以为缓蚀剂的缓蚀机理提供信息[20]。
加入缓蚀剂后极化曲线的阴阳极Tafel斜率比不加入缓蚀剂的大,尤其是阳极Tafel斜率更明显,同时电极的腐蚀电位正移,表明缓蚀剂主要是控制电化学反应的阳极过程;这是因为三元缓蚀剂中的葡萄糖酸根、两个膦酸根螯合基团在阳极区与阳极溶解产物(Fe2+和Fe3+)形成螯合物的沉积膜,抑制了阳极的溶解。随着缓蚀剂浓度的增加,腐蚀电位又负移,表明缓蚀剂对氧扩散过程控制的阴极过程也有较强的抑制作用,与锌离子和氢氧根离子生成沉积膜有关。
3 结 论
(1)通过正交实验确定了葡萄糖酸钠、硫酸锌、HEDP复配的3元缓蚀剂最佳复配比为15:20:4。
(2)用极化曲线法确定了3元缓蚀剂的临界浓度为195 ppm。据极化曲线分析可以确定该3元缓蚀剂是抑制阳极过程为主的混合型缓蚀剂。主要是葡萄糖酸根、两个膦酸根螯合基团在阳极区与阳极溶解产物(Fe2+和Fe3+)形成螯合物的沉积膜,抑制了阳极的溶解,锌离子在阴极区与氢氧根离子形成沉积膜,抑制了阴极的氧扩散过程。
(3)室内失重实验表明在25 ℃模拟海水中缓蚀效率为98.1%,防腐蚀效果优良。

