多b值扩散加权成像在阿尔茨海默病临床诊断中的价值探讨
邱艳华,陈秋雁,施黎炜,郑添秀,张德永,魏鼎泰*
作者单位:1.福建医科大学附属漳州市医院影像科,漳州 363000;2.宁德师范学院附属宁德市医院影像科,宁德 352100;3.宁德师范学院附属宁德市医院脑脉管性疾病与分子影像实验室,宁德 352100
0 前言
阿尔茨海默病(Alzheimer's disease, AD)作为一种进行性的、不可逆的中枢神经系统退行性疾病,起病隐匿,以渐进性认知障碍为主要临床表现,其主要神经病理特征是β 淀粉样蛋白在细胞外沉积及tau 蛋白以神经元纤维缠结的形式在细胞内积聚,脑神经细胞之间的联系被异常的蛋白质阻断,导致在大脑中传递信息的递质被破坏[1]。轻度认知障碍(mild cognitive impairment, MCI)是一种存在一个或多个领域认知功能损害而其他领域功能相对保存的综合征,但尚未达到痴呆的标准[2]。临床上最为常见的类型是遗忘型MCI,其主要临床表现为记忆力损害。MCI通常被认为是AD的一种前驱阶段,具有向AD转化的高风险[3]。
迄今为止临床上尚无有效治愈AD 的药物及手段。在AD的临床早期进行药物干预可在短期内改善认知功能,减缓疾病的进展;而在痴呆阶段药物治疗效果明显降低,对临床症状无明显的改善作用。目前我国大多数确诊AD 患者都处于痴呆阶段,存在不可逆的神经损伤,药物治疗效果差,若能在临床早期进行早期诊断及药物干预则可以很大程度上延缓病程的进展、减轻家庭负担。
目前,临床诊断AD 主要根据临床症状评估及神经心理学量表评分,这些信息的获取较方便,但具有主观性。而通过获取体液标志物和正电子发射断层成像(positron emission tomography, PET)可为AD的诊断提供更客观的依据[4]。但脑脊液检查及PET由于其侵入性、高成本等局限,在AD 的临床早期及MCI阶段尚未得到广泛的临床应用。因此临床工作中迫切需要一种能够无创、早期且准确的检查手段来识别MCI、AD,进一步指导临床治疗。有研究表明脑结构发生明显的形变前脑组织的功能已发生改变[5]。越来越多的证据表明AD 的潜伏期可长达几十年,其病理变化在症状出现前几十年就已经发生[6]。若能早期检测到脑功能的改变就能早期识别AD,从而进一步进行临床干预,可改善患者的认知功能。
1 材料与方法
1.1 研究对象
本研究纳入2020年6月至2021年12月在宁德市医院就诊患者共76名,经入组标准及排除标准筛选,最终纳入68名患者,分成两组,包括AD患者24名(AD组),MCI患者29名(MCI组);同时招募15名健康老年人作为正常对照(normal control, NC)组。本研究遵守《赫尔辛基宣言》,经宁德市医院伦理委员会批准,批准文号:20200901,全体受试者均签署了知情同意书。
纳入标准:(1)年龄范围在50~85 岁(包括50 岁和85 岁);(2)同意进行MRI 检查,并签署参与研究的知情同意书;(3)由符合伦理要求的家属陪同,可配合完成影像学检查,若无法一次全部检查完成者分成两次进行;(4)AD 组符合美国国立神经病学、语言障碍和卒中研究所、阿尔茨海默病和相关疾病协会“可能AD”诊断标准与统计手册第4次修订版AD诊断标准[16];MCI组符合Petersen的MCI诊断标准[17]。排除标准:(1)脑肿瘤性病变;(2)严重心血管疾病;(3)精神疾病病史及家族史;(4)既往脑外伤病史;(5)重大脑部疾病,如中枢神经系统感染性疾病、帕金森病、亨廷顿舞蹈症、癫痫、多发性硬化等脱髓鞘性疾病;(6)严重心肺/肝/肾/造血疾病;(7)图像存在伪影。
1.2 临床资料评估
对所有受试者均进行详细的病史采集,包括受试者的基本情况、性别、年龄、受教育年限、家族史、糖尿病、高血压病史等情况,并进行全面的体格检查。三组患者均采用简明精神状态检查(Mini-Mental State Examination, MMSE)量表评价认知功能状况。MMSE 量表包括定向力的检测、记忆力及回忆力的测评、简单的计算能力、语言及结构模仿视空间能力等项目,满分为30分。
1.3 影像学检查
1.3.1 扫描仪器
所有受试者均使用3.0 T磁共振成像(Discovery MR750 3.0 T)及配套8 通道头部专用正交线圈进行检查。为减少图像运动伪影的产生,在检查前使用泡沫垫固定受试者的头部,并在受试者双侧外耳道置入耳塞。
1.3.2 检查序列
T1WI、T2WI、T2- 液 体 衰 减 反 转 恢 复(fluid attenuated inversion recovery, FLAIR)、扩散加权成像(diffusion weighted imaging, DWI)、MB-DWI(b 值包括0、30、50、80、100、150、200、300、500、800、1000、1300、1700、2000、2500、3000、3500、4000、4500 s/mm2)、3D T1WI序列。
T1WI 序列扫描参数:FOV 24.0 cm×24.0 cm,层厚5 mm,间隔1.5 mm,TR 1750.0 ms,TE 24.0 ms,矩阵320×256,带宽41.67 kHz,扫描时间1 min 22 s;T2-FLAIR 序列扫描参数:FOV 24.0 cm×24.0 cm,层厚5 mm,间隔1.5 mm,TR 8400.0 ms,TE 145.0 ms,矩阵256×256,带宽62.5 kHz,扫描时间2 min 15 s;T2WI 序列扫描参数:FOV 24.0 cm×24.0 cm,层厚5 mm,间隔1.5 mm,TR 6051.0 ms,TE 93.0 ms,矩阵512×512,带宽83.3 kHz,扫描时间2 min 1 s; DWI序列扫描参数:FOV 24.0 cm×24.0 cm,层厚5 mm,间隔1.5 mm,TR 4000 ms,TE 65.7 ms,b=0、1000 s/mm2,带宽250.0 kHz,矩阵160×160,扫描时间32 s;MB-DWI 序列扫描参数:FOV 24.0 cm×24.0 cm,层厚5 mm,间隔1.5 mm,TR 2831.0 ms,TE 88.3 ms,矩阵128×128,带宽250.0 kHz,扫描时间6 min 24 s;3D T1WI 序列扫描参数:FOV 25.6 cm×25.6 cm,层厚 1 mm,间隔1.5 mm,TR 8.2 ms,TE 3.2 ms,矩阵256×256,带宽31.25 kHz,扫描时间4 min 19 s。
1.5 临床衰弱水平量表(CFS-7) 对老年衰弱患者死亡发生有较高的预测能力[17] 在老年综合评估(CGA)基础上,由临床医师根据日常活动能力和疾病程度做出分级,级别越高,衰弱程度越重。美国血管外科研讨会指出随着衰弱程度增加,老年人入住护理机构、死亡率增加,CFS可作为血管外科老年手术患者的衰弱评估工具[18]。但目前暂无研究指出CFS所评估的衰弱与血管外科术后不良事件存在何种相关性。亦有研究指出此方法复杂耗时,不适于术前评估[19]。
1.4 MRI图像后处理及数据采集
将所有受试者的原始MRI图像传输至图像存档与传输系统GE Aw Volume Share 5 工作站,应用Functool软件中的MADC及AQP对图像进行后处理,得到常规ADC 伪彩图、IVIM-D 伪彩图、IVIM-D*伪彩图、IVIM-f伪彩图、AQP-ADC伪彩图(图1)。常规ADC伪彩图使用的b值为0、1000 s/mm2,IVIM-D伪彩图、IVIM-D*伪彩图、IVIM-f 伪彩图选取的b 值为0~2000 s/mm2,AQP-ADC 伪彩图选取的b 值区间为2000~4500 s/mm2。常规ADC使用单指数模型,计算公式如下:
其中,S 为b 值的DWI 信号强度,S0为b0值得到的DWI信号强度。
使用所有DWI图像拟合成三指数模型,计算公式如下:
其中,当b 值<2000 s/mm2时,使用双指数方程进行拟合得到DWI 信号S;当b≥2000 s/mm2时,使用单指数方程来量化得到ADCuh(即AQP-ADC)。f为灌注分数,D反映了水分子随机运动的真实扩散系数,D*反映了水分子扩散的伪扩散系数。
结合常规T2-FLAIR及DWI图像,选择双侧大脑半球的额叶皮层、额叶白质、颞叶白质、顶叶白质、海马、丘脑、苍白球、尾状核等和认知功能密切相关的脑区(图2),选取感兴趣区(region of interest, ROI),分别测量三次,取其平均值,记录常规ADC值、IVIM-D值、IVIM-f值、AQP-ADC值。不同伪彩图上同一解剖部位尽量取相同部位并保持ROI大小一致,ROI的大小根据解剖位置而定,放置于信号较均匀部分,同时避开血管、扩大的血管周围淋巴间隙、脑脊液等区域。勾画ROI工作均由同一丰富神经影像诊断经验的医师在独立双盲(临床资料及影像资料)的情况下进行。
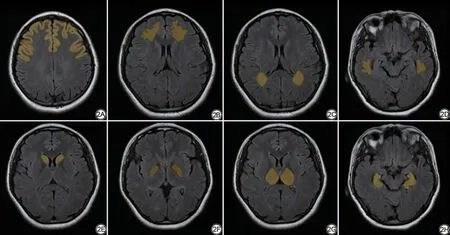
图2 各个脑区的感兴趣区取样范围。2A:额叶皮层;2B:额叶白质;2C:顶叶白质;2D:颞叶白质;2E:尾状核;2F:苍白球;2G:丘脑;2H:海马。Fig.2 Region of interest of each brain region.2A: Frontal cortex; 2B: Frontal white matter; 2C: Parietal white matter; 2D: Temporal white matter; 2E: Caudate nucleus; 2F: Globulus pallidus; 2G: Thalamus; 2H: Hippocampus.
1.5 统计学分析
应用SPSS 25.0软件进行统计学分析。年龄、受教育年限等临床资料、认知相关评分指标、常规ADC值、IVIM-D值、IVIM-f值、AQP-ADC值均以平均值±标准 差()表 示,采 用 单 因 素 方 差 分 析 或Cruskal-Wallis 秩和检验比较NC、MCI、AD 组受试者间年龄、受教育年限等临床资料、认知相关评分指标、常规ADC 值、IVIM-D 值、IVIM-f 值、AQP-ADC 值的差异,以P<0.05表示差异具有统计学意义。对差异具有统计学意义的指标用Bonferroni法进行两两比较。MB-DWI 相关指标与临床认知评分之间的相关性采用Pearson相关性分析法。
2 结果
2.1 基线资料及认知情况比较
本研究最终共纳入68名受试者,包括24名AD患者、29名MCI患者、15名NC受试者。受试者的临床基线资料列于表1。研究结果显示,年龄、体质量、受教育年限、性别存在组间差异。
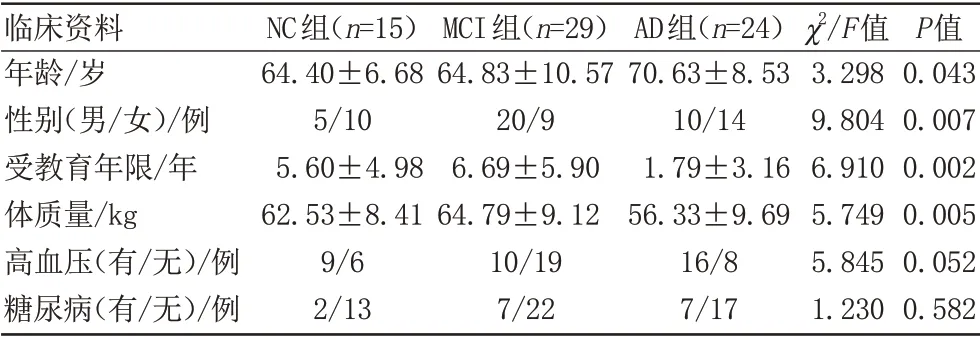
表1 临床基线资料分析Tab.1 Analysis of clinical baseline data
68 名受试者的认知情况对比,MMSE 评分、定向力、记忆力、计算力、回忆力、语言及结构模仿视空间均有组间差异(图3)。本研究在AD 与NC、MCI 三组的比较中,发现AD组患者的定向力、记忆力、计算力、回忆力、语言、结构模仿视空间均减退,MMSE 评分明显降低;而与NC 组相比,MCI 组患者主要表现为回忆力减退。
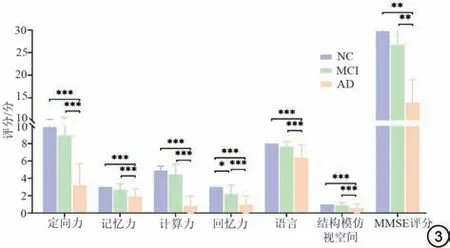
图3 认知评分的组间差异性对比。与NC 组相比,AD 组患者的定向力、记忆力、计算力、回忆力、语言、结构模仿视空间均减退,MMSE评分明显减低;而与NC 组相比,MCI 组患者主要表现为回忆力减退。NC:正常对照;AD:阿尔茨海默病;MMSE:简明精神状态检查;MCI:轻度认知障碍。Fig.3 Comparison of differences between groups in cognitive scores.Compared with the NC group, the orientation, memory, calculation, recall,language, and structure imitation of visual space in AD patients are reduced,and MMSE is significantly reduced.Compared with NC group, patients with MCI mainly show loss of recall.NC: normal control; AD: Alzheimer's disease;MMSE: Mini-Mental State Examination; MCI: mild cognitive impairment.
2.2 MB-DWI相关指标的比较
表2 列出了三组间有差异的MB-DWI 相关指标。在进行MCI和NC组的分析中,使用ADC未发现显著的差异,而在AQP-ADC值上发现了额叶皮层(右P=0.046;左P=0.016)、海马(右P=0.020;左P=0.022)、丘脑(右P=0.022;左P=0.001)及左侧颞叶白质(P=0.049)的显著差异。另外在IVIM 指标上,MCI 组海马(右P<0.001;左P<0.001)、丘脑(右P=0.001;左P=0.001)及颞叶白质(右P=0.043;左P=0.034)的IVIM-D 值显著升高,而IVIM-f 值上仅显示双侧额叶皮层(右P=0.036;左P=0.004)具有显著差异。

表2 NC、MCI、AD三组间MB-DWI相关指标的比较Tab.2 Comparison of MB-DWI related indicators between NC, MCI and AD group
相较于MCI 组,AD 组表现出额叶皮层(右P=0.017;左P=0.011)、右侧海马(P=0.001)及左侧顶叶白质(P=0.044)的AQP-ADC 值显著升高,而IVIM-D 分析上显示出额叶皮层(右P=0.002;左P=0.020)及左侧顶叶白质(P=0.017)具有显著差异,但ADC 值及IVIM-f值并未表现出差异性。
相较于MCI 组与NC 组,AD 组与NC 组更多部位表现出显著差异。相较于NC 组,AD 组的额叶皮层(右P=0.046;左P=0.019)及 海 马(右P=0.033;左P=0.006)的ADC 值的显著升高。AQP-ADC 分析显示,组间差异主要表现在额叶皮层(右P<0.001;左P<0.001)、颞叶白质(右P=0.002;左P<0.001)、顶叶白质(右P=0.040;左P=0.004)、海马(右P<0.001;左P<0.001)和丘脑(右P<0.001;左P=0.001)。IVIM-D 值的差异主要表现在额叶皮层(右P<0.001;左P=0.002)、颞叶白质(右P=0.008;左P=0.018)、海马(右P<0.001;左P<0.001)、丘脑(右P<0.001;左P<0.001)及左侧苍白球(P=0.036)。另外IVIM-f 值检测到两组间仅在额叶皮层(右P<0.001;左P<0.001)存在显著差异。
2.3 MB-DWI相关指标与认知评分之间的相关性分析
图4 显示了左海马、双侧丘脑的MB-DWI 相关指标与认知评分的相关性分析。左海马(r=0.452,P<0.001)、双侧丘脑(右r=0.392,P=0.001;左r=0.319,P=0.008)的AQP-ADC 值、双侧丘脑(右r=0.348,P=0.004;左r=0.306,P=0.011)的IVIM-D值与MMSE呈负相关,且差异具有统计学意义。另外,为了解MB-DWI相关指标对AD 患者的鉴别能力,本研究分别以非AD组(MCI组、NC组)为对照组、AD患者为病例组(图5A),以NC组为对照组、MCI与AD患者为病例组(图5B),以NC组为对照组、MCI患者为病例组(图5C)绘制受试者工作特性(receiver operating characteristic,ROC)曲线,比较左海马MB-DWI 相关指标检测AD 的曲线下面积(area under the curve, AUC)。结果(图5)显示,在三种ROC 曲线比较模式下,AQP-ADC 值、IVIM-D值的AUC均大于ADC值。且以NC组为对照组、MCI为病例组和以NC组为对照组、MCI与AD为病例组时,IVIM-D值与ADC值的AUC差异具有统计学意义。

图4 MB-DWI 相关指标与MMSE 评分之间的相关性分析。4A~4E 分别表示左海马(r=0.452,P<0.001)、双侧丘脑(右r=0.392,P=0.001;左r=0.319,P=0.008)的AQP-ADC 值、双侧丘脑(右r=0.348,P=0.004;左r=0.306,P=0.011)的IVIM-D 值与MMSE 评分呈负相关。MB-DWI:多b 值扩散加权成像;MMSE:简明精神状态检查;AQP-ADC:水通道蛋白相关表观扩散系数;IVIM-D:体素内不相干运动成像扩散系数。Fig.4 Correlation analysis between MB-DWI related indexes and MMSE score.4A-4E show the AQP-ADC value of left hippocampus (r=0.452, P<0.001),bilateral thalamus (right r=0.392, P=0.001; left r=0.319, P=0.008), the IVIM-D value of bilateral thalamus (right r=0.348, P=0.004; left r=0.306, P=0.011) is negatively correlated with MMSE.MB-DWI: muti-b value diffusion resonance imaging; MMSE: Mini-Mental State Examination; AQP-ADC: aquaporin-apparent diffusion coefficient; IVIM-D: intravoxel incoherent motion-diffusion coefficient.

图5 AQP-ADC、ADC、IVIM-D 及IVIM-f 区别非AD 和AD(5A)、NC 和MCI 与AD(5B)、NC 和MCI(5C)的ROC 曲线图。三种分组的ROC 曲线分析显示,AQP-ADC 值、IVIM-D 值的AUC均大于ADC值;且以NC组为对照组、MCI 为病例组和以NC 组为对照组、MCI 与AD 为病例组时,IVIM-D 值与ADC 值的AUC 差异具有统计学意义。AQP-ADC:水通道蛋白相关表观扩散系数;ADC:表观扩散系数;IVIM-D:体素内不相干运动成像扩散系数;IVIM-f:体素内不相干运动成像灌注分数;AD:阿尔茨海默病;NC:正常对照;MCI:轻度认知障碍;ROC:受试者工作特征;AUC:曲线下面积。Fig.5 ROC curves of AQP-ADC, ADC, IVIM-D and IVIM-f to distinguish between non-AD and AD (5A), NC and MCI & AD (5B), NC and MCI (5C).In the three ROC curve comparison modes, the AUC of the AQP-ADC value and the IVIM-D value are greater than the ADC value.When NC group is used as the control group, MCI as the case group, NC group as the control group, and MCI & AD as the case group, the difference between the AUC of IVIM-D value and ADC value is statistically significant.ADC: apparent diffusion coefficient; AQP-ADC: aquaporin-apparent diffusion coefficient; IVIM-D: intravoxel incoherent motion-diffusion coefficient; IVIM-D*: intravoxel incoherent motion-pseudo diffusion coefficient; IVIM-f: intravoxel incoherent motion-perfusion fraction; AD: Alzheimer's disease;NC: normal control; MCI: mild cognitive impairment; ROC: receiver operating characteristic; AUC: area under the curve.
3 讨论
AD作为一种神经系统退行性疾病,在结构上表现为弥漫性的脑萎缩,在临床上以记忆力下降、认知恶化、视空间障碍、执行力减退及精神和行为改变为主要表现[18]。但仅依靠常规MRI 和临床表现难以对AD进行确切诊断,更无法早期识别临床早期的AD或MCI患者,而功能磁共振成像(functional MRI, fMRI)通过无创性反映活体脑组织功能改变,为AD 的更早期诊断提供客观依据。本研究采用MB-DWI 技术,选择额叶皮层、额顶颞叶白质、海马、丘脑、苍白球、尾状核等和认知功能密切相关的脑区为ROI[19],通过测量AQP-ADC 值、ADC 值、IVIM-D 值及IVIM-f 值分析细胞功能改变,评估AD 患者和MCI 患者脑组织功能的变化,以探索其在AD疾病进展中的评估价值。
3.1 MB-DWI 相较于DWI 对AD 脑功能改变的检出更具敏感性
在使用ADC 值分析中发现AD 组海马的ADC 值明显高于NC 组,却未发现NC 组与MCI 组在ADC 值上的明显差异。既往研究表明海马ADC 值可预测遗忘性MCI进展成AD,比海马萎缩及早期神经退行性变更敏感[20]。但在本研究中,海马ADC 值在AD 患者与MCI 患者中并没有明显差异,且在AD 的疾病早期或MCI 阶段的检出中也具有一定的局限性。而在使用MB-DWI相关指标分析中,MCI 组和NC 组之间显示出海马AQP-ADC 值、IVIM-D 值的差异性,这说明MB-DWI 对AD的疾病早期或MCI阶段的检出上具有一定的敏感性。
研究结果显示相较于临床常规使用的DWI,MB-DWI 能够检测到MCI 患者、AD 患者多个脑区的显著差异。在本研究中,MCI 患者的额叶皮层、丘脑的AQP-ADC 值、IVIM-D 值相比于NC 组明显升高。大量的研究证实AD患者最早出现脑萎缩的部位为内侧颞叶,其中以海马及内嗅皮层为著[21],然后逐渐蔓延到大部分颞叶以及后扣带回,最后影响到顶叶、额叶等其他脑区[22]。根据这一观点,额叶皮层的改变应出现在AD 的晚期。但众所周知,前额叶皮层涉及到注意力、执行力等方面的指挥过程;额叶皮层也被认为通过杏仁核及其他边缘系统的连接在情绪、行为调节等方面中起重要作用[23]。此外,在即将转化为AD 的MCI 患者的基于体素的形态学测量相关分析中也发现了额叶皮层的体积减小[24],这些结果表明额叶皮层的改变不仅仅出现在AD 的晚期。本研究MCI 患者额叶皮层MB-DWI相关指标的改变可能是由于杏仁核内在功能连接在疾病早期就已经受到损害。另外值得关注的是,丘脑的AQP-ADC 值、IVIM-D 值在MCI 阶段就出现明显的改变,这与丘脑可能参与AD 的临床早期或MCI 阶段的相关研究具有一致性[25-26]。随着AD疾病的进展,与NC组相比,AD组表现更多部位的显著差异,主要位于额叶皮层、颞叶白质、顶叶白质、海马、丘脑,而这些区域被认为是与AD病理相关的主要区域[27-28]。这些研究结果表明,MB-DWI 可从微观分子水平评估AD 的疾病进展,与标准神经成像生物标志物提供互补信息,有可能成为AD 的更早期影像检查手段。
3.2 MB-DWI相关指标对AD脑功能的评价
既往研究表明,AD 的发生与Aβ 淀粉样蛋白的沉积密切相关[29],即Aβ 淀粉样蛋白产生和清除的不平衡,这也被认为是突触功能损害及记忆丧失的原因[30-31]。Aβ 淀粉样蛋白清除率的损害可能是AD 发生的关键因素。动物实验的研究结果表明,在Aβ 淀粉样蛋白清除过程中,AQP4 起着不可或缺的重要作用[32]。AQP4 作为类淋巴系统的关键组成部分,通常在脑实质和间质液之间的边界高度表达[33],而这种极化的分布模式是星形胶质细胞发挥其功能及维持脑稳态的基础[34]。本研究中观察到的AD 患者大脑AQP-ADC值的显著改变,一定程度上反映了AQP4水平的改变,这与之前的研究结果是相似的[35]。且本研究中AD 疾病进展过程中累及的部位与Braak 分期方案所描述的神经元纤维缠结增加的典型模式相匹配[36]。本研究中AQP-ADC 值相较于常规ADC 可在多个脑叶白质中显示出差异,这与高b值DWI在显示AD白质变性时更为敏感的研究是一致的[37]。愈来愈多的证据表明,AQP4在AD的发病机制中至关重要,这提示我们AQP4有望成为AD预防和治疗的新靶点。水通道蛋白成像技术以AQPs 为成像基础,从细胞和分子水平无创、在体获取细胞膜上AQPs 信息,有可能成为AD 新的影像学生物标志物。
而在使用IVIM-D 分析AD 疾病进展过程中,本研究也发现了与AQP-ADC指标相似的结果。病理上,AD患者大脑中细胞内外异常蛋白的沉积导致细胞膜破坏、髓鞘和轴突丢失,进而形成细胞体损伤和灰质萎缩,最终表现为水分子扩散率的增加即ADC 值增高[38]。与ADC 值相比,基于不同拟合算法得出的IVIM-D 通过分离出微循环灌注的扩散信息,更能够反映水分子真实的扩散运动。近年来,AD 早期阶段的脑组织突触功能改变成为研究的热点。有研究表明AD患者在临床早期突触功能的损伤导致以致密核心囊泡分泌物质为主的多种蛋白的分泌减少,而这些蛋白主要分布在Aβ斑块周围的营养不良性神经突起和反应性星形胶质细胞中[30],这可能是MCI 患者部分脑区IVIM-D 值增高的原因。但目前国内外有关IVIM-D 评估AD 脑组织功能改变的研究报道尚少,且样本量均较小,并与本研究结果存在一定的差异性[19,39],这可能是由于b 值的设置存在不足。应用b值的使用数量和分布的不同会影响参数的精确性,因此IVIM衍生的参数和映射是高度可变的和不一致的[40]。本研究使用IVIM-D值探究AD疾病进展过程中水分子的扩散情况变化,试图从细胞和亚细胞水平分析AD 患者脑组织的微观改变,并发现IVIM-D 在评估AD 上显示出一定的优势。但为了明确IVIM 在AD临床诊断中的价值,还需探究b值的最优化方案。
另外,本研究在IVIM-f 值的分析中,仅发现MCI患者、AD 患者的额叶皮层的IVIM-f 值明显增高。在目前的AD标准生物标志物模型中,PET被认为是评估AD 脑代谢及灌注的主要神经功能成像工具[41]。但由于其有创性及放射性核素的使用,其在临床应用上受到了限制。有研究表明AD患者的脑血流量随着疾病的进展呈进行性地下降[42],特别是在即将转化成AD 的MCI 患者表现出了海马及前额叶皮层等区域的脑血流量明显减低[43]。但有部分研究结果显示AD患者额叶的灌注是呈增高改变[44]。而FEDERAU 等[45]在验证IVIM-f的准确性时,发现IVIM-f与动态对比增强灌注加权成像(dynamic contrast enhanced perfusion weighted imaging, DCE-PWI)在评估相对脑血容量方面具有良好的一致性,因此有理由相信IVIM-f是具有可靠性的。AD 被认为是与神经炎症相关的一种退行性疾病,小胶质细胞的异常活化与炎症因子的过度释放激活下游信号通路,进而产生级联反应导致中枢神经系统炎症的发生[46]。而一些细胞因子的产生如肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-1β(interleukin-1β, IL-1β)、血管内皮生长因子(vascular endothelial growth factor, VEGF)能促进AD 神经病理相关的区域的血管生成[47]。本研究中在MCI患者、AD患者中也发现了额叶皮层的IVIM-f值的升高,推测这可能与细胞因子介导的微血管密度增高有关。但本研究仅发现个别部位的IVIM-f值具有差异性,我们分析研究结果显示IVIM-f与预期结果不相符的原因可能为:(1)IVIM-DWI 相关量化参数的敏感度会因血管粗细、小血管的黏度、湍流等因素而变化[48];(2)相较于IVIM-D 参数,IVIM-f 参数的可重复性存在不足[49]。
3.3 MB-DWI相关指标在临床认知功能评估中的应用
水分子的跨膜转运在细胞维持生理功能中起着不可或缺的作用。MB-DWI 技术基于完全内源性自体报告基团,通过三指数模型算法,得到更全面的水分子跨膜转运信息,可从亚细胞水平感知脑功能的改变,从而更准确地反映AD 患者脑功能改变。本研究中MB-DWI 能够检测到MCI 患者、AD 患者多个脑区的显著差异,这表明MB-DWI 在AD 的影像评估方面中具有显著优势,可为MR分子成像技术提供新的路径。
为了进一步探索左海马、双侧丘脑的ADC 值、AQP-ADC 值、IVIM-D 值、IVIM-f 值的改变与AD 临床认知严重程度是否具有一致性,本研究还进行了上述指标与认知评分之间的相关性分析。研究结果显示左海马、双侧丘脑的AQP-ADC 值、双侧丘脑的IVIM-D值与MMSE 评分呈负相关,这表明MB-DWI 相关指标在AD 疾病的评估上具有临床价值。但本研究未排除临床相关因素带来的影响,下一步将纳入受教育年限等临床因素进行多重线性回归分析。MB-DWI 技术目前仍处于实验阶段,尚未应用于临床,因此未来还需进行更多的临床及动物研究来验证其在AD临床诊断中的价值。
此外,本研究仍存在许多局限性:(1)病例数不足,因公众对痴呆认识不足,临床就诊的痴呆患者多以其他疾病为主诉就医,部分患者无法接受MRI 检查;另因痴呆患者的认知障碍,多数患者无法配合MRI 检查;(2)本研究纳入的受试者缺乏AD 诊断的生物标志物检查及载脂蛋白E 基因检测;(3)本研究是一项横断面的研究,为进一步验证相关指标的评价价值,需长期对患者的影像学检查及认知功能进行随访;(4)本研究中的多种影像数据经软件后处理后,采用手动采集,ROI 的选取存在主观因素,对结果存在一定的影响;(5)脑白质变性的程度受到很多临床因素影响,这些临床因素的影响在本研究中没有得到纠正;(6)MRI 层厚较厚,部分小结构不能完全显示,如杏仁核等小核团。为了精准地评估MB-DWI 技术在AD、MCI 患者早期诊断的临床价值,下一步研究应当扩大病例样本量,尽可能采集全面的临床指标、纳入多个深部核团,完善临床各种认知评估量表,并完善MRI参数。
4 结论
综上所述,相较于常规ADC,MB-DWI 对AD 的诊断具有明显的优越性,特别是提供了MCI阶段的额外信息,本研究中MB-DWI 相关指标与认知相关评分呈负相关改变,这些结果表明MB-DWI 相关指标在AD 疾病的评估上具有临床价值,MB-DWI 可能成为AD 相关病理生理改变的另一个早期生物标志物和疾病进展的衡量指标。MB-DWI 可能从细胞和分子水平的微观改变反映AD 疾病的病理生理改变,其中AQP4 作为重要参与部分,有望成为AD预防和治疗的新靶点。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:魏鼎泰设计本研究的方案,对稿件重要内容进行了修改,获得了福建省自然科学基金科技项目、2020 年宁德师范学院创新团队专项项目的资助;邱艳华参与选题和设计,采集数据、参与资料的分析与解释,撰写论文并对学术内容的重要方面进行了关键修改;陈秋雁、施黎炜、郑添秀、张德永参与选题和设计,采集数据、参与资料的分析与解释,对最终要发表的论文版本进行了全面的审阅和把关;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

