梨园土壤中梨火疫病菌存活时间研究
李晓妹 韩丽丽 陈卫民

摘要为探究发病梨园土壤中是否存在梨火疫病菌 Erwinia amylovora 以及在土壤中的存活时间,2020—2021年,在新疆库尔勒市梨园采集土壤,利用划线分离法,采用 Zeller 选择性培养基从中分离病原细菌,并结合形态鉴定、PCR 检测和致病性测试结果确认梨火疫病菌 E.amylovora,并对自然土壤中的E.amylovora持续分离。结果表明,发病梨园土壤中存在梨火疫病菌。梨火疫病菌在土壤中存活时间可长达 550 d,且分离菌株仍具有明显的致病性。该试验对库尔勒市梨园土壤中E.amylovora的是否存在和存活时间进行研究,其结果对土壤作为E.amylovora传播源的风险性评估具有重要理论意义,为梨火疫病的有效防控提供科学依据。
关键词土壤;Erwinia amylovora;存活时间;PCR;致病性;测试
中图分类号S 436.6文献标识码A
文章编号0517-6611(2023)24-0127-04
doi:10.3969/j.issn.0517-6611.2023.24.027
Study on Survival Time of Erwinia amylovora in Soil of Fragrant Pear Orchard
LI Xiaomei1,HAN Lili2,CHEN Weimin2
(1.College of Agronomy,Xinjiang Agricultural University,Urumqi,Xinjiang 830052;2.Xinjiang Yili Vocational and Technical College,Yining,Xinjiang 835000)
AbstractIn order to explore the existence of Erwinia amylovora in the soil of the diseased pear orchard and its survival time in the soil,from 2020 to 2021,soil was collected in the pear orchard of Korla City,Xinjiang,and the pathogenic bacteria were isolated by Zeller selective medium by streak separation method,and the pear fire blight bacterium E.amylovora was confirmed by combination of morphological identification,PCR detection and pathogenic test results,and E.amylovora in natural soil was continuously isolated.The results showed that there were pear fire blights in the soil of the diseased pear orchards.Pear fire blight bacteria could survive in soil for up to 550 days,and isolated strains remained significantly pathogenic.In this study,the existence and survival time of E.amylovora in the soil of pear orchards in Korla City were studied,and the results had important theoretical significance for the risk assessment of soil as the source of E.amylovora transmission,and provided a scientific basis for the effective prevention and control of pear fire blight.
Key wordsSoil;Erwinia amylovora;Survival time;PCR;Pathogenicity;Test
梨火疫病是一種重大的国际检疫性病害,由解淀粉欧文氏菌 (Erwinia amylovora)引起,该病害不仅对梨树造成毁灭性的危害,还可危害苹果、山楂、海棠、榅桲等多种蔷薇科果树,具有传播速度快、传播途径多样化、危害严重和难以根治等特点,其在世界范围内对重要果树造成了巨大的产量损失[1-5]。梨火疫病菌可通过梨树的花、果实、叶片、枝条、砧木等侵染[6-8]。梨火疫病在梨园中的传播主要是依靠果农对病树的修枝剪和风雨等对果树造成的伤口入侵,还可依靠昆虫和飞鸟的传播[9-10]。溃疡斑处的菌脓可以随雨水的冲击飞溅至其他果树,还可随雨水流动汇集于土壤表层。梨火疫病的传播速度较快,除人为因素干扰外,自然状态下梨火疫病的传播速度每年16 km,由果树贸易及观赏植物的引进等因素传播速度每年可达100 km[10]。
2016年5月梨火疫病首次在我国新疆伊犁霍城县发生,现已传播至新疆14个地州,严重危害梨、苹果、山楂、海棠、榅桲等果树,尤其是在库尔勒香梨上传播极为迅速,对新疆乃至全国林果产业带来严重威胁[11]。笔者以新疆库尔勒市重度发病香梨园土壤为试材,通过对土壤中梨火疫病菌的分离、致病性测试以及接种致病菌样品的PCR扩增,明确梨火疫病菌能否在土壤中存活及存活时间,为该病害的传播及防控对策研究提供理论依据。
1材料与方法
1.1材料
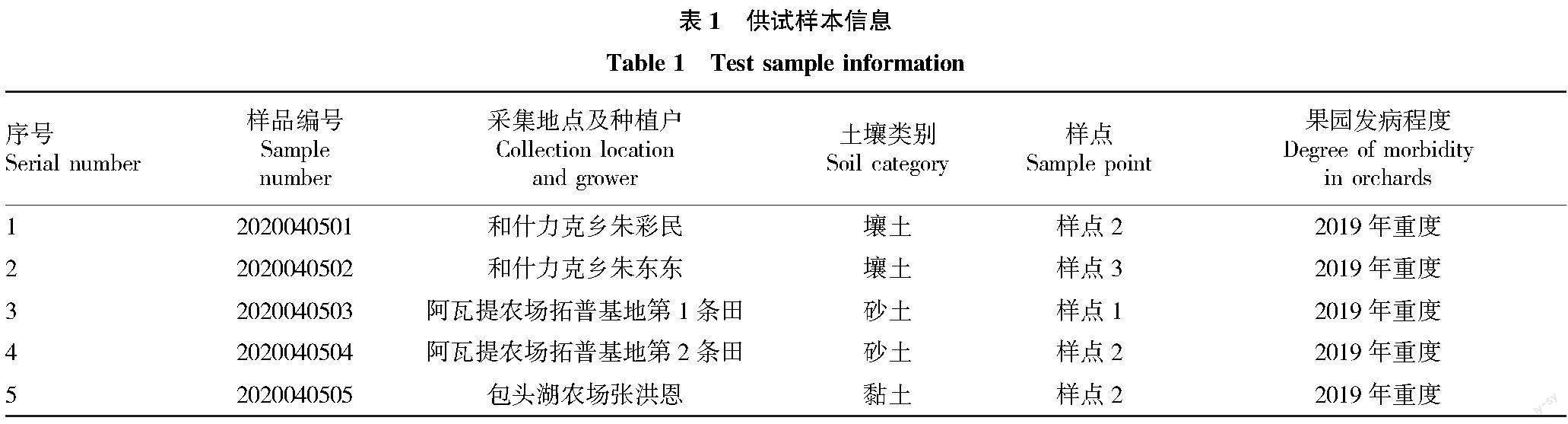
1.1.1土壤样品。2020年4月5日在新疆库尔勒市5个香梨园中采集土壤样品(表1)。
1.1.2培养基。
Zeller改良高糖培养基:牛肉膏8 g,蔗糖50 g,放线菌酮50 mg,0.5%溴百里酚蓝9 mL,0.5%中性红2.5 mL,琼脂18 g,水1 000 mL,pH 7.4。
液体培养采用营养肉汤培养基(NB)+5% 蔗糖培养基:牛肉浸膏 1 g,酵母膏 2 g,蛋白胨 5 g,氯化钠 5 g,蔗糖 50 g,水1 000 mL,pH 7.2。
1.1.3致病性测定供试材料。
采集库尔勒市绿化4队行道树上未喷任何药剂、健康的当年生香梨树嫩叶片、幼果,供离体接种使用。
1.1.4主要试剂及仪器。
细菌基因组 DNA 提取试剂盒(目录号:DP302;生产商:天根公司),2×Taq PCR mix(TANGEN,PER008-1)、ddH2O、DL5000 Marker、1×TAE缓冲液琼脂糖、GenGreen 核酸染料(TANGEN,GG1301-500UL)、VERITI 2.0 PCR 扩增仪,美国 Allen-Bradley 公司;AIIegra 25R 高速 冷冻离心机,美国贝克曼公司;HE99 电泳仪,美国 General Electric 公司;OD600 DiluPhotometerTM分 光光度计,德国 Implen 公司;G:BO× EF 凝胶成像系统,英国 Syngene 公司;Climacell 404 培养箱, 德国 MMM 公司。
1.2方法
1.2.1土壤采集及制备。
2020 年 4 月 5 日,在新疆库尔勒市随机选取5个发病程度为重度的香梨园,使用土壤采集器在田间采用对角线法采集土样,采集深度为0~10 cm 。每个香梨园采集5个样点,每个样点采集300 g土样,共25份土壤样本。实验室内分别对各样地采集的土壤样本进行混合、过筛(10目),去除样本中的杂质后采用四分法取样500 g,密封于土壤采集袋中,常温保存备用。
1.2.2土壤中病原菌分离及纯化。
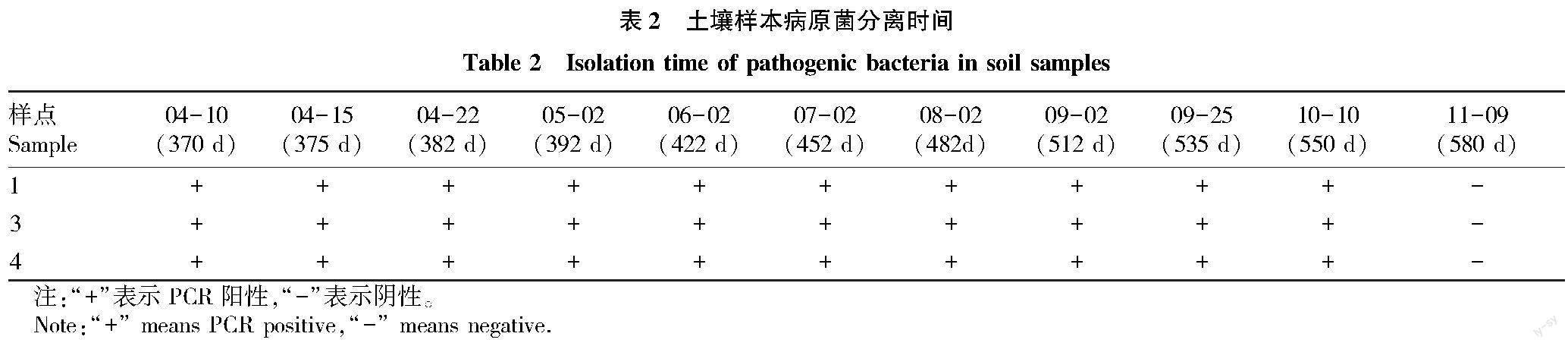
病原菌分离时间为2021年4月10日、4月15日、4月22日、5月2日、6月2日、7月2日、8月2日、9月2日、9月25日、10月10日。
每份土壤样本各取30 g分别倒入500 mL灭菌三角烧杯中加入200 mL无菌水进行浸泡,静置12 h后,各取2 mL浸出液于离心管中,12 000 r/min离心5 min,去上清液后加入100 μL无菌水悬浮,接种环蘸取悬浮液于 Zeller 改良高糖培养基平板上划线分离;28 ℃、光照12 h/黑暗12 h,培养24~48 h后观察有无疑似菌落。挑取菌落呈橙红色半球形,高度凸起,中心色深,有蛋黄状中心环,表面光滑,边缘整齐疑似梨火疫病菌的单菌落在选择性培养基Zeller上进行纯培养,培养3次后,保存,用于后续测试。
1.2.3PCR检测。
参考贾平乔等[12]建立的梨火疫病菌的巢式PCR检测技术,对分离菌株提取DNA,第一轮引物为P29A/P29B,第二轮引物为PEANT1/PEANT2。PCR反应体系参照试剂盒2×Taq PCR mix (天根生化科技(北京)有限公司)进行。体系为25 μL:2×Taq PCR mix 12.5 μL、上下游引物(10 μmol/L)各1.0 μL、1.0 μL DNA、9.5 μL ddH2O;反应程序:95 ℃预变性5 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃ 延伸90 s,30个循环;72 ℃ 延伸5 min。扩增产物用1%琼脂糖凝胶1×TAE缓冲液电泳,SYBR Green核酸染料染色后用凝胶成像系统分析。
1.2.4接种菌悬液制备。
分离物转皿于Zeller 改良高糖培养基平板上,28 ℃、光照12 h/黑暗12 h,培养 48 h。挑取单菌落接种NB液体培养基,28 ℃,相对湿度75%,150 r/min振荡培养 12 h后,利用紫外分光光度计测定将OD600为0.4的菌液作为接种菌悬液。
1.2.5致病性测试。
以土壤中分离所得的梨火疫病菌菌株,制备浓度为 1×108CFU/mL 的接种菌液,接种于健康香梨叶片和香梨幼果上,用灭菌水作空白对照。
离体叶片接种,在叶片基部的叶柄上用无菌注射器针头针刺叶脉后,移液器取1 μL菌液滴在伤口处,接种香梨叶片置于灭菌培养皿中, 28 ℃保濕培养;梨幼果接种,先对待接种的梨幼果用 75%乙醇浸泡 10 min,无菌水冲洗 3 次后,轻轻擦拭干净,用灭菌的解剖刀纵切为二,灭菌牙签蘸取菌悬液,在香梨果纵切面上均匀接种 6 个点,置灭菌培养皿中 28 ℃保湿培养,定时观察记录接种叶片和幼果的发病情况。并对发病杏叶症状组织进行病菌的再分离培养和检测。
2结果与分析
2.1病原菌分离结果
2020年4月5日采集的土壤,在2021年4月10日进行第一次划线分离,检测为阳性的共3个土壤样品,样品编号为2020040501(壤土)、2020040503(砂土)、2020040504(砂土)。2021年10月10日(550 d)时再次进行病原菌分离,经病原形态鉴定(图1)、PCR检测及致病性测定确定仍有病原菌存活且具有致病性,但在2021年11月9日(580 d)第11次病菌分离时,连续分离了3次都未分离出病原菌,证实该病菌可在土壤中存活550 d(表2)。
2.2致病性测试结果
将2020040501(壤土)、2020040503(砂土)、2020040504(砂土)3个土壤样品最后一次分离菌株制备成接种菌悬液(1×108 CFU/mL),针刺接种于香梨叶片、幼果,离体叶片、幼果接种后24 h均开始发病,接种点处有菌脓产生。对照无明显变化(图2)。
2.3PCR检测结果
2021年4月10日分离菌株编号为2020040501、2020040503、2020040504,其土壤样品分离病原菌接种香梨树叶片,取发病的叶片巢式PCR检测结果为阳性(图3)。2021年10月10日再次分离土壤样品病原菌接种香梨树叶片,经巢式PCR检测仍为阳性。2次土壤样品PCR检测均为阳性,说明土壤中分离的梨火疫病菌具有致病性(图4)。
3结论与讨论
3.1讨论
2020年4月5日采集的土壤,经过2021年4月10日划线分离及PCR检测为阳性的3个土壤样品,2021年10月10日(550 d)对3个土壤样品再次进行病原菌分离时,经病原形态鉴定、PCR检测及致病性测定确定仍有病原菌存活且具有致病性,但在2021年11月9日(580 d)第11次病菌分离时,连续分离了3次均未分离出病原菌,证实该病菌可在土壤中存活550 d。土壤样本保存于常温密闭土壤采集袋中,试验在采集土壤过程中去除沙石、枯枝等杂物以保持土壤的均一性,但土壤中微小的病残体、杂物、腐殖质等有机成分依然存在,可能给病原菌提供了生存的条件。因此病原菌可在土壤中长时间存活,侵染条件合适情况下,病原菌通过梨园土壤传播的风险依然较大。
研究表明,烟草青枯病菌在病残体中存活时间可达210 d 左右,有些甚至在土壤和堆肥中可存活8~25年,但当处于干燥的环境条件下会很快死亡,附着于种子表面的病菌2 d后即可全部死亡[13-14]。土壤是土传病原细菌生命周期中的一个重要生活环境,一旦寄主植物死亡或不存在时,病原细菌可以通过改变当前细胞生活状态从而延长其在土壤或水环境中存活时间,一旦感知到寄主植物存在时,它们将从土壤转移到寄主根系,然后在根表定殖并吸附植物皮层,随后分泌致病因子穿透木质部,进入寄主体内繁殖,最终随着寄主植物的死亡再次返回到土壤环境当中。土壤病原细菌对植物的侵染是一个时空动态过程,其涉及病原菌与土壤生物和非生物因素之间的相互协同互作。土壤环境本身的复杂性以及病原菌与环境之间的相互作用是制约土传病原菌控制效率的关键因素[15]。
3.2结论
试验通过对梨园土壤浸出液进行室内划线分离、致病性测试以及PCR检测,证实新疆库尔勒市发病梨园土壤中存在梨火疫病菌。采集的土壤样品常温保存于实验室内,土壤中的梨火疫病菌存活时间可达550 d且具有致病性。
参考文献
[1]胡白石,许志刚,周国梁,等.梨火疫病的进境风险分析[J].植物保护学报,2001,28(4):303-308.
[2] 全国农业技术推广服务中心.植物检疫性有害生物图鉴[M].北京:中国农业出版社,2001.
[3] 梁慧敏,刘君,王希东,等.梨火疫病抑菌制剂的室内筛选[J].新疆农业科学,2019,56(2):333-344.
[4] AC′IMOVIC′,S G,ZENG Q,MCGHEE G C,et al.Control of fire blight (Erwinia amylovora) on apple trees with trunkinjected plant resistance inducers and antibiotics and assessment of induction of pathogenesisrelated protein genes[J].Front Plant Sci,2015,6:1-10.
[5] BADOSA E,MONTESINOS L,CAM C,et al.Control of fire blight infections with synthetic peptides that elicit plant defense responses[J].J Plant Pathol,2017,99:65-73.
[6] EASTGATE J A.Erwinia amylovora:The molecular basis of fireblight disease[J].Mol Plant Pathol,2000,1(6):325-329.
[7] CROSSE J E,BENNETT M,GARRETT C M E.Investigation of fireblight of pear in England[J].Ann Appl Biol,1960,48(3):541-558.
[8] BAHADOU S A,OUIJJA A,KARFACH A,et al.New potential bacterial antagonists for the biocontrol of fire blight disease (Erwinia amylovora) in Morocco[J].Microb Pathog,2018,117:7-15.
[9] BILLING E.Fireblight Erwinia amylovora and weather:A comparison of warning systems[J].Ann Appl Biol,1980,95(3):365-377.
[10] CUI Z Q,HUNTLEY R B,ZENG Q,et al.Temporal and spatial dynamics in the apple flower microbiome in the presence of the phytopathogen Erwinia amylovora[J].ISME J,2021,15(1):318-329.
[11] 李晓妹,韩丽丽,何亚南,等.20个苹果品种(类型)对梨火疫病菌的抗病性评价[J].植物检疫,2022,36(4):6-12.
[12] 贾平乔,周国梁,吴杏霞,等.进境苹果果实中梨火疫病菌的套式PCR检测[J].植物病理学报,2009,39(5):1-9.
[13] 霍沁建,张深,王若焱.烟草青枯病研究進展[J].中国农学通报,2007,23(8):364-368.
[14] 黎妍妍,王昌军,黄俊斌,等.烟草青枯病灾变原因剖析[J].安徽农业科学,2016,44(29):127-129,133.
[15] 韦中,王佳宁,江高飞,等.土传病原细菌的生存与致病权衡[J].土壤学报,2022,59(2):324-333.

