艾叶及其燃烧产物的化学成分研究进展
高鹏 陈利军 王喆之 王世强 牛俊峰

摘要艾为我国传统中药,主要含有挥发油类、黄酮类、苯丙素类及萜类等化学成分,具有平喘镇咳、抗肿瘤、抗炎、抗菌抗病毒、抗氧化等多种药理活性。艾叶晒干捣碎得艾绒,艾绒燃烧物艾烟中主要成分有呋喃类、芳香类、酯类、烷烃或含羟基类化合物,具有抗真菌及病毒、抗衰老和调节脂质代谢作用。综述了艾叶及艾烟的化学成分和药理作用的研究进展,为艾叶的开发利用提供依据。
关键词艾叶;燃烧产物;化学成分;药理作用
中图分类号R 284.1文献标识码A
文章编号0517-6611(2023)24-0019-05
doi:10.3969/j.issn.0517-6611.2023.24.004
开放科学(资源服务)标识码(OSID):
Research Progress on Chemical Constituents of Artemisia argyi and Its Combustion Product
GAO Peng1,2,CHEN Lijun1,2,WANG Zhezhi1,2 et al
(1.National Engineering Laboratory for Resource Development of Endangered Chinese Crude Drugs in Northwest of China,College of Life Sciences,Shaanxi Normal University,Xian Shaanxi 710119;2.Key Laboratory of Medicinal Resources and Natural Pharmaceutical Chemistry,Ministry of Education College of Life Sciences,Shaanxi Normal University,Xian Shaanxi 710119)
AbstractArtemisia argyi Lévl.et.Vant.is a traditional Chinese medicine in China.Its chemical components mainly include essential oil,flavonoids,phenylpropanoids and terpenoids,etc.It has various pharmacological activities such as antiasthmatic and antitussive,antitumor,antiinflammatory,antibacterial and antiviral,and antioxidation.Artemisia argyi is dried and mashed to make argyi.The main components of combustion product of Artemisia argyi are furans,aromatic,esters,alkanes or hydroxyl compounds,which have the functions of antifungal and virus,antiaging and regulating lipid metabolism.This paper reviewed the research progress on the chemical constituents and pharmacological action of Artemisia argyi and its combustion product,in order to provide the basis for the developmen utilization of Artemisia argyi.
Key wordsArtemisia argyi;Combustion products;Chemical composition;Pharmacological effects
艾叶为菊科植物艾(Artemisia argyi Lévl.et.Vant.)的干燥叶,又名冰台、艾蒿、炙草、医草、蕲艾、黄草、家艾、甜艾等。性温,味苦、辛,归肝、脾、肾经,具有驱寒止痛、调经止血、止咳平喘、杀虫祛痒的作用[1]。近年来,随着艾叶药理作用研究的深入,以及提取技术和气相色谱质谱联用、液相色谱质谱联用等分离分析技术日益成熟,对艾叶中化学成分的研究更加全面深入,获得鉴定了多种化合物。艾叶晒干捣碎后得到艾绒,点燃后可用于艾灸,生成的艾烟具有抗病毒、抗衰老和调节脂质代谢作用。目前艾烟的检测仪器和检测方法也在不断进步,对其中的有效成分、有害成分、治疗效果和对人体产生的不良反应也有了更深的认识。基于此,综述了艾叶及艾烟的化学成分和药理作用的研究进展,以期为艾叶的开发利用提供依据。
1艾叶研究概况
1.1艾叶化学成分
艾叶中主要化学成分有挥发油、黄酮类、萜类、 苯丙素类、有机酸类、甾体类、多糖类及微量元素等。
1.1.1挥发油。
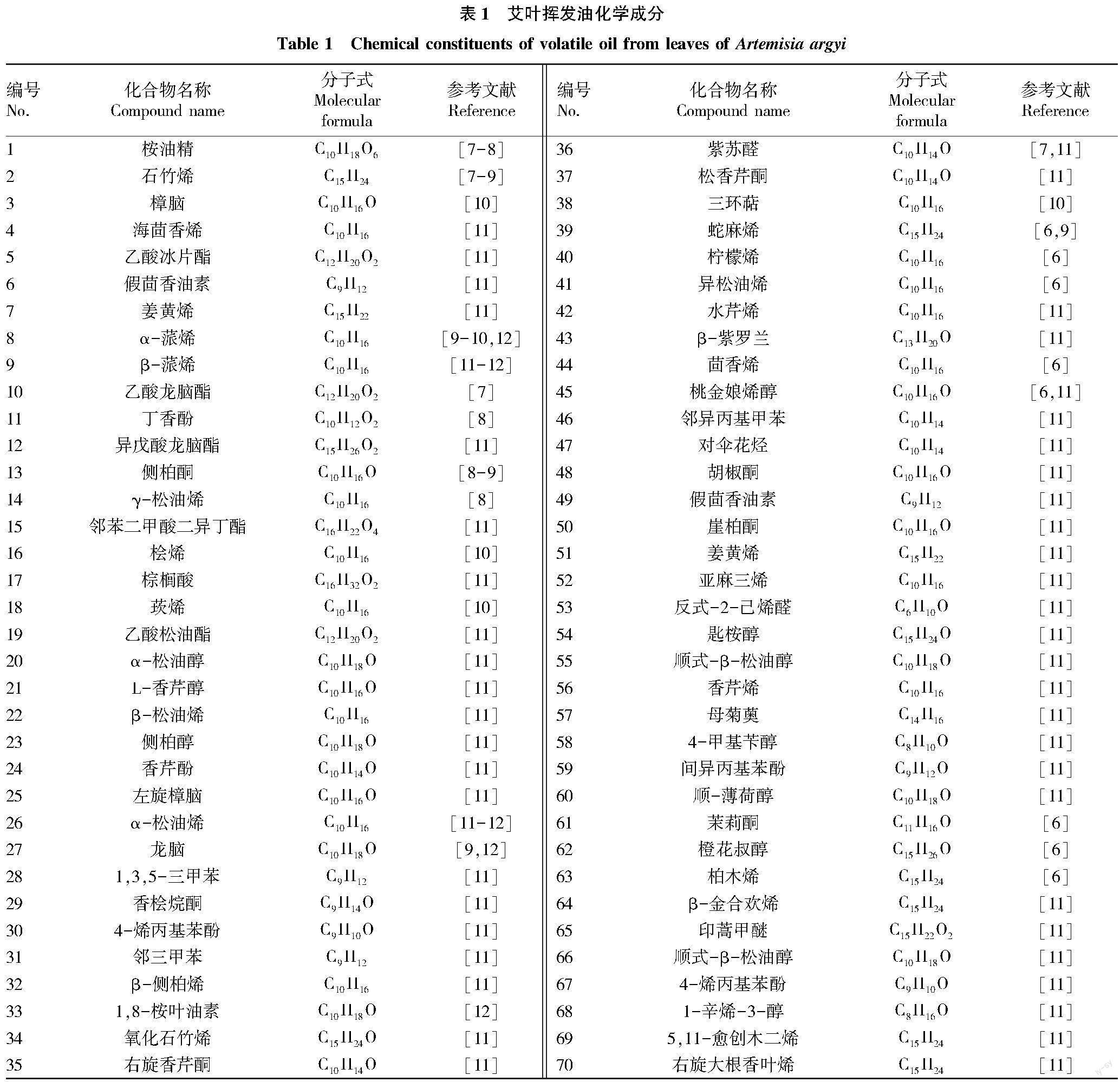
艾叶中发挥主要药理作用的成分是挥发油类,其中发揮作用的化学成分主要有桉油精、龙脑、樟脑、石竹烯等,主要的有害成分为侧柏酮[2],该物质浓度过高会引起呼吸系统的损伤。在生产过程中影响挥发油含量和成分的主要因素有提取时间、料液比、提取温度等[3]。而不同产地、提取方法、采摘时间、炮制以及存储条件也是影响艾叶挥发油的化学成分与含量的因素[4]。采用气相色谱-质谱联用技术分析艾叶挥发油的化学成分,测得其中有醚类、醇类、倍半萜类、酯类、单萜类、酮类、芳香族化合物[5]。目前有学者已经从湖北蕲春、山西、湖南等地的艾叶样品中鉴定出180个挥发性成分[6],表1列举了其中的70种常见活性成分。
1.1.2黄酮类。
黄酮类物质普遍存在于多种中草药,是一类主要的抗氧化物质,从艾叶中共分离得到51个黄酮类化合物,主要为黄酮、黄酮醇及其苷、二氢黄酮、黄烷酮、查耳酮等[13]。艾叶黄酮类化合物有效成分主要有5,7- 二羟基-6,3′,4′-三甲氧基黄酮(eupatilin)、5-羟基-6,7,3′,4′-四甲氧基黄酮(5-hydroxy-6,7,3′,4′-tetramethoxyflavone)、槲皮素(quercetin)和柚皮素(naringenin)等[14]。
1.1.3萜类。
艾叶中分离得到的萜类化合物主要有单萜类、倍半萜类和三萜类,其中报道较多的是倍半萜类和三萜类。倍半萜类主要包括倍半萜、倍半萜二聚体、倍半萜单萜聚合物[13]。段丽萍等[15]对艾叶中三萜类化合物的提取进行了技术优化,对溶剂、提取温度、液固比和提取时间进行选择,经过单因素试验和响应面优化试验后得到当乙醇体积分数为72%、提取温度73 ℃、液固比21∶1(mL∶g)、超声时间42 min时,艾叶总三萜的得率最高。且各因素对艾叶总三萜得率的影响大小为:提取温度>超声时间>液固比>乙醇体积分数。
1.1.4苯丙素类。
艾叶中确认结构的苯丙素类化合物有28个,包括东莨菪内酯、伞形花内酯、瑞香素、咖啡酸、绿原酸、异绿原酸、伞形花内酯等,其中分离鉴定的苯丙酸类2个、苯丙酸酯类5个、香豆素类5个、木脂素类2个[13]。
1.1.5其他类。
艾叶中还发现有机酸、甾体类等化学成分及多种微量元素。艾叶中发现的芳香酸类化合物有水杨酸、苯甲酸、香草酸、对羟基苯甲醛等;甾体类有β-谷甾醇、胡萝卜甾醇和豆甾醇。艾叶含有多种微量元素,其中含量较高的有钾(K)、钙(Ca)、镁(Mg)、铁(Fe),其次还有锌(Zn)、铝 (Al)、镍(Ni)、钴(Co)、铬(Cr)、锶(Sr)、铜(Cu)、锰(Mn)、 钠(Na)等[16]。
1.2艾叶药理作用
1.2.1抗菌抗病毒。
研究表明[9],艾叶挥发油以及从其中分离得到的桉树脑和4-松油烯醇这2种单体化合物对5种真菌(疫霉、黑曲霉、粉红聚端孢、青霉、链格孢菌)均有抗真菌活性,且存在剂量依赖效应。杨文婷等[17]利用抑菌圈法和常量稀释法考察蕲艾挥发油对不同微生物的抑菌效果,结果为金黄色葡萄球菌>大肠杆菌>黑曲霉>青霉,金黄色葡萄球菌抑菌圈直径达1.5 cm,对金黄色葡萄球菌的最小抑菌浓度为8.0 mg/mL。除此之外,考究了艾叶不同溶剂提取物对大肠杆菌菌株的抑制效果,结果发现,艾叶水提物对受试大肠杆菌菌株的最小抑菌浓度值为31.25~62.5 mg/mL,艾叶醇提物对大肠杆菌菌株的最小抑菌浓度值为6.25~12.5 mg/mL[18]。除挥发油外,段丽萍等[15]提取艾叶中总三萜并进行抑菌试验表明,艾叶总三萜对金黄色葡萄球菌、大肠杆菌、普通变形杆菌、鼠伤寒沙门氏菌、化脓性链球菌等常见致病菌均存在抑制作用。艾叶乙酸乙酯提取物中3′-甲氧基蓟黄素对HBsAg 的半数抑制浓度(IC50 ) 为 8.09 mg/L ,对 HBeAg 的 IC50小于 2.5 mg/L。
1.2.2抗肿瘤。
艾叶多糖能明显抑制肝癌细胞的增殖,浓度为100~200 μg/mL时能显著促进脾细胞分泌TNF细胞因子,或增强TNF 杀伤肿瘤靶细胞的活性,同时也可增强NK细胞对肿瘤细胞的杀伤作用,且这些作用都存在剂量依赖效应[19]。艾叶黄酮可抑制肝癌SMMC-7721细胞增殖和促进SMMC-7721凋亡,且细胞抑制率、凋亡率都呈一定浓度依赖性。其机制可能是通过调控Caspase-3、Bcl-2、P21蛋白诱导其凋亡[20]。艾叶总黄酮提取物中的异泽兰黄素可抑制体内肿瘤的生长,异泽兰黄素能够在体外抑制SMMC-7721细胞的生长,促进其凋亡,在体内可抑制裸鼠移植瘤的生长,其作用机制与下调Bcl-2、TopoⅡα表达,促进p53、caspase-3表达,激活IRE1/JNK/MCP-1信号通路有关[21]。艾叶挥发油对A549细胞增殖有明显的抑制作用,且存在剂量依赖效应;当挥发油浓度为424.8 μg/mL 时,细胞凋亡率最高,达到67.1%。艾叶挥发油可通过调控细胞周期将其抑制在S期,抑制细胞增殖,且存在剂量依赖效应[22]。
1.2.3抗氧化。
艾叶各提取物均具有较好的抑制黄嘌呤氧化酶(XOD) 和抗氧化作用,其清除自由基能力和抑制XOD作用大小为:醇提物>传统煎煮法提取物>蒸馏水超声波辅助提取物,3种提取物对XOD的抑制作用均表现为不可逆抑制,艾叶醇提物对血清尿酸 (UA)、肌酐 (Scr)、尿素氮水平(BUN)具有降低效果,有治疗高尿酸血症的效果,对肝脏XOD活性具有显著抑制作用[23]。艾叶多糖对羟基自由基(·OH)、超氧阴离子自由基(O2-·)、DPPH自由基都有良好的清除率,其IC50值分别为0.320 0 mg /mL、0.062 5 mg/mL、54.720 0 μg/mL,且都存在剂量依赖效应[24]。
1.2.4降血糖。
艾叶提取物可使低、中、高剂量组小鼠的空腹血糖低于模型组小鼠,空腹胰岛素水平高于模型组小鼠,肝糖原的水平高于模型组小鼠,且均存在剂量依赖效应[25]。使用艾叶多糖处理糖尿病模型小鼠发现,给药10 d后,与模型組比较,400 mg/kg 组小鼠血糖明显下降; 给药20 d后,高、低剂量组小鼠血糖与模型组比较有明显下降,在给药30 d后,高、中、低剂量组小鼠血糖与模型组比较均有明显下降。由此可见,艾叶多糖对糖尿病小鼠有明显的降血糖作用,当浓度为400 mg/kg时,降血糖效果最好[26]。
1.2.5抗炎。
在对二甲苯所致耳肿胀急性炎症模型小鼠的耳肿胀抑制试验中,艾叶挥发油可显著抑制小鼠耳的肿胀程度,其中高剂量组(20 mL/kg)的抑制效果与地塞米松处理后的抑制效果相差不大,说明艾叶挥发油有良好的抗炎效果[27]。
51卷24期高 鹏等艾叶及其燃烧产物的化学成分研究进展
2艾烟研究概况
2.1艾烟化学成分
艾烟提取物中的化学成分主要有醇、酮、烯烃和酚类成分,此外,还含有酸、酯、 内酯、烷烃、胺、腈、吲哚、萘、吡啶等成分。表2列举了部分常见或含量较高的成分。
2.2艾煙的提取工艺
艾烟中的主要有效成分有柠檬烯、桉叶油醇、樟脑、肉桂腈、吲哚、丁香酚、石竹烯等[33]。对人体产生危害的化学成分主要为苯酚、邻二甲苯、对二甲苯等芳香类化合物。其中有害成分的产生可能是由于燃烧程度和燃烧速度导致。若加强通风,燃烧速度过快会导致燃烧锥内部缺氧,从而积累较多的有害成分。研究表明,将艾烟浓度范围控制在27.45 mg/m3以内,对于人体而言属于安全浓度。不同提取方法所提取的艾烟中的化学成分差异极大。靳然等[29]利用固相微萃取对燃烧2 min后的艾绒进行收集,然后连接GC-MS进行成分分析鉴定出26个化学成分,包括苯酚、苯甲醛、石竹烯等成分。李炎强等[30]对艾叶粉末蒸馏萃取,同时将卷烟烟支中的烟丝吹出,填入揉碎的艾叶,点燃后也以水蒸馏的方式提取,GC-MS分析分别鉴定出54种和46种挥发性成分,其中龙脑、松油醇、石竹烯为共有成分,苯甲醛、苯酚、2 ,4 -二甲基苯酚和绿花白千层醇为燃烧后特有的物质。
2.3艾烟药理作用
2.3.1抗菌抗病毒。
杨梅[34]在艾叶燃烧物中提取出了5-叔丁基连苯三酚,对其进行了抑菌试验,结果显示对大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌的抑制效果较好,但对白色念珠菌需要较高的浓度才能达到相同的抑制效果。除此之外,研究发现[35],艾烟对乙肝病毒有较好的灭活效果,可以用围灸法对乙肝患者进行治疗。
2.3.2抗衰老。
孟笑男等[36]研究艾烟对快速老化老鼠模型中单胺类神经递质5-羟色胺(5-HT)、去甲肾上腺素(NE)和多巴胺(DA)含量时发现,有艾烟的处理组中3类神经递质的含量均显著高于无艾烟的处理组,且各艾烟处理组间无显著差异,因此,适当浓度范围的艾烟可提高神经递质的含量,起到一定的抗衰老作用。王昊等[37]发现,一定浓度艾烟干预ApoE 基因敲除后小鼠可使得其脑内神经递质5-羟色胺(5-HT)、GABA的含量相比于对照组有显著增加。
2.3.3调节脂质代谢。
艾烟能调节载脂蛋白E基因敲除(ApoE-/-)小鼠的脂质代谢,使得低密度脂蛋白(LDL)水平显著降低[37]。杨佳[38]在对LDL的观察过程中也发现,中浓度艾烟可显著提高血清低密度脂蛋白受体(LDL-r)的水平,说明艾烟对脂质代谢有良性调节作用。崔莹雪[39]也得到了相似的结论。
2.4艾烟毒理作用
2.4.1对血液循环系统的不良影响。
杨佳等[40]将大鼠分为低、中、高浓度组以及空白对照组,以血清中vWF和氧化性低密度脂蛋白(ox-LDL)为检测指标,其中vWF表征血小板的聚集程度,发现高浓度的艾烟可以使血清中vWF的含量显著降低,中浓度的艾烟可以使血清ox-LDL水平显著升高,表明中浓度的艾烟可以对血管内皮造成损伤。
2.4.2对呼吸系统的不良影响。
韩丽等[41]将大鼠分为低、中、高浓度组以及空白对照组,以血清、肺组织、支气管肺泡灌洗液中的超氧化物歧化酶(SOD)和丙二醛(MDA)作为检测指标,结果表明高浓度的艾烟可以使SOD含量降低,使血清和支气管肺泡灌洗液中的MDA上升,因此高浓度艾烟可以使肺组织出现损伤,但该试验低、中浓度是安全的。
2.4.3对免疫系统的不良影响。
韩丽[42]通过艾烟毒理相关试验发现,随着艾烟浓度的增高及染毒时间的增长,艾烟可能具有遗传毒性。研究发现,艾烟中高浓度的可吸入颗粒物具有导致染色体损伤的毒性,遗传毒性呈浓度依赖性。
2.4.4对细胞的影响。胡海等[43]用不同浓度艾烟冷凝物处理肺泡Ⅱ型上皮细胞A549观察其形态和活性,分别用直接镜和荧光显微镜观察发现,当浓度大于0.05 g/L时,细胞形态开始发生变化,逐渐由正常的梭形、多角形变为圆形,并且细胞数量逐渐下降,且具有剂量依赖效应;当浓度大于0.12 g/L时,细胞活性显著降低,具有浓度依赖性。同时研究艾烟冷凝物对其的凋亡作用也得到了相似的结论[44]。Dou等[45]在对肺泡Ⅱ型上皮细胞 A549 线粒体膜电位及 Bax/Bcl-2 影响的研究中发现,当艾烟浓度为0.4 mg/mL 时,肺泡Ⅱ型上皮细胞A549线粒体膜电位(mitochondrial transmembrane potential,MTP) 和凋亡抑制基因 Bcl-2 mRNA均有显著降低,因此高浓度的艾烟可引起氧化损伤,进而导致细胞凋亡。
2.5艾烟的质量评估
艾烟的疗效主要是通过其燃烧后释放的热量和化学成分发挥作用。影响艾烟生成物的因素包括艾条的存储年份、艾绒比例、产地、制作工艺等,目前主要以燃烧物中苯酚和自由基(烷基、烷氧、NO以及焦油自由基)的含量作为评价其燃烧性能的标准。当年艾叶和放置1年、2年的陈艾挥发性成分随着放置时间的延长,艾叶中易挥发的成分含量会降低到一定范围,各组分所占含量比值趋于稳定,毒性成分侧柏酮的含量会降低。存储时间为3年和5年的艾条燃烧后产生的自由基的数量要远小于存储1年的艾条[46]。不同叶绒比的艾绒在燃烧学性质上具有明显差异,艾绒的燃烧热值随着其叶绒比增加而有所降低[47]。
3研究展望
目前艾叶中的化学成分已经有了一定的研究基础,但对于不同的采摘时间、采摘地点、提取方法、炮制以及存储时间对其化学成分的影响缺少更加深入系统的研究。此外,艾叶的抗菌、抗炎的药理作用,所对应的化学物质基础还不清楚,其发挥作用的机制也缺乏进一步的研究。艾叶与艾烟中的化学成分有着较大的差异,提取方法的不同对艾烟的成分影响极大。艾烟在使用过程中的安全评估也成为日渐关注的话题,目前认为艾烟中有害成分的产生可能与燃烧程度有着较为紧密的关系。此外,浓度不同对人体也有着不同的影响,低、中浓度艾烟一般不会对人体产生危害,在高浓度或长期暴露的情况下,它对呼吸系统和免疫系统都会造成损伤。但目前对于其引发损伤的具体化学成分和机理还有待更为系统的研究。艾叶有着广阔的应用前景,在未来的研究过程中应该重点关注艾叶和艾绒的药用机理及相关药用产品的开发。
参考文献
[1]国家药典委员会.中华人民共和国药典:2020年版一部[S].北京:中国医药科技出版社,2020:92.
[2] 张秀芳,忻晓东,程媛,等.优选提取-共沸精馏耦合技术提取艾叶挥发油工艺[J].中国现代应用药学,2020,37(14):1708-1713.
[3] 武露,刘红霞,董璐元,等.微波辅助提取艾叶挥发油的工艺优化[J].齐齐哈尔大学学报(自然科学版),2019,35(6):67-68,72.
[4] 赵秀玲,党亚丽.艾叶挥发油化学成分和药理作用研究进展[J].天然产物研究与开发,2019,31(12):2182-2188.
[5] HUANG H C,WANG H F,YIH K H,et al.Dual bioactivities of essential oil extracted from the leaves of Artemisia argyi as an antimelanogenic versus antioxidant agent and chemical composition analysis by GC/MS[J].Int J Mol Sci,2012,13(11):14679-14697.
[6] 宋叶,张鹏云,戴卫波,等.不同产地艾叶挥发油成分的比较研究[J].时珍国医国药,2019,30(4):845-851.
[7] 阳一兰.湖南野生新鲜艾叶挥发油成分分析[J].湖南农业科学,2019(3):73-75.
[8] 杜家俊,高瑞,王少圣,等.安徽产艾叶挥发油成分GC-MS分析[J].皖南医学院学报,2017,36(1):11-15.
[9] 努尔比耶·奥布力喀斯木,热娜·卡斯木,杨璐,等.艾叶挥发油化学成分分析和抗真菌活性的研究[J].新疆医科大学学报,2017,40(9):1195-1198,1202.
[10] 谷瑶,梁忠云,陈松武,等.广西野生艾叶挥发油成分的GC-MS分析[J].南方农业,2020,14(28):13-15.
[11] 戴卫波,李拥军,梅全喜,等.12个不同产地艾叶挥发油的GC-MS分析[J].中药材,2015,38(12):2502-2506.
[12] 蒋潇,田静.三个产地艾叶挥发油的化学成分分析[J].中国民族民间医药,2015,24(17):19-22.
[13] 兰晓燕,张元,朱龙波,等.艾叶化学成分、药理作用及质量研究进展[J].中国中药杂志,2020,45(17):4017-4030.
[14] 胡倩,刘大会,曹艳.艾叶黄酮类化合物的研究进展[J].食品安全质量检测学报,2019,10(12):3648-3653.
[15] 段丽萍,孙炜炜,苗丽坤,等.艾叶总三萜的提取工艺优化及其抑菌活性[J].现代食品科技,2020,36(5):88-95.
[16] 靳然,于密密,赵百孝,等.电感耦合等离子质谱测定不同产地艾叶的微量元素研究[J].环球中医药,2011,4(6):420-422.
[17] 杨文婷,黄士栩,翁德会,等.蕲艾挥发油体外抑菌作用及其机理[J].北方园艺,2017(23):22-28.
[18] 李小妞,陈志坚,关强强,等.艾叶提取物对大肠杆菌抑菌活性的研究[J].黑龙江畜牧兽医,2019(6):140-142,173.
[19] 喻昕,尹美珍,王静晖,等.艾叶多糖的直接及免疫协同抗肿瘤作用[J].湖北理工学院学报,2014,30(3):53-56.
[20] 李钦.艾蒿总黄酮诱导人肝癌细胞株SMMC7721凋亡及相关调控基因的研究[D].南昌:南昌大学,2016.
[21] 刘瑞.艾叶提取物异泽兰黄素诱导肝癌细胞凋亡机制的研究[D].广州:南方医科大学,2019.
[22] 丁圆平,刘靖怡,田洋,等.艾叶挥发油对A549细胞的抑制作用[J].中成藥,2019,41(9):2063-2068.
[23] 李美萍,王微,张婕,等.艾叶提取物对黄嘌呤氧化酶的抑制作用及对高尿酸血症小鼠的降尿酸作用[J].现代食品科技,2019,35(1):22-30.
[24] 胡岗,尹美珍,喻昕,等.艾叶多糖体外抗氧化作用研究[J].时珍国医国药,2015,26(11):2650-2652.
[25] 尚喜雨,曲震理,刘尚书,等.艾叶提取物对2型糖尿病小鼠血糖和氧化应激的影响[J].中国现代医药杂志,2020,22(5):35-37.
[26] 尹美珍,胡岗,苏振宏,等.艾叶多糖I型糖尿病小鼠的降血糖作用[J].时珍国医国药,2015,26(9):2072-2074.
[27] 赵桂芝,王绪平,俞忠明,等.艾叶挥发油对耳肿胀急性炎症模型小鼠的抗炎作用研究[J].浙江中医杂志,2016,51(4):288-289.
[28] 吴子建,王斌,段文秀,等.顶空进样-气相色谱-质谱联用法检测3年陈艾条燃烧产物中挥发性成分[J].安徽中医药大学学报,2017,36(2):64-67.
[29] 靳然,赵百孝,于密密,等.艾燃烧生成物组分固相微萃取气相色谱质谱法定性分析[J].北京中医药大学学报,2011,34(9):632-636.
[30] 李炎强,胡军,张晓兵,等.艾叶及其烟气粒相物挥发性成分的分析[J].烟草科技,2005,38(10):15-17,21.
[31] 张潇予,李瑞,薛澄,等.基于HS-GC-MS分析不同艾绒比艾条及其艾烟中挥发性成分[J].中药材,2020,43(5):1164-1169.
[32] 周次利,吴焕淦,窦传字,等.三年陈蕲艾艾烟化学成分的GC-MS分析[C]//中国针灸学会.2011中国针灸学会年会论文集(摘要).北京:中国针灸学会,2011:4107-4116.
[33] 许小宇,单思,王雯蕾,等.不同加工工艺艾条艾烟化学成分的HS-GC-MS分析[J].中华中医药杂志,2021,36(1):506-509.
[34] 杨梅.艾叶燃烧产物有效成分药效研究[D].武汉:中南民族大学,2009.
[35] 赵红梅,李小敏,关丽婵,等.爱婴病房艾条熏蒸对HBsAg灭活效果的研究[J].中华护理杂志,2000,35(1):11-12.
[36] 孟笑男,许焕芳,崔莹雪,等.艾燃烧生成物对快速老化模型小鼠P8大脑单胺类神经递质含量的影响[J].中华中医药杂志,2014,29(9):2761-2763.
[37] 王昊,杨佳,赵百孝,等.艾燃烧生成物对ApoE基因敲除小鼠脑内神经递质5-HT、GABA的影响[J].世界中医药,2016,11(8):1410-1413.
[38] 杨佳.不同浓度艾烟长期干预对大鼠心血管疾病易感因子影响的实验研究[D].北京:北京中医药大学,2013.
[39] 崔莹雪.艾灸及艾烟对ApoE-/-小鼠动脉粥样硬化胆固醇代谢和炎性反应的影响[D].北京:北京中医药大学,2014.
[40] 杨佳,赵百孝,韩丽,等.不同浓度艾烟长期干预对大鼠血清vWF及ox-LDL表达的影响[J].世界中医药,2013,8(8):859-861.
[41] 韩丽,赵百孝,刘铜华,等.不同浓度艾烟干预对大鼠肺脏及血清SOD、MDA表达的影响[J].中国针灸,2015,35(7):687-690.
[42] 韩丽.艾烟的毒理学实验研究[D].北京:北京中医药大学,2013.
[43] 胡海,赵百孝,邬继红,等.艾烟冷凝物对肺泡Ⅱ型上皮细胞A549形态及活性的影响[J].北京中医药大学学报(中医临床版),2012,19(6):13-15.
[44] 胡海,赵百孝,邬继红,等.艾烟冷凝物对肺泡Ⅱ型上皮细胞A549活性及凋亡的影響[J].北京中医药大学学报,2012,35(6):426-429,436.
[45] DOU C Z,WU H G,MA X P,et al.Influence of moxa smoke on mitochondrial transmembrane potential and Bax/Bcl-2 in alveolar type II epithelial A549 cells[J].Journal of acupuncture and tuina science,2016,14(5):305-310.
[46] 窦传字,吴焕淦,洪宗国,等.不同储存年份的艾条燃烧生成自由基的ESR波谱研究[J].世界中医药,2013,8(8):852-855.
[47] 武娟,万定荣,江远明,等.艾灸疗法原材料艾绒的燃烧热值测定研究[J].上海针灸杂志,2020,39(12):1623-1627.

