Fe3O4@COOH纳米酶比色检测食用纯植物油的过氧化值
栗 鑫,罗 磊,熊蓥姿,王 玲,李脉泉,刘 霞
(湖南农业大学食品科学技术学院,食品科学与生物技术湖南省重点实验室,湖南 长沙 410128)
食用植物油中由于含有大量不饱和脂肪酸,在生产、运输、贮藏过程中易发生氧化,其氧化中间产物氢过氧化物易分解为4-羟基-反式-壬烯醛、巴豆醛、丙二醛等低分子的醛酮类化合物,不仅使油脂的感官品质受损,还具有一定的生理毒性,危害身体健康[1-4]。过氧化值(peroxide value,POV),可以有效反映油脂的氧化程度,即POV越大,表明油脂氧化生成的氢过氧化物的量越多[5]。我国在GB 5009.227—2016《食品中过氧化值测定》[6]中规定:食用植物油的POV应不高于0.25 g/100 g。
目前,国内外检测食用植物油POV的方法主要有碘量法[7]、光谱法[8]、色谱法[9]、电化学酶促分析法[10-11]等。碘量法虽简单易行,但测定过程中易受人为因素的影响,如摇晃速率、滴定终点的确定等,导致检测结果重复性差。光谱法主要有傅里叶变换红外光谱和荧光光谱。傅里叶变换红外光谱具有测试时间短、操作成本低、预处理简单等明显优势,但其模型可靠性和专一性还需进一步优化[12]。荧光光谱法灵敏度高、样品用量少,但容易受到干扰[13]。色谱法以高效液相色谱为主,简单灵敏,选择不同的色谱柱和检测器,能分析具有不同特性、不同分子质量或极性的油脂[14],但检测时间长[15]。此外,光谱法与色谱法都需应用大型仪器,检测成本高,且检测方法不够便捷。酶促分析法中,过氧化物酶传感器应用居多[16]。Jia Jianbo等[17]研究了基于辣根过氧化物酶(horseradish peroxidase,HRP)制备的酶电极,将其应用于植物油POV的测定,取得了满意的结果。但HRP存在着对环境敏感、成本高等问题。
纳米酶是一种具有天然酶催化活性的纳米材料,在生理条件下可有效催化底物的转化,并遵循天然酶的酶促动力学[18]。Fe3O4纳米酶是最早被发现具有类过氧化物酶(peroxidase,POD)催化活性的材料,具有容易制备、性质稳定、超顺磁性等特性。Fe3O4纳米酶表面含有丰富的Fe2+、Fe3+,两者间的相互转换是其释放催化活性的关键。如图1所示,酸性条件下,Fe3O4纳米酶中的Fe3+能与氢过氧化物(如H2O2)反应,生成不稳定的FeOOH2+离子基,该离子基进一步分解成Fe2+,再与H2O2反应生成羟自由基[19],羟自由基可氧化显色底物,如3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine,TMB)和2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonate),ABTS)。TMB的氧化产物,即氧化态TMB(oxidation-TMB,ox-TMB)呈蓝色,其最大吸收波长为652 nm。Ding Ning等[20]基于Fe3O4纳米酶的类POD活性,以ABTS为显色底物,建立了Fe3O4纳米酶-H2O2-ABTS的比色传感体系,用于检测乳制品中的三聚氰胺。Re Hejun等[21]制备了一种表面修饰有VC的Fe3O4纳米酶,并将其作为催化剂,构建了一种用于检测H2O2和葡萄糖的比色传感器。
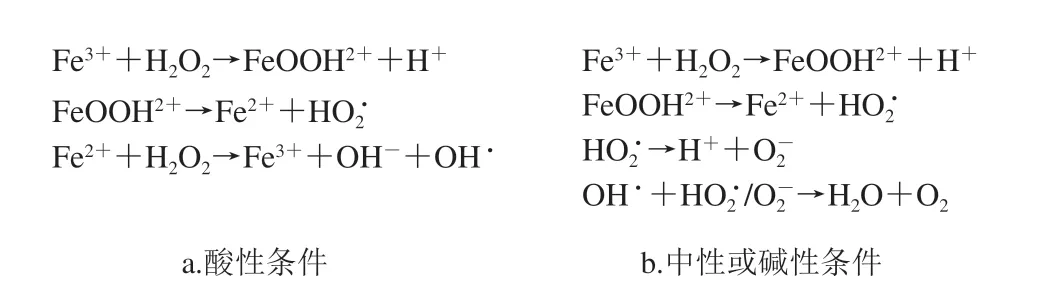
图1 Fe3O4纳米酶催化反应机理Fig.1 Mechanism of reactions catalyzed by Fe3O4 nanozyme
本研究基于表面修饰羧基的Fe3O4纳米酶(Fe3O4@COOH)的类POD活性,以TMB为显色底物,构建一种用于检测食用纯植物油中POV的简单快速、灵敏高效的新型比色方法。
1 材料与方法
1.1 材料与试剂
食用纯植物油(压榨、一级):玉米油、花生油、葵花籽油、菜籽油、大豆油 长沙市步步高超市。
四水合氯化亚铁(FeCl2·4H2O)、六水合三氯化铁(FeCl3·6H2O)、氢氧化钠(NaOH)、一水柠檬酸(C6H10O8·H2O)、乙酸、乙醇、30%过氧化氢(H2O2)、三水合乙酸钠(CH3COONa·3H2O)、二甲亚砜(dimethyl sulfoxide,DMSO)、三氯甲烷(CHCl3)、冰乙酸(CH3COOH)上海国药集团化学试剂有限公司;TMB(纯度≥99%)上海瑞永生物科技有限公司;HRP(活性>300 U/mg)上海麦克林生化科技有限公司;Fe3O4@COOH纳米酶由本实验室自制;氮气 长沙长钢气体厂;汝铁硼强磁铁 长沙南湖五金机电市场;实验所用试剂均为分析纯及以上,实验用水为超纯水。
1.2 仪器与设备
Multiskan GO 1510多功能酶标仪 美国Thermo Scientific公司;KQ-250DE超声波清洗器 昆山市超声仪器有限公司;DZF-6030A真空干燥箱 上海恒一科学仪器有限公司;XMTD-702便携式恒温箱 常州市凯奥仪器有限公司;AUY 220分析天平 日本岛津公司;移液枪 大龙兴创实验仪器公司;WGZ-9070B鼓风干燥箱 上海科恒仪器有限公司;紫外灯箱为实验室(2.0 A、30 W)均由本实验室自制。
1.3 方法
1.3.1 Fe3O4@COOH纳米酶类POD催化活性的验证
Fe3O4@COOH纳米酶的制备是在实验室现有方法上稍加优化[22]。过程如下:准确称取5.0 g FeCl3•6H2O、2.0 g FeCl2•4H2O,超声溶解在100 mL超纯水中,通氮除氧,水浴加热至80 ℃,加入40 mL NaOH溶液(2 mol/L)、1.1 g柠檬酸,在550 r/min反应1 h。待反应结束后,冷却至室温,在外部磁场作用下使用超纯水洗涤至中性,于60 ℃条件下真空干燥24 h后备用。
H2O2存在下,研究Fe3O4@COOH纳米酶对底物TMB的催化氧化能力。将800 μL乙酸盐缓冲液(0.2 mol/L,pH 3.5)于离心管中,依次加入50 μL Fe3O4@COOH纳米酶水溶液(1 mg/mL)、100 μL H2O2(0.08 mol/L)和50 μL TMB(0.008 mol/L),加入50 μL DMSO溶解,混合均匀,在室温下反应5 min后,在外部磁力作用下分离Fe3O4@COOH纳米酶,然后吸取100 μL上清液置于酶标板中,扫描其在550~750 nm范围内的吸收光谱。
1.3.2 Fe3O4@COOH纳米酶比色检测POV条件优化
反应条件优化的参数如表1所示,方法与1.3.1节相同。每个实验平行测定3 次。

表1 反应条件的优化Table 1 Optimization of reaction conditions
1.3.3 Fe3O4@COOH纳米酶的酶促动力学分析
首先,固定H2O2浓度(0.08 mol/L),改变TMB浓度。将反应总体积缩小为原来的1/5,依次往酶标板中加入160 μL乙酸盐缓冲液(0.2 mol/L,pH 2)、20 μL Fe3O4@COOH纳米酶(1 mg/mL)、40 μL H2O2以及20 μL TMB(不同浓度),混合均匀,在652 nm波长处进行吸光度的测定。每隔30 s测定一次,以吸光度随时间变化曲线斜率的倒数为纵坐标,以TMB浓度倒数为横坐标绘图,得到Fe3O4@COOH纳米酶对TMB的双倒数图,再根据公式:1/V=(Km/Vmax)(1/[S])+1/Vmax计算出米氏常数(Km)和最大反应速率(Vmax)[23]。
类似地,固定TMB浓度(0.8 mmol/L),改变H2O2浓度。检测过程与数据处理方法同上。
1.3.4 Fe3O4@COOH纳米酶的重用性及贮藏性
将制备好的Fe3O4@COOH纳米酶置于4 ℃条件下冷藏保存,采用1.3.1节的方法,考察其重复使用性及贮藏性能。
1.3.5 基于Fe3O4@COOH纳米酶比色测定食用纯植物油POV的可行性
1.3.5.1 纯植物油提取液
准确称取3.0 g(精确到0.01 g)植物油,溶解于30 mL三氯甲烷-冰乙酸混合溶液(4∶6,V/V)中,混合均匀后,加入100 mL超纯水,静置1 min,待溶液分层后,吸取下层溶液至离心管中,获得食用纯植物油提取液。
1.3.5.2 POV的检测
采用GB 5009.227—2016对食用纯植物油提取液,进行POV的测定,同时采用Fe3O4@COOH纳米酶比色法检测食用纯植物油原液和食用纯植物油提取液的POV,比较检测结果。
1.3.6 基于Fe3O4@COOH纳米酶比色检测食用植物油POV的方法建立
取200 μL不同种类纯植物油,分别采用国家标准方法与比色法进行POV检测,以比色法测得的吸光度为横坐标,POV为纵坐标,建立油样吸光度与POV的关系曲线。
1.3.7 不同氧化方式对食用纯植物油POV比色检测的影响
紫外氧化:准确吸取100 mL食用纯植物油(玉米油、花生油、葵花籽油、菜籽油、大豆油)倒入烧杯中,将烧杯放入紫外灯箱中,经紫外灯照射进行氧化。
烘箱氧化:同上,试样放入电热高温干燥箱中,80 ℃氧化。
自然氧化:同上,试样于室温下自然氧化。
其中,每间隔一定时间从烧杯的上、中、下三层共取出5 mL油样,混匀后,分别应用1.3.6节建立的方法和国家标准方法,对其进行POV的检测。
1.3.8 实际油样的检测
采用玉米、花生、葵花籽、菜籽、大豆油5 种纯植物油作为实际样品。分别应用所建的比色检测方法和国家标准方法对其进行POV的检测,并比对其检测结果。
1.4 数据处理
数据处理分析采用软件OriginPro、Excel、SPSS和Photoshop,其中线性回归方程、作图使用OriginPro和Photoshop,重复性、偏差值、回收率采用SPSS、Excel处理数据。
2 结果与分析
2.1 Fe3O4@COOH纳米酶类POD催化活性的验证
本实验室合成的Fe3O4@COOH纳米酶粒径平均值约为6.6 nm,如图2所示。
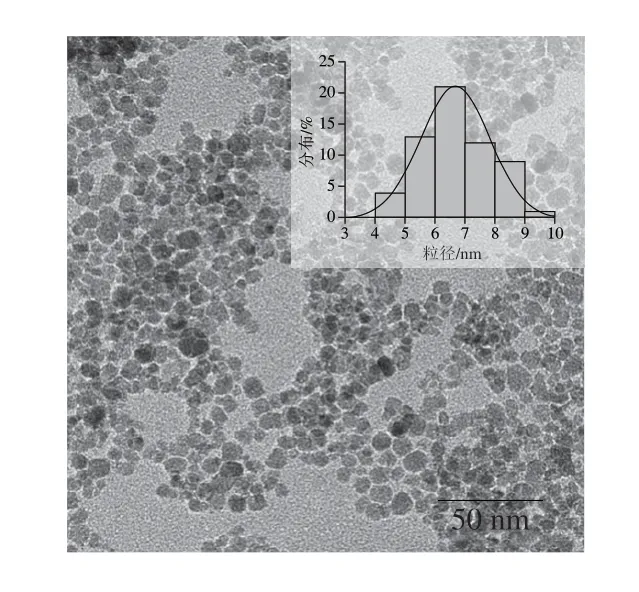
图2 Fe3O4@COOH纳米酶的透射电镜图Fig.2 TEM image of Fe3O4@COOH
如图3所示,当反应体系中同时存在Fe3O4@COOH纳米酶、H2O2和TMB时,该体系在500~750 nm波长范围内出现了较强的吸收峰;当反应体系中不存在Fe3O4@COOH纳米酶时,相同时间内,并未出现明显的吸收峰,这说明Fe3O4@COOH纳米酶能够催化H2O2氧化TMB。此外,当反应体系中存在TMB时,均会出现较弱的吸收峰,但吸光度显著低于Fe3O4@COOH纳米酶-H2O2-TMB反应体系,原因可能是TMB受到溶液及空气中的氧气影响,发生了微弱的氧化。但反应体系中不存在TMB时,则并未出现明显的吸收峰。上述结果表明,本研究制备的Fe3O4@COOH纳米酶具有类POD的催化活性,且以TMB作为显色底物时,其最大吸收峰波长为652 nm。
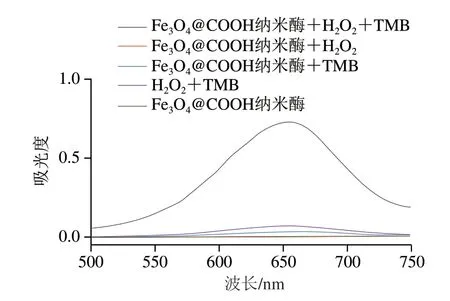
图3 不同反应体系的吸收光谱Fig.3 Absorption spectra of different reaction systems
2.2 比色检测条件的优化
为获得最佳比色检测条件,研究乙酸盐缓冲液体积、缓冲液pH值、TMB浓度、Fe3O4@COOH纳米酶质量浓度、反应时间等因素对Fe3O4@COOH纳米酶催化活性的影响。
首先,探究乙酸盐缓冲液体积对显色效果的影响(固定反应体系总体积)。如图4A所示,反应溶液吸光度随乙酸盐缓冲液体积的增加而增加,当乙酸盐缓冲液体积为800 μL时,其吸光度最大。之后,反应溶液吸光度没有出现明显变化,故选择800 μL乙酸盐缓冲液进行后续实验。

图4 乙酸盐缓冲液体积(A)、pH值(B)、TMB浓度(C)、Fe3O4@COOH纳米酶质量浓度(D)、反应时间(E)对显色效果的影响Fig.4 Effects of acetate buffer volume (A),pH (B),TMB concentration (C),concentration of Fe3O4@COOH nanozyme (D) and reaction time (E) on coloration
从图4B可以看出,随pH值的升高,反应体系的吸光度也随之增加,当pH 3时,反应体系显示出最大吸光度。之后,反应体系的吸光度随pH值的增加而降低。这是在酸性环境下时,Fe3O4@COOH纳米酶表现出类POD的催化活性[24-25]。故反应体系的最佳pH值为3。
显色底物TMB浓度是影响比色反应的重要因素,结果如图4C所示。当TMB浓度增加时,其吸光度随之升高。当TMB浓度为0.08 mol/L时,其吸光度达到最大。之后,即使TMB浓度继续增大,反应体系的吸光度并未出现明显变化,原因可能是Fe3O4@COOH纳米酶与H2O2反应释放出羟自由基,后者与TMB发生氧化反应,当底物量趋于饱和时,颜色变化趋于稳定,其增长变化趋势符合酶与底物结合反应过程曲线[26]。故选择0.08 mol/L TMB进行后续实验。
Fe3O4@COOH纳米酶质量浓度直接影响反应体系的显色效果,结果如图4D所示。反应体系的吸光度随Fe3O4@COOH纳米酶质量浓度的增加而增加。当Fe3O4@COOH纳米酶质量浓度为1 mg/mL时,吸光度达到较大水平,之后,吸光度的变化不明显,可能原因是反应体系中酶与底物已结合完全,故选择1 mg/mL Fe3O4@COOH纳米酶进行后续实验。
反应时间影响体系的显色效果,结果如图4E所示,随着反应时间的延长,反应体系的吸光度也随之增加。当反应时间为10 min时,反应体系的吸光度达到最大,之后,随着反应时间的延长,反应体系的吸光度逐渐下降,超过10 min后,蓝色氧化产物ox-TMB呈现不稳定状态,进一步分解为其他物质,使得反应体系的颜色逐渐变浅,其吸光度也随之降低。考虑到检测方法的适用性,以及连续大批量检测的需要,故选择5 min作为本方法的显色反应时间。
2.3 Fe3O4@COOH纳米酶的酶促动力学分析
通过酶促动力学实验,进一步研究Fe3O4@COOH纳米酶的类POD催化活性(图5),获得的米氏常数(Km)和最大反应速率(Vmax)见表2,其中,Fe3O4@COOH纳米酶对H2O2和TMB的Km值分别为0.315、0.702 mmol/L。Km值代表酶与底物的亲和能力,Km值越小,表明酶与底物的亲和能力越高。从表2得知,Fe3O4@COOH纳米酶对H2O2和TMB的Km值均低于HRP,说明Fe3O4@COOH纳米酶相较于HRP而言,对H2O2和TMB的亲和力更高,可能是由于所制备的Fe3O4@COOH纳米酶粒径小、比表面积大、表面带有丰富的负电荷,能结合更多的H2O2和TMB。相较于HRP与底物具有更强的结合能力[27-28]。但其Vmax略低于HRP,表明其催化反应速率与天然酶相比存在一定差距。相较于Fe3O4纳米酶和表面修饰其他物质的Fe3O4纳米酶而言,Fe3O4@COOH纳米酶对H2O2和TMB的亲和力较弱,表中表面不同修饰的Fe3O4纳米酶对底物的亲和力也有不同程度的降低,这是由于Fe3O4纳米酶的催化活性位点主要分布在其表面,表面修饰后,其活性位点部分被覆盖,导致该纳米酶的催化活性有所降低。但修饰后的Fe3O4@COOH纳米酶稳定性与分散性更佳,不易发生聚集,这也从另一个方面提升了Fe3O4@COOH纳米酶的催化稳定性与活性[29],且有利于实际应用。此外,虽然本研究所应用的Fe3O4@COOH纳米酶对底物的反应速率,不及Au、MnO2、C修饰的Fe3O4,但是其制备简单、成本低,能够满足比色检测的需要。
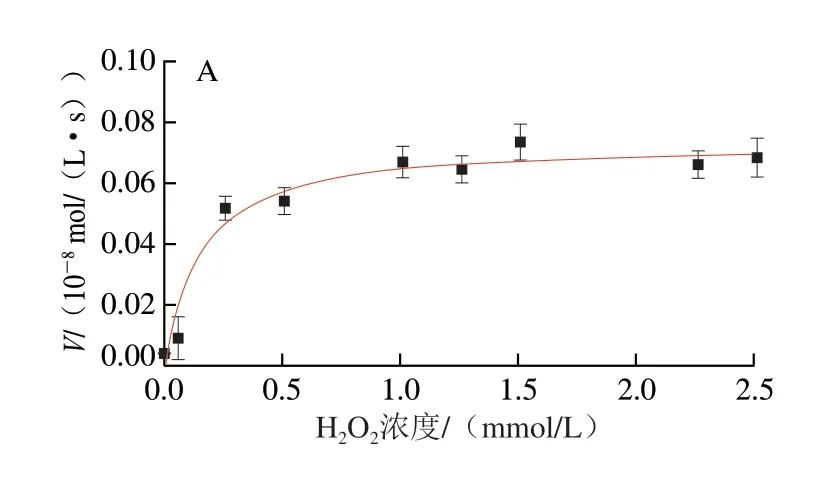
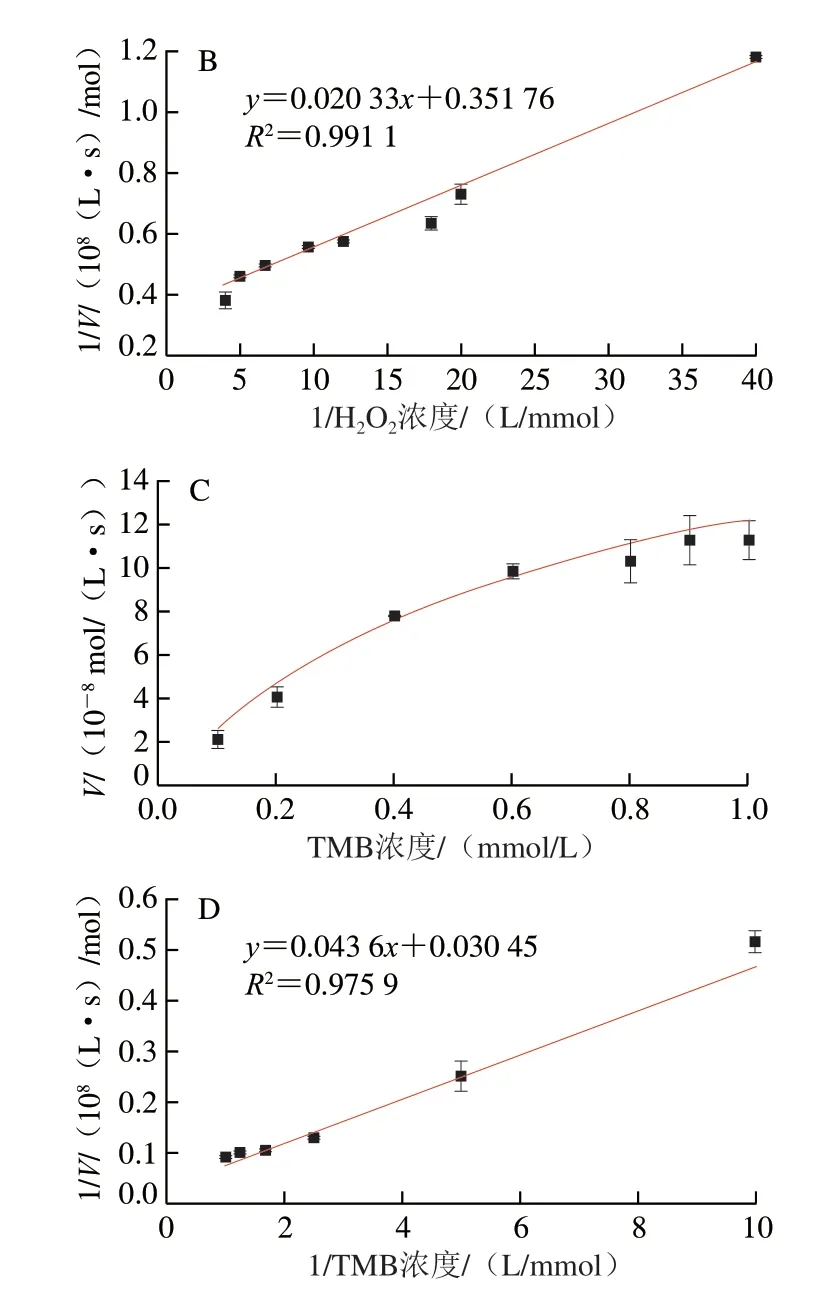
图5 Fe3O4@COOH纳米酶酶促动力学分析Fig.5 Enzymatic kinetic analysis of Fe3O4@COOH nanozyme

表2 各种纳米材料与HRP的Km和VmaxTable 2 Km and Vmax values of nanomaterials and HRP
2.4 Fe3O4@COOH纳米酶的重复使用性及贮藏性
如图6所示,该纳米酶经5 次显色-干燥-再显色的循环反应后,反应体系的吸光度未出现明显变化,说明所制备的Fe3O4@COOH纳米酶催化活性稳定,具有可重复使用性,这是由于Fe3O4@COOH纳米酶具有良好的超顺磁性,能够在每次显色反应完成后,借助外部磁力作用回收,相较于HRP而言更加经济。
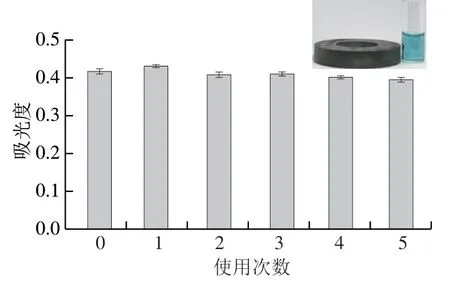
图6 Fe3O4@COOH纳米酶重复使用次数Fig.6 Reusability of Fe3O4@COOH nanozyme
使用冷藏(4 ℃)保存不同时间的Fe3O4@COOH纳米酶进行比色反应(图7),发现反应体系的吸光度无明显变化,表明Fe3O4@COOH纳米酶在冷藏条件下保存50 d后,仍表现出良好的类POD催化活性,即具有较好的稳定性。

图7 Fe3O4@COOH纳米酶的保存时间Fig.7 Storage stability of Fe3O4@COOH nanozyme
2.5 Fe3O4@COOH纳米酶比色检测食用纯植物油POV的可行性
如图8所示,无论是食用纯植物油提取液,还是食用纯植物油原液,Fe3O4@COOH纳米酶均可催化油脂中过氧化物,并与TMB发生显色反应。但食用纯植物油原液的反应溶液颜色,明显深于植物油提取液的反应溶液颜色,且反应溶液在500~750 nm波长范围内,均产生了明显的吸收峰,且前者的吸收峰明显强于后者的吸收峰(图9)。这或许是食用纯植物油经有机溶剂提取后,其所含的过氧化物部分被分解所致。上述结果说明,采用食用纯植物油原液+Fe3O4@COOH纳米酶+TMB的反应体系,可实现食用植物油中POV的检测,不仅省时且更加准确。

图8 植物油和提取液与TMB反应前后的溶液颜色变化Fig.8 Color changes of vegetable oil and its extract before and after reaction with TMB

图9 食用纯植物油原液、植物油提取液的吸收光谱图Fig.9 Absorption spectra of edible vegetable oil and its extract
2.6 Fe3O4@COOH纳米酶比色法检测食用纯植物油的POV
2.6.1 比色法检测食用纯植物油POV方法的建立
以紫外照射不同时间的纯植物油作为样品,在最佳比色检测条件下,采用食用纯植物油原液+Fe3O4@COOH纳米酶+TMB的反应体系,对其吸光度进行测定,同时采用国家标准方法对同一样品进行POV的测定。如图10所示,不同种类食用纯植物油的POV在0~0.30 g/100 g范围内,与其吸光度之间均呈现出良好的线性关系。但斜率不同,这或许是由于不同种类的食用植物油成分差异,生成的过氧化物类型不同[35]。
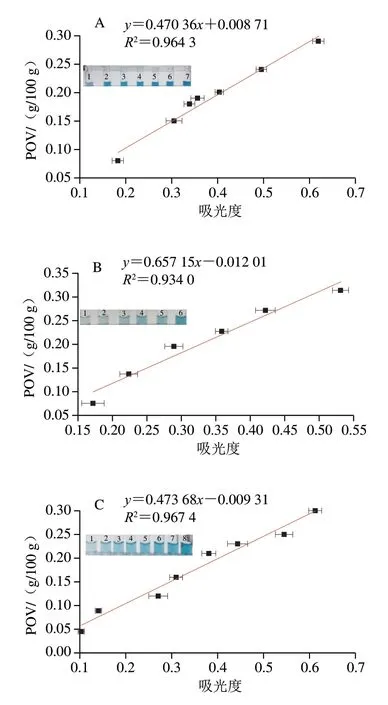
图10 比色法检测玉米油(A)、花生油(B)、葵花籽油(C)、菜籽油(D)、大豆油(E)POV的线性关系及照片Fig.10 Linear relationships between POV and absorbance of corn oil (A),peanut oil (B),sunflower oil (C),rapeseed oil (D) and soybean oil (E)
2.6.2 Fe3O4@COOH纳米酶比色检测不同氧化方式油样的POV
经过3 种氧化方式(紫外灯照射、烘箱加热、自然放置)的油样的POV分别为0.32、0.28、0.29,吸光度分别为0.577 9、0.568 3、0.599 1(图11)。在POV较为稳定的情况下,经过3 种不同氧化方式的油样的吸光度稳定在0.58左右,相对标准偏差(relative standard deviation,RSD)分别为4.56%、6.14%、5.82%,表明所构建的基于Fe3O4@COOH纳米酶的比色检测方法,适用于不同方式氧化的食用纯植物油POV检测。

图11 不同氧化方式下的植物油吸光度与POVFig.11 Absorbance and POV of vegetable oil oxidized by different methods
2.6.3 实际样品的检测
采用所构建的比色法和滴定法(国家标准方法),分别对5 种未知氧化程度的食用纯植物油(玉米油、花生油、葵花籽油、菜籽油、大豆油)进行POV的测定。结果表明(表3),两种方法的检测结果接近,差值均在0.05以下,不影响最终结果的判定。此外,5 种油样的POV,两种测定方法的RSD分别为6.13%、5.84%、6.82%、3.62%、5.75%。这说明本研究构建的比色法具有良好的准确度,可用于纯植物油中POV的定量检测。
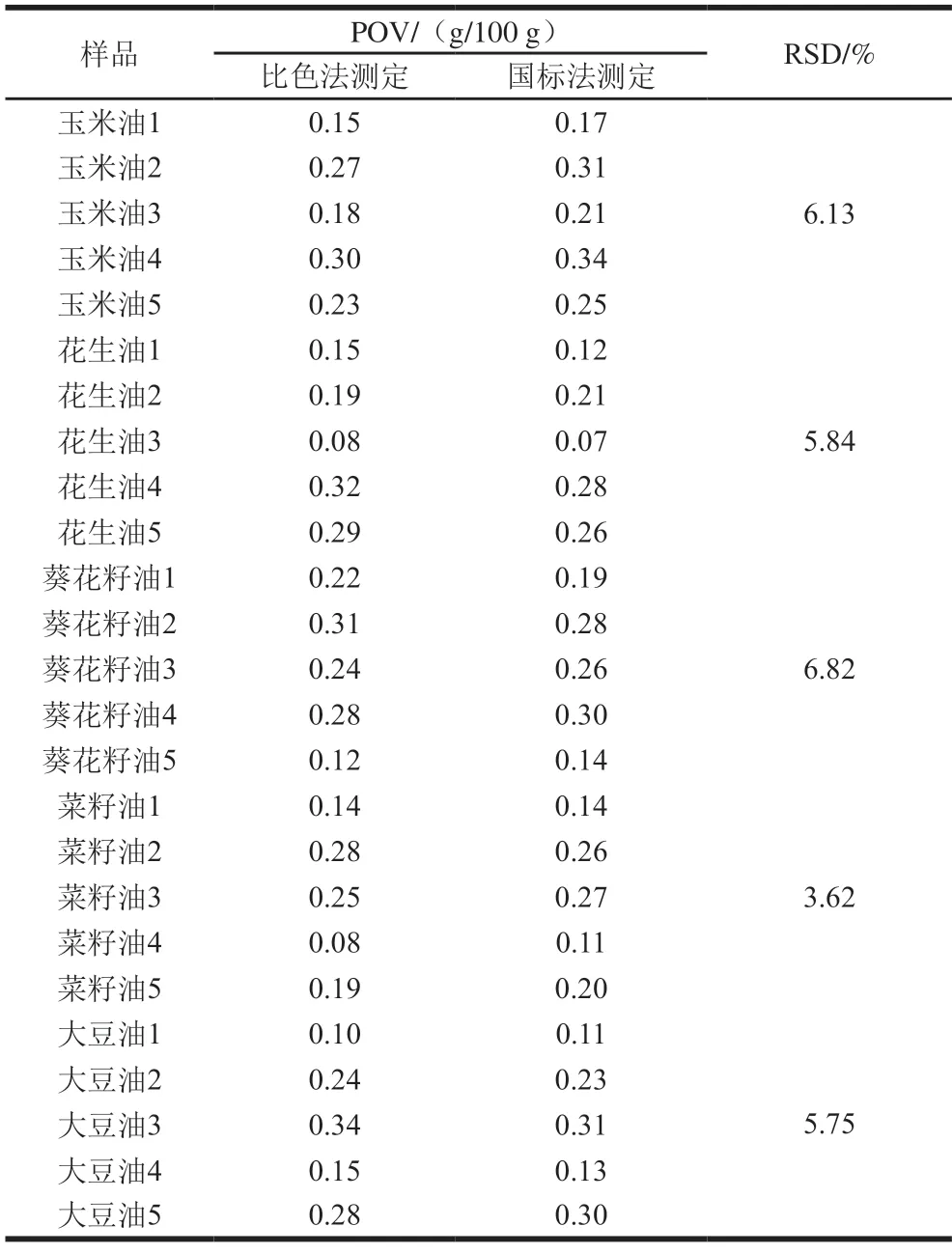
表3 不同方法测定食用油的POVTable 3 POV of oil samples measured by different methods
图12为实际食用油样品反应后的颜色(在国家标准中规定的食用植物油POV限定值(0.25 g/100 g)附近)。玉米油、花生油、葵花籽油、大豆油反应后色泽均为蓝色,虽然菜籽油反应后见少许原油颜色,但并未影响其在652 nm波长处的吸光度。

图12 食用油反应后颜色Fig.12 Color changes of edible oil after reaction
3 结论
本研究基于Fe3O4@COOH纳米酶的类POD催化活性,建立了检测食用纯植物油POV的比色法。所制备的Fe3O4@COOH纳米酶,对H2O2和TMB具有强亲和力,在4 ℃冷藏保存50 d仍表现出较强的催化活性,可重复使用。在最佳检测条件下,5 种食用纯植物油的POV(0~0.3 g/100 g)与其比色方法的吸光度具有良好线性关系。无论对未知POV的食用纯植物油,还是对不同氧化方式(紫外灯照射、烘箱加热、自然放置)处理后的食用纯植物油,比色法均给出了准确的检测结果,表明本研究构建的比色法对食用植物油POV测定具有良好的实用性。
本方法操作简单、反应现象明显,且所使用的Fe3O4@COOH纳米酶具有超顺磁性,只需施加外部磁场即可分离重复使用,检测成本低,具有较大的实用前景。但Fe3O4@COOH纳米酶容易受温度影响,因此需进一步拓宽其温度适用范围。此外,人们饮食中也常用到调和油,如何将所建立的方法应用在调和油的POV测定中,也是未来需要研究的方向。

