Fe3O4@氧化石墨烯复合材料的吸附性能*
王晨洋,孙琳琳,2,余长磊,郝 鑫,冯东旭
(1.渭南师范学院 化学与材料学院,陕西 渭南 714099;2.陕西省煤基低碳醇转化工程研究中心,陕西 渭南 714099)
目前,经济的快速发展和人类的活动产生了严重的水污染问题,其中重金属污染在工业污染中所占比例较高,尤其在钢铁、电镀、皮革等工业中,铬的使用尤为广泛[1],导致排放的废水、废气和废渣中铬浓度较高。重金属铬污染会导致土壤和水体中铬的含量升高,昆虫、鱼类等生物在吞食了铬污染的食物后,铬也会在体内富集[2]。关于铬污染废水处理技术研究和应用已经成为关注的焦点问题之一。
磁性氧化铁来源丰富,具有化学稳定性好、耐酸碱性好、易从废水中分离和回收等特点,纳米尺度Fe3O4可用作重金属离子的吸附剂,其对污水处理方面的研究已引起了科学界的广泛关注[3]。范文娟等[4]采用化学共沉淀法制备了Fe3O4/活性炭复合材料作为吸附剂,m(吸附剂)=0.15 g、pH=3、吸附120 min吸附量最大,为33.21 mg/g,表现出较大的吸附能力,具有高回收率。何睿等[5]制备了氧化石墨烯(GO)和Fe3O4的磁性复合材料,该复合材料在ρ[Cr(Ⅵ)]=20 mg/L、m(吸附剂)=50 mg、吸附5 h,对Cr(Ⅵ)离子的吸附量最大,为19.66 mg/g,去除率为98.2%。吴鹏等[6]制备了Fe3O4@GO磁性纳米复合材料作为吸附剂,ρ[Pb(Ⅱ)]=30 mg/L、吸附200 min,去除率为95.39%,吸附量为40.85 mg/g;ρ[Pb(Ⅱ)]=40 mg/L、吸附300 min,吸附量为45.84 mg/g,去除率为96.87%。江华等[7]制备的磁性纳米Fe3O4@还原GO复合材料,pH=5、m(吸附剂)=0.03 g、初始ρ[Pb(Ⅱ)]=30 mg/L,对Pb(Ⅱ)离子的吸附量最大为60.18 mg/g,去除率为84.6%。
作者采用水热合成法制备Fe3O4@GO复合材料,通过X射线衍射仪、粒度分析仪及傅里叶红外光谱仪对Fe3O4及其复合材料的微结构进行了对比分析,研究了该材料在不同工艺参数如时间、pH、溶液初始质量浓度和吸附剂用量等条件下的吸附性能,探究了Fe3O4@GO复合材料在工业废水处理中的应用前景,为解决水污染的问题提供新的技术方法。
1 实验部分
1.1 原料、试剂与仪器
GO:苏州碳丰石墨烯科技有限公司。
FeCl2·4H2O:国药集团化学试剂有限公司;柠檬酸钠、尿素:上海阿拉丁生化科技股份有限公司;重铬酸钾:天津市红岩化学试剂厂。
X射线衍射仪(XRD):6100,扫描速度2°/min,Cu Kα靶,日本岛津公司;红外光谱仪(FTIR):TensorⅡ采用衰减全反射(ATR)方法,德国Bruker公司;紫外-可见分光光度计:Cary60,波长540 nm,安捷伦科技有限公司。
1.2 实验方法
1.2.1 纳米Fe3O4的制备
称取1 g FeCl2·4H2O、2.411 6 g柠檬酸钠和0.6 g尿素,于80 mL去离子水中溶解并在磁力搅拌下搅拌30 min,直至完全溶解。将反应物溶液放入100 mL的反应釜中,t=195 ℃反应4 h。离心、干燥,得到Fe3O4纳米粉体。
1.2.2 Fe3O4@GO纳米复合材料的制备
向0.1 g GO中加入20 mL去离子水,超声处理,使GO在去离子水中充分分散,将称取的1 g FeCl2·4H2O、2.411 6 g柠檬酸钠和0.6 g尿素于40 mL去离子水中溶解,并在磁力搅拌下搅拌30 min,直至完全溶解,再将其与GO溶液进行混合。将混合溶液放入100 mL的反应釜中,t=195 ℃反应4 h,得到Fe3O4@GO纳米复合材料。
1.3 吸附实验
选择不同的pH、初始ρ[Cr(Ⅵ)]、m(吸附剂)。向锥形瓶中加入一定量的吸附剂和50 mLρ[Cr(Ⅵ)]=20 mg/L溶液,探究Fe3O4@GO复合材料对Cr(Ⅵ)离子吸附性能的影响。分别调节pH=1、3、5.3、8、10;初始ρ[Cr(Ⅵ)]=10、20、30 mg/L;m(吸附剂)=10、20、30 mg。在振荡器上以150 /min速度振荡,静止10 min后取上清液,按V(磷酸)∶V(硫酸)=1∶1加入混合液,采用分光光度法在λ=540 nm条件下测定ρ[Cr(Ⅵ)]。
取不同的5个ρ[Cr(Ⅵ)]溶液,测量其吸光度,根据数据绘制质量浓度与吸光度的关系并进行拟合,得到曲线方程y=0.477 3x-0.054 4,R2=0.999 9。吸附量和去除率计算见公式(1)、(2)。
q=(ρ0-ρ)V/m
(1)
(2)
式中:q为吸附量,mg/g;为去除率,%;ρ0为Cr(Ⅵ)离子的初始质量浓度,mg/L;ρ为吸附后t时刻Cr(Ⅵ)离子的质量浓度,mg/L;V为溶液体积,L;m为所用吸附剂的质量,g。
2 结果与讨论
2.1 Fe3O4@GO纳米复合材料的微观结构表征
纳米Fe3O4及Fe3O4@GO纳米复合材料的XRD谱图见图1。
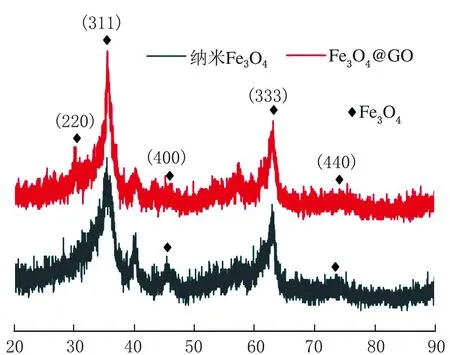
2θ/(°)图1 纳米Fe3O4及Fe3O4@GO纳米复合材料的XRD谱图
由图1可知,纳米Fe3O4在2θ=28.06°、35.78°、45.64°、60.98°、75.70°出现不同强弱的衍射峰,分别对应晶面(220)、(311)、(400)、(333)、(400),均为Fe3O4相。Fe3O4@GO纳米复合材料在2θ=29.06°、35.5°、42.64°、50.87°、60.98°出现不同强弱的衍射峰,分别对应晶面(220)、(311)、(400)、(511)、(400),这些峰同样均为Fe3O4相[8-9]。通过对比发现,Fe3O4@GO纳米复合材料未呈现出GO的晶面结构,是因为GO的结构尺寸小、含量少。
纳米Fe3O4和Fe3O4@GO纳米复合材料的FTIR谱图见图2。

σ/cm-1图2 纳米Fe3O4和Fe3O4@GO纳米复合材料的FTIR谱图

2.2 工艺参数对Cr(Ⅵ)离子吸附性能的影响
2.2.1 时间对吸附性能影响
m(吸附剂)=20 mg、初始ρ[Cr(Ⅵ)]=20 mg/L、pH=5.3,纳米Fe3O4、Fe3O4@GO纳米复合材料随时间变化的吸附量和去除率曲线见图3。
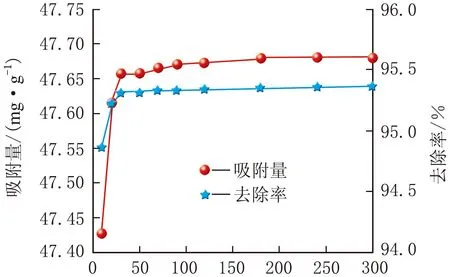
t/mina 纳米Fe3O4
由图3可知,t<70 min,纳米Fe3O4粒子达到平衡吸附量,为47.68 mg/g,去除率最大为95.3%;t=120 min,Fe3O4@GO纳米复合材料的吸附量达到平衡,吸附量最高为47.90 mg/g,去除率为95.8%。吸附量随时间增加而增加,后趋于平衡。该现象是因为在最开始阶段纳米粒子和复合材料表面含有大量的活性位点未被填充,Cr(Ⅵ)离子在溶液中与裸露在外面的活性位点快速反应,结合在一起;随着吸附时间的增加,活性位点逐渐被填充完全。此外,在水溶液中磁性Fe3O4颗粒容易团聚在一起,在一定程度上会减少Cr(Ⅵ)离子与活性位点结合的能力,所以吸附速率开始有所降低,吸附量逐渐到达平衡。掺杂GO之后吸附和去除Cr(Ⅵ)离子的能力均得到了提升,因为GO具有高稳定性和大比表面积,使Fe3O4@GO纳米复合材料比纳米Fe3O4有更优异的吸附性能。
2.2.2 pH对吸附性能的影响
m(吸附剂)=20 mg、初始ρ[Cr(Ⅵ)]=20 mg/L,Fe3O4@GO纳米复合材料在不同pH下对Cr(Ⅵ)离子的吸附量见图4。
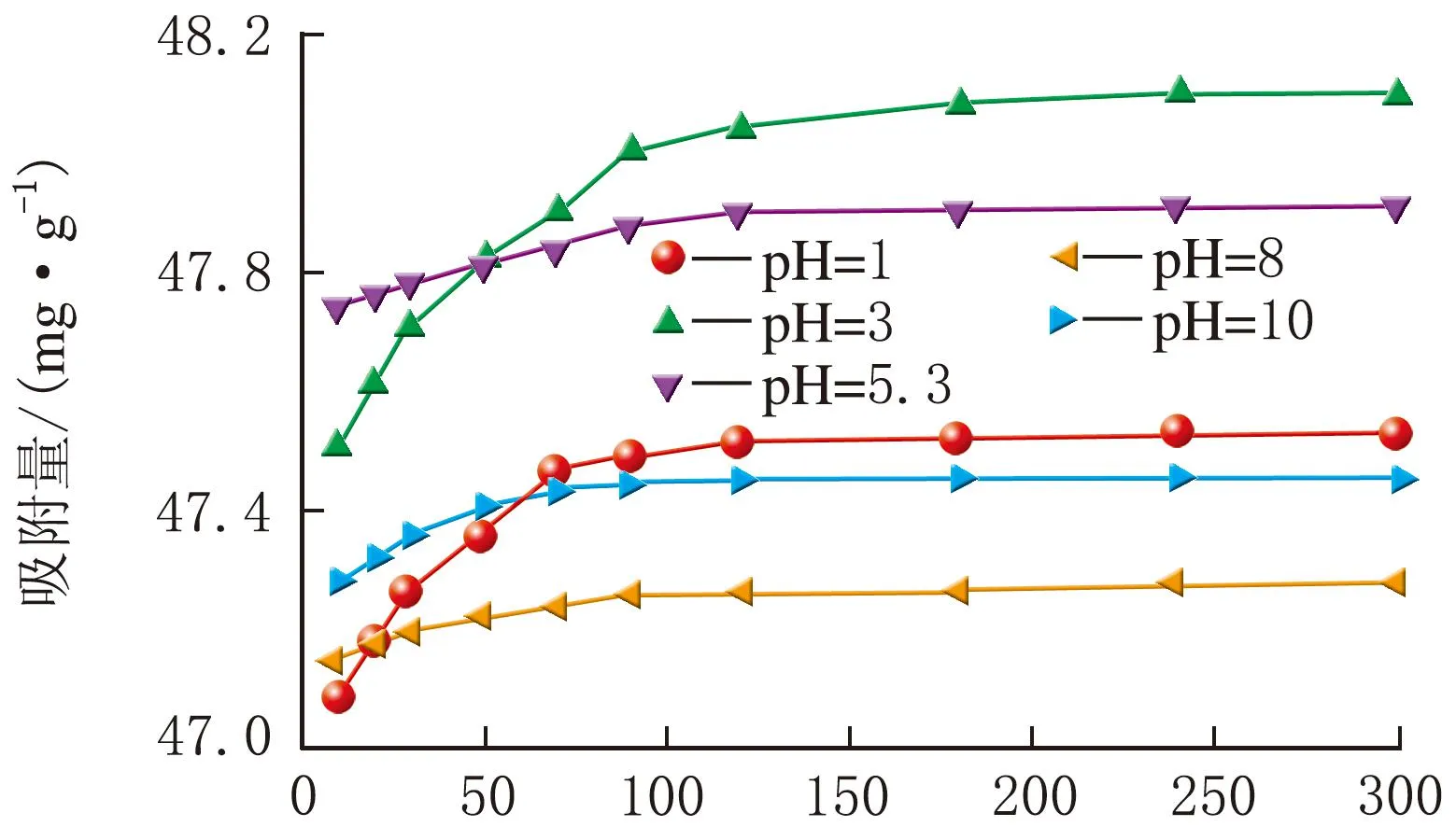
t/min图4 pH对吸附性能的影响
2.2.3 初始ρ[Cr(Ⅵ)]对吸附性能的影响
m(吸附剂)=20 mg、pH=5.3,Fe3O4@GO纳米复合材料在不同初始ρ[Cr(Ⅵ)]下对Cr(Ⅵ)离子的吸附性能曲线见图5。
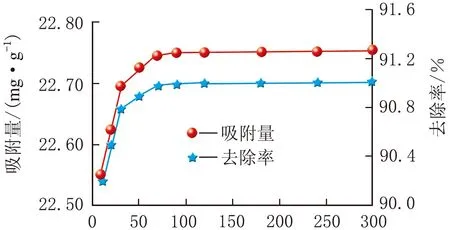
t/mina 初始ρ[Cr(Ⅵ)]=10 mg/L
由图5可知,初始ρ[Cr(Ⅵ)]=30 mg/L,t=90 min基本达到平衡,吸附量为70.01 mg/g,去除率为93.35%。因为初始ρ[Cr(Ⅵ)]越大,Cr(Ⅵ)离子越容易扩散到吸附剂的活性位点上面,对溶液中的Cr(Ⅵ)离子吸附量越大。
2.2.4m(吸附剂)对吸附性能的影响
初始ρ[Cr(Ⅵ)]=20 mg/L、pH=5.3,Fe3O4@GO纳米复合材料在不同m(吸附剂)下对Cr(Ⅵ)离子的吸附性能曲线图见图6。
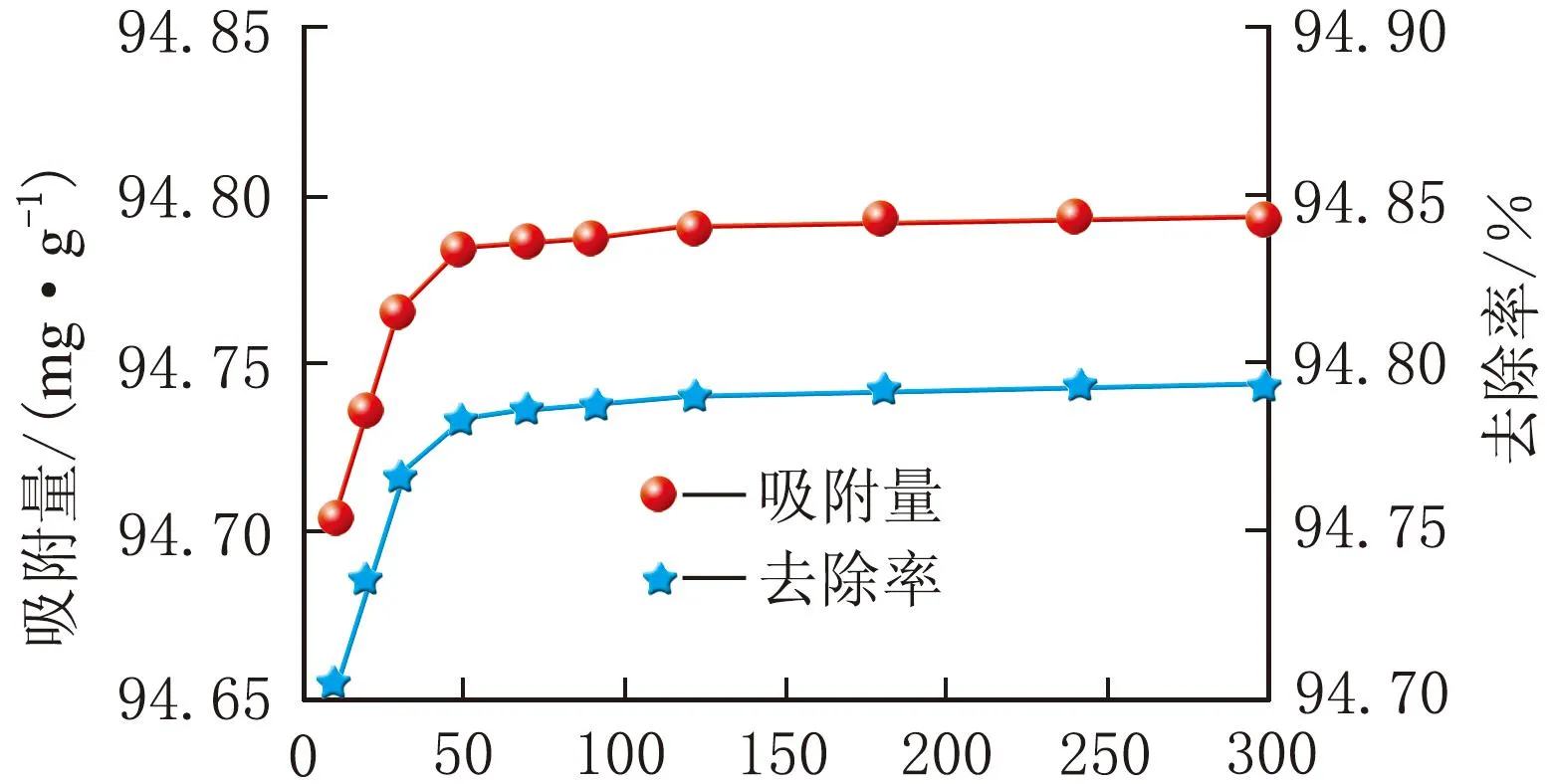
t/mina m(吸附剂)=10 mg
由图6可知,m(吸附剂)=10 mg,吸附效果最好,Fe3O4@GO纳米复合材料的吸附量为94.79 mg/g,去除率为94.79%。m(吸附剂)越大,吸附效果逐渐降低,因为吸附剂用量多容易团聚,导致吸附剂的表面活性位点变少,吸附性能下降。
2.3 Fe3O4@GO纳米复合材料的多次吸附
Fe3O4@GO纳米复合材料循环性能测试见图7。
由图7可知,Fe3O4@GO纳米复合材料经过5次循环吸附后吸附量仍为46.58 mg/g,为初次吸附率的97.26%,证明该复合材料可以进行反复吸脱附后仍具有较高的稳定性及良好的循环使用性能。
3 结 论
(1)通过水热法成功制备了Fe3O4@GO纳米复合材料,加入GO改善了纳米Fe3O4的微观结构,增大了比表面积,因此对Cr(Ⅵ)离子吸附能力有所提高。
(2)pH=3,Fe3O4@GO纳米复合材料的吸附量最大为48.09 mg/g;初始ρ[Cr(Ⅵ)]=30 mg/L,Fe3O4@GO纳米复合材料吸附量最大为70.01 mg/g;m(吸附剂)=10 mg,Fe3O4@GO纳米复合材料吸附量最大为94.79 mg/g。
(3)在经过5次循环吸附之后,Fe3O4@GO纳米复合材料吸附量仍为46.58 mg/g,由此可知,Fe3O4@GO纳米复合材料具有很好的稳定性,可以多次重复使用。