栝楼桂枝汤调节小胶质细胞活化后的表型转化缓解脑缺血再灌注大鼠模型的神经损伤
钟兴华,杨劲博,胡海霞
(福建中医药大学科技创新与转化中心,福建 福州 350122)
缺血性脑卒中常伴随着严重的并发症,有较高的致残率,给社会、家庭带来沉重负担[1-2]。脑卒中后脑损伤是由多种细胞相互作用引起的级联反应,脑卒中后过度的神经炎症反应是导致神经元功能异常的主要因素之一[3]。研究表明缺血性脑损伤后的炎症反应会使小胶质细胞活化,活化后的小胶质细胞会转化为M1 型(促炎型)及M2 型(抗炎型)2 种表型,M1 型小胶质细胞会释放过量的促炎因子,导致炎症反应持续进展,使突触结构异常和突触减少[4-6],进而导致神经元的损伤[7]。相比之下,M2 型小胶质细胞会增强吞噬活性以清除碎片,并产生许多抗炎和修复因子。因此调节小胶质细胞活化后的表型转化,抑制卒中后过度的炎症反应,可改善神经损伤,为缺血性脑卒中治疗提供了重要的研究方向。
栝楼桂枝汤来源于《金匮要略》,治疗外感热病引起的肢体痉挛,也可用于缓解卒中后肢体痉挛[8]。研究证实:栝楼桂枝汤可缓解缺血再灌注损伤模型大鼠卒中后痉挛状态,抑制神经细胞的凋亡,且可明显降低脑内小胶质细胞的活化及炎症因子、趋化因子的表达[9],但其具体机制尚不明确。本研究通过建立脑缺血再灌注大鼠模型,调控小胶质细胞活化后的炎症反应,进一步明确栝楼桂枝汤对脑保护的分子作用机制,为栝楼桂枝汤治疗缺血性脑卒中提供科学依据。
1 实验材料
1.1 实验动物 SPF 级健康雄性SD 大鼠30 只,8~12 周龄,体质量(240±20)g,购自上海斯莱克实验动物责任有限公司,实验动物生产许可证号:SYXK(闽)2019-0007,饲养于福建中医药大学实验动物中心,实验动物使用许可证号:SYXK(闽)2019-0007。将小鼠置于笼具中饲养,室温22~24 ℃,相对湿度50%~60%。本研究已通过福建中医药大学动物伦理委员会审核(FJTCM IACUC 2020086)。
1.2 实验药物 栝楼桂枝汤由栝楼根30 g,桂枝9 g,生姜9 g,白芍9 g,大枣9 g,甘草6 g 组成,购自福建中医药大学附属第三人民医院。栝楼桂枝汤水提液制备:加5 倍量水,浸泡30 min,加热回流2 次,每次1 h,滤液合并浓缩至1.06 g/mL。
1.3 实验试剂 大鼠白细胞介素-1(IL-1)ELISA试剂盒(合肥莱尔生物科技有限公司,货号:LEB1145);精氨酸酶1(Arg-1)抗体(武汉三鹰生物科技有限公司,货号:66129-1);组织相容性复合物-Ⅱ(MHC-Ⅱ,货号:ab92511)、离子钙接头蛋白(Iba-1,货号:ab178846)、微管相关蛋白2(MAP-2,货号:ab5392)抗体均购自英国Abcam 公司;DAB 显色试剂盒(货号:DA1015)、中性树胶(货号:G8590-100ML)、柠檬酸钠缓冲液(货号:C1010-2L)均购自北京索莱宝科技有限公司。
1.4 实验仪器 7500 荧光定量PCR 仪(美国ABI公司);石蜡包埋机(临沂爱华生物科技有限公司,型号:BMJ-1B)。
2 方 法
2.1 分组与造模 将SD 大鼠随机分为假手术组10 只和造模组20 只。造模组采用改良型线栓法[10]使大鼠左侧大脑中动脉发生梗死,1.5 h 后再灌注建立脑缺血再灌注模型;假手术组仅钝性分离颈部肌肉血管,不插入线栓。采用Longa 评分[11]进行神经功能损伤程度的评价,1~3 分视为造模成功。采用抽签法将造模成功的大鼠分成模型组和栝楼桂枝汤组各10 只。
2.2 干预 于造模成功后第2 天开始灌胃干预,栝楼桂枝汤组按0.15 mg/(kg·d)给予栝楼桂枝汤药液灌胃,假手术组和模型组按10 mL/(kg·d)给予生理盐水灌胃,每日1次,持续灌胃1 周。
2.3 神经行为学评分 采用Longa 评分[11]对干预前后神经功能缺损状态进行评估。① 大鼠可自主活动,没有神经功能异常状态,计为0 分;② 提尾时,前肢不能完全屈伸,计为1 分;③ 自主行动时,大鼠向大脑缺血侧病灶对侧转圈,计为2 分;④ 自主行动时,大鼠身体向大脑缺血侧病灶对侧歪斜,计为3 分;⑤ 大鼠不能自主行走,有意识昏迷,计为4 分。评分越高则说明大鼠神经功能缺损越严重。
2.4 取材 2%的戊巴比妥钠动物麻醉后,腹主动脉取血,静置30 min 后,12 000 r/min 离心30 min,取血清于-20 ℃冻存,用于后续ELISA 实验。同时各组选取部分大鼠脑组织于-20 ℃冻存,用于Western blot 实验。剩余大鼠从左心室灌注生理盐水约100 mL,然后抽取50 mL 4%多聚甲醛继续灌注,固定脑组织,随后断头取脑,进行脱水、石蜡包埋以及切片,用于HE 染色及免疫组化实验。
2.5 ELISA 法检测大鼠血清IL-1 含量 取外周血血清,每组单次设3 个复孔,独立重复实验3 次以上,按ELISA 试剂盒说明书进行操作,绘制标准曲线,检测并计算IL-1 含量。
2.6 HE 染色观察大鼠脑组织病理形态 石蜡切片置于梯度酒精脱蜡,随后分别用苏木素与伊红染色细胞核与细胞质,PBS 溶液清洗,中性树脂封片。光学显微镜下观察大鼠大脑脑组织细胞形态并拍照。
2.7 Western blot 检测大鼠脑组织MHC-Ⅱ、Arg-1蛋白表达量 取各组脑组织使用蛋白裂解液提取总蛋白,BCA 法测定浓度。经电泳、转膜,快速封闭液封闭15 min,分别加入MHC-Ⅱ(1∶1 000)、Arg-1(1∶8 000)、vinculin(1∶1 000)抗体,4 ℃孵育过夜,TBST 溶液洗膜后,再加兔二抗(1∶5 000)及鼠二抗(1∶3 000),37 ℃下孵育1 h,TBST 溶液洗膜3 次后加ECL 化学发光剂显影。应用Image Lab 图像分析软件测定目的条带灰度值,计算目的蛋白表达量。
2.8 免疫组化观察大鼠脑组织Iba-1、MAP-2 蛋白表达水平 取大鼠脑组织,制备蜡块,并包埋切片备用。将石蜡切片放入柠檬酸盐缓冲溶液中,水浴加热10 min,冷却至室温后,PBS 溶液清洗3 次。切片上滴加封闭液,室温下封闭20 min。在切片上滴加Iba-1 及MAP-2 一抗,4 ℃孵育过夜,PBS 溶液清洗3次。在切片上滴加二抗,37 ℃下孵育抗体20 min,PBS 溶液清洗3 次。在切片上滴加辣根酶标记链霉卵白素工作液(S-A/HRP),37 ℃孵育20 min。随后在切片上滴加DAB 显色试剂,显微镜观察并拍照后,若出现棕色或棕褐色表示Iba-1、MAP-2 阳性。应用ImageJ 软件计数400 倍镜下随机5 个视野的阳性细胞数,取平均值,求得阳性细胞数目。
2.9 统计学方法 采用SPSS 23.0 软件进行数据处理。计量资料符合正态分布以(±s)表示,组间比较采用单因素方差分析,两两比较方差齐性采用LSD-t检验,方差不齐采用Games-Howell 检验。P<0.05 为差异有统计学意义。
3 结 果
3.1 3 组干预前后Longa 评分比较 见表1。
表1 3 组干预前后Longa 评分比较(±s) 分
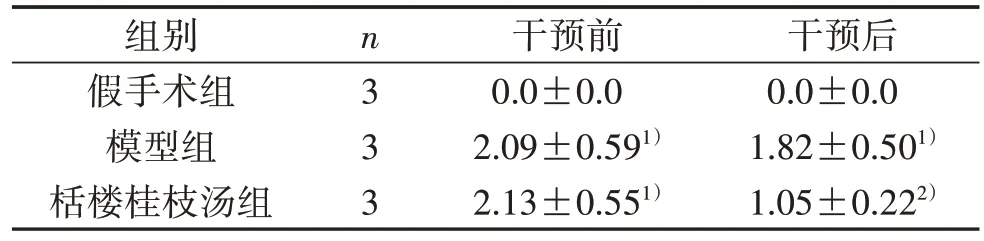
表1 3 组干预前后Longa 评分比较(±s) 分
注:与假手术组比较,1) P<0.05;与模型组比较,2) P<0.05。
干预后0.0±0.0 1.82±0.501)1.05±0.222)组别假手术组模型组栝楼桂枝汤组n333干预前0.0±0.0 2.09±0.591)2.13±0.551)
3.2 3 组血清IL-1 含量比较 见图1。
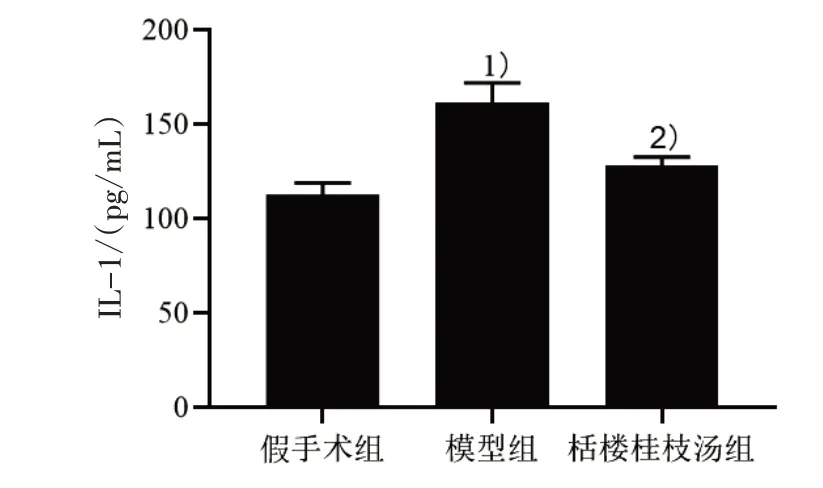
图1 3 组血清IL-1 含量比较
3.3 3 组脑组织病理形态变化 假手术组大鼠脑组织结构清晰完整,神经细胞均匀分布,无异常;模型组大鼠脑组织结构排列紊乱,神经元被破坏,出现细胞皱缩、细胞核深染现象,同时大量炎性细胞贯穿脑组织;与模型组比较,栝楼桂枝汤组脑组织结构均趋于正常,神经细胞坏死显著减少。见图2。
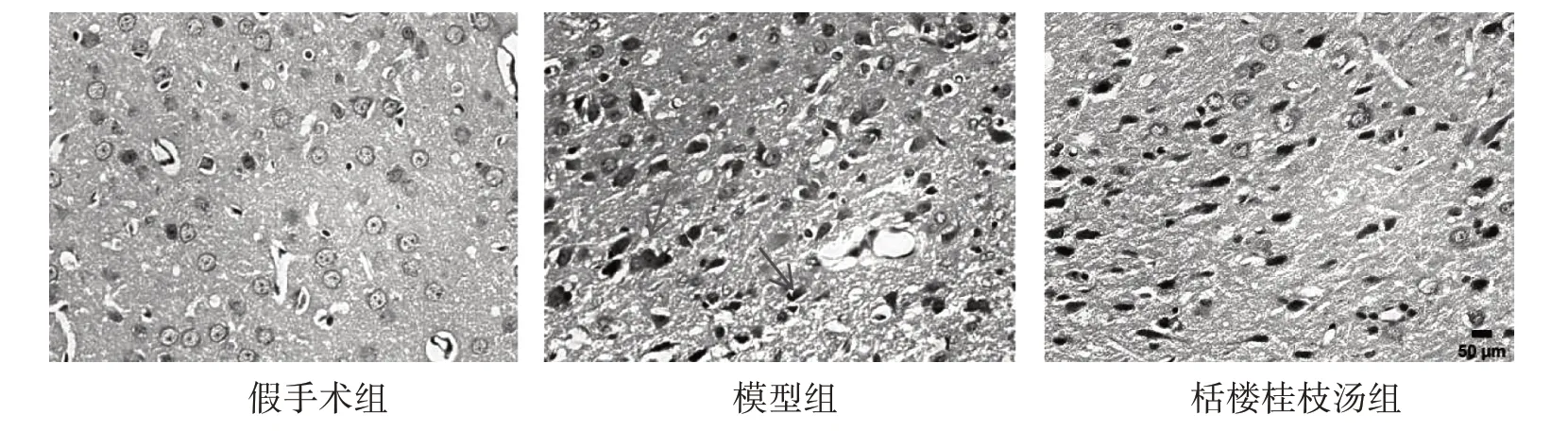
图2 3 组脑组织HE 染色图(×400)
3.4 3组脑组织MHC-Ⅱ、Arg-1蛋白表达量比较 见图3。

图3 3 组脑组织MHC-Ⅱ、Arg-1 蛋白表达量比较
3.5 3 组脑组织Iba-1、MAP-2 蛋白表达水平比较 假手术组Iba-1 阳性表达较少,颜色较浅,MAP-2 阳性表达较多,颜色较深。与假手术组比较,模型组Iba-1 阳性表达明显增多(P<0.05),颜色为棕褐色;MAP-2 蛋白表达明显减少(P<0.05),并且神经元细胞变小,排列不规则,棕黄色染色颗粒较少。与模型组比较,栝楼桂枝汤组Iba-1 阳性表达明显降低(P<0.05),MAP-2 阳性表达明显提高(P<0.05)。见图4、图5。

图4 3 组脑组织Iba-1、MAP-2 免疫组化图(×400)
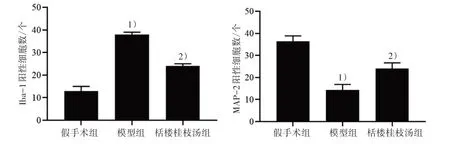
图5 3 组脑组织Iba-1、MAP-2 蛋白表达水平比较
4 讨 论
越来越多的证据表明缺血后产生的炎症反应是致病过程的重要促成因素[12],缺血性卒中早期产生的炎症反应会促进脑梗死的发展,致使缺血半影区发生不可逆的损伤,加剧缺血再灌注损伤[13]。小胶质细胞是大脑的免疫调节器,在正常条件下不断监测大脑微环境[14-15],它的活化在神经炎症的进展中尤为重要[16]。脑缺血后引起的炎症反应会引起小胶质细胞表型的转化,即M1 型(促炎型)或M2型(修复型)2 种表型,小胶质细胞活化后的M1 表型会产生损伤神经的细胞因子,进而加重神经炎症,引起神经元细胞的损伤[17-18],而M2 表型则会产生相应的神经保护介质。脑卒中后坏死神经细胞的清除以及脑梗死后神经功能的恢复需要小胶质细胞的活化[19]。
脑卒中后肢体痉挛归属于中医学“痉病”范畴,病机为气血阴阳失衡,筋脉失于濡养,因此治则当以调和气血阴阳、滋养筋脉为主。栝楼桂枝汤中天花粉清热润燥、濡润筋脉;桂枝、白芍互用,酸甘化阴,具有通缓脉络之效;大枣、生姜可资助脾胃之气,促进周身气血运化;甘草调和诸药之性。诸药互通互用,具有柔润筋脉、解肌止痉的功效。临床研究发现栝楼桂枝汤可改善中风后肢体痉挛患者的肢体运动功能及生活活动能力[1]。相关基础研究也提示栝楼桂枝汤可以调控HIF-1α 信号通路,进而促进脑卒中后脑血管的再生,进而缓解神经细胞损伤、改善脑缺血再灌注大鼠神经功能缺损状态[20]。本课题组前期研究也表明栝楼桂枝汤可改善脑缺血再灌注大鼠的运动功能障碍,可降低患侧脑组织的炎症反应水平,抑制神经元的凋亡,保护缺血半暗带[21-23]。
Iba-1 也称为同种异体移植炎症因子,是细胞骨架结合蛋白,参与活化小胶质细胞/巨噬细胞状态相关的形态变化,是小胶质细胞的特异性标志物,可以反映小胶质细胞的活化[24]。MAP-2 是神经元特异性的细胞骨架蛋白,主要表达在轴突,能够作为神经细胞的表型标记物,与中枢神经系统内神经元的形态、生长及功能密切相关,可以充分反应神经细胞的损伤[25]。本研究结果显示:与假手术组比较,模型组Logna 评分明显升高,血清IL-1含量明显提高,病理形态显示脑组织神经元结构破坏及炎性细胞浸润情况明显,大鼠脑组织Iba-1 蛋白表达水平明显提高,MAP-2 蛋白表达水平明显降低,提示脑缺血再灌注模型大鼠炎症反应明显。栝楼桂枝汤干预结束后,脑缺血再灌注大鼠Logna评分明显降低,外周血IL-1 含量明显减少,缺血侧脑组织炎症浸润、神经元损伤程度明显改善,Iba-1蛋白表达水平明显降低,MAP-2 蛋白表达水平明显提高,提示栝楼桂枝汤能减轻脑卒中后的炎症反应,改善脑缺血再灌注大鼠卒中后的神经功能缺损。
MHC-Ⅱ主要位于抗原提呈细胞上,能够将细胞外来抗原利用MHC-Ⅱ提呈给辅助细胞,激活免疫细胞,从而引起机体的炎症反应,是M1 型小胶质细胞的常用标记物[26]。Arg-1 为M2 型小胶质细胞最佳标记物之一,可以通过促进病原体的识别、结合和内溶质作用来介导抗炎反应,主要受信号转导和转录活化因子6(STAT6)调控,因此是重要的抗炎因子,可抑制炎症反应并促进机体修复[27]。本研究结果显示:与假手术组比较,模型组MHC-Ⅱ蛋白表达量明显升高,Arg-1 蛋白表达量明显降低,提示脑缺血再灌注大鼠脑组织中M1 型小胶质细胞的表达增多,M2 型小胶质细胞的表达减少。与模型组比较,栝楼桂枝汤组MHC-Ⅱ蛋白表达量明显降低,Arg-1 蛋白表达量明显升高,提示栝楼桂枝汤可以促进脑缺血再灌注大鼠脑组织中M2 型小胶质细胞的表达,抑制M1 表型的表达。
综上所述,栝楼桂枝汤可能通过调控小胶质细胞活化后的表型,即上调M2 表型,下调M1 表型,从而抑制炎症反应,改善脑缺血再灌注大鼠的神经细胞损伤。但是,炎症反应涉及多种调控通路,级联反应复杂,栝楼桂枝汤通过调控小胶质细胞活化减弱缺血性脑卒中后炎性反应,其机制是否涉及相应调控通路,还需要进一步研究。

