Ag 对Ag-ZnO 纳米抗菌涂层微观结构和性能的影响
李 伟,张 卓,张镨丹,章 浩,马 迅
(1.上海理工大学 材料与化学学院,上海 200093;2.上海长海医院 创伤骨科,上海 200433)
Ti6Al4V 螺钉在骨科手术中广泛应用于治疗骨折、骨骼畸形和关节置换等骨骼问题[1]。尽管Ti6Al4V 具有许多出色的性能特点,但它们无法有效抵御金黄色葡萄球菌等致病菌的粘附和生长[2],容易在其表面形成生物膜,进而导致严重的感染和植入失败。近年来,随着对抗生素耐药性的菌株的增多,人们重新关注无机抗菌剂,如Ag[3]、Cu[4]和Zn[5]等,将无机抗菌剂应用于Ti6Al4V 螺钉表面有望成为解决骨科植入体感染问题的方法。
抗菌涂层可涂覆在骨科 Ti6Al4V 螺钉表面以防止细菌粘附和生物膜的形成[6],这些涂层通常被设计成能在一段时间内释放抗菌物质,如Ag+或Zn2+等金属离子,以抑制细菌生长[7-8]。在各项研究中,使用抗菌涂层可以有效减少细菌的附着和生物膜的形成。Diez-Escudero 等[9]在多孔Ti6Al4V 表面镀Ag,显著降低了金黄色葡萄球菌和表皮葡萄球菌等常见病原体形成生物膜的风险,促进骨骼愈合。另一项体外研究[10]表明,与无涂层的不锈钢或钛植入物相比,有Ag 涂层的可以显著减少细菌数量。Abdulkareem 等[11]利用电流体动力学沉积技术将ZnO 纳米粒子和HA 纳米粒子包覆在Ti 植入体上,其抗菌率达90%以上。Ag 还被证明具有抗病毒和抗真菌的特性[12]。
尽管Ag 作为抗菌剂具有很多优点,人们仍然担心其安全性和潜在的副作用。Ag+可以与人体细胞中的蛋白质和酶结合,导致细胞功能障碍和细胞死亡[13]。然而有研究[14]表明,Ag 对人体细胞的伤害比对细菌细胞的要小,其毒性取决于Ag+的浓度和接触时间。因此,通过合理控制涂层中Ag 和Zn 等抗菌剂的含量有望开发出符合人体安全标准的植入体抗菌涂层,对解决骨科植入体感染这一术后并发症问题具有重要意义。
本试验通过射频磁控溅射技术,调整Ag、ZnO 和Ti 3 种靶材的体积比,在Ti6Al4V 表面研制出Ag 质量分数具有梯度变化的Ag-ZnO/Ti 复合抗菌涂层,研究了Ag 质量分数的变化对Ag-ZnO/Ti涂层的微观形貌、表面粗糙度、接触角以及Ag+和Zn2+释放速率的影响,并采用CCK-8(Cell Counting Kit-8 试剂)法和共培养-平板涂布法重点研究了Ag-ZnO/Ti 复合涂层的细胞毒性和抗菌活性,最终探究了涂层中Ag 质量分数的变化对涂层微观形貌以及对金黄色葡萄球菌抗菌性能的影响。
1 试验材料及方法
1.1 涂层的制备
采用JGP-450 型高真空磁控溅射薄膜沉积系统制备Ag-ZnO/Ti 复合抗菌涂层,所使用的靶材由体积分数为1%、2%、3%、4%的Ag 靶材、固定体积分数2%的ZnO 靶材、Ti 靶材3 种靶材拼接而成,拼接靶材直径50 mm、厚度3 mm。基底选用了直径10 mm×厚度1 mm 的Ti6Al4V 片。沉积涂层时使用的靶材如图1 所示,将分别镶嵌了体积分数1%、2%、3%和4%Ag 靶材的复合靶材制备出的样品依次命名为1-Ag/Zn 组、2-Ag/Zn 组、3-Ag/Zn 组和4-Ag/Zn 组。当基底和靶材安装完毕后开始抽真空,当真空度下降至6×10-4Pa 以下时,对腔体通入氩气,氩气流量30 sccm,沉积功率35 W,自转速率5 r/min,预溅射15 min 清除靶材表面的氧化物等杂质,其中预溅射采用的气压为8 Pa。以上准备工作完成后,调整气压至75 ×10-2Pa 并转动挡板,开始沉积涂层,待沉积完毕后,取出样品密封保存。
图1 Ag、ZnO 和Ti 靶材拼接示意图Fig.1 Splicing diagram of Ag,ZnO and Ti targets
1.2 涂层的结构及性能表征
采用D8 Advance X 射线衍射仪(X-ray diffraction,XRD)对涂层进行物相分析,检测方法为广角X 射线衍射法,取30°~80°范围的衍射角,以4(°)/min 的速度进行扫描。采用Zeiss Sigma-300 型扫描电子显微镜(scanning electron microscope,SEM)观察涂层表面形貌。采用Dimension Icon 原子力显微镜(atomic force microscopy,AFM)对涂层的微观三维形貌及表面粗糙度进行表征。采用JC2000C1 型接触角测量仪反映涂层表面的润湿性。采用JXA-8530F Plus 场发射电子探针显微分析仪(electron probe X-ray micro-analyser,EPMA)测定涂层的化学成分。
1.3 涂层的离子释放试验
在本研究中,采用美国安捷伦公司生产的Agilent 720ES 电感耦合等离子体质谱仪(inductively coupled plasma mass spectrometer,ICP-MS)测定涂层在不同时间点(12、24、36、48、72 h)释放出的Ag+和Zn2+的浓度。具体测试时每次取1 mL 同组试管中的磷酸盐缓冲溶液(phosphate buffer saline,PBS)检测其中Ag+和Zn2+浓度,同时对试管补加相同体积的PBS。以上测试每组样品重复3 次。
1.4 涂层的细胞毒性试验
本试验通过CCK-8 法测定在不同时间点(12、24、36、48、72 h)大鼠骨髓间充质干细胞(rat bone marrow mesenchymal stem cells,rBMSCs)的活力值,以判断涂层的细胞毒性是否符合生物安全标准。试验采用对数生长期的rBMSCs,按上述分组处理,将细胞按照1.5×104的密度接种到96 孔板中,然后置于恒温培养箱内在5%(体积分数)CO2和37 ℃的条件下培养24、72、120 h。在每个培养完成的时间点移除培养基,用PBS 洗涤各孔3 次并加入1 000 μL含 10%(体积分数)CCK-8 的培养基,然后再次放进5%CO2和37 ℃的恒温培养箱中培养2 h。最终培养完成后,每孔取800 μL 的上清液到新的24 孔板中,用酶标仪检测450 nm 处的吸光度。
对每组样品的细胞相对活力(relative growth rate,RGR)采用以下公式计算:
式中:RGRx代表编号为x的样品组的细胞相对活力;Ox则是其对应的吸光度;O1为空白组 Ti6Al4V的吸光度;Ob为背景吸光度,即多孔板本身未加培养基和细胞的吸光度。将得到的各组的RGR按照表1 对其细胞毒性进行分级。
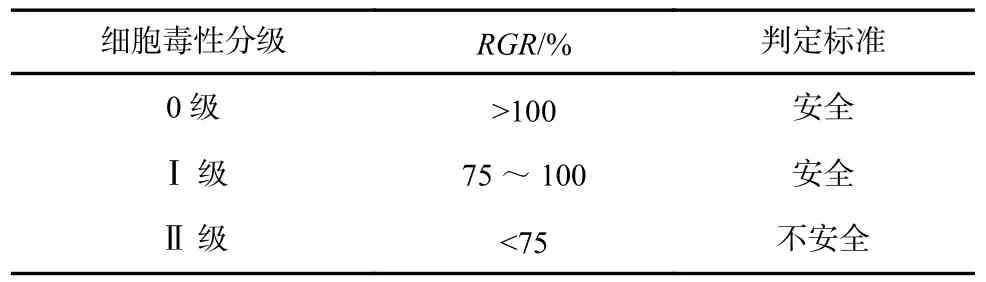
表1 细胞毒性分级判断标准Tab.1 Criteria for grading cytotoxicity
1.5 涂层的抗菌性能试验
采用共培养-平板涂布法测试涂层对金黄色葡萄球菌的抗菌性能。将样品放入24 孔板中,用移液器在对应的孔中依次滴入500 μL 的菌悬液。再将载有样品和菌悬液的24 孔板放入恒温培养箱,在37 ℃恒温条件下共培养24 h。待培养完成后,从培养箱中取出24 孔板,通过轻微振动以分离样品表面上的菌悬液使其脱落,然后移除孔中的共培养样品并收集孔中的菌悬液,将后者转移到无菌容器中用PBS 稀释后用于平板涂布,通过涂布棒均匀涂布在这些平板的表面。对平板编号后放入37 ℃恒温培养箱,24 h 后取出琼脂平板对其表面的菌落数量进行统计。为了定量比较各组样品的抗菌效果,本试验采用抑菌率计算样品的抗菌性能,计算公式如下:
式中:Rx代表编号为x的样品的抑菌率;C1代表空白组琼脂平板表面的菌落数量(CFU/片);Cx代表第x组琼脂平板表面的菌落数量(CFU/片)。参考国家标准《HG/T 3 950-2007》中对涂层抗菌性能的划分标准,可以对样品组的抗菌性能进行分级:当Rx≥99%时,样品具有强抗菌性,为I 级;当90%≤Rx≤99%时,样品具有抗菌性,为II 级。
2 结果与讨论
2.1 微观形貌
各组样品表面SEM 图如图2 所示,Ag-ZnO/Ti复合涂层样品的表面都形成了球形纳米颗粒,间距清晰且分布均匀,平铺在整个基底表面上。其中1-Ag/Zn 组涂层表面的纳米颗粒最为细小,平均粒径仅为26 nm,间距最大。随着Ag 质量分数的递增,纳米颗粒的尺寸和数量都有所增加,大颗粒间平铺了致密的小颗粒,表面形貌粗糙。

图2 Ag-ZnO/Ti 复合涂层表面SEM 图Fig.2 SEM images of Ag-ZnO/Ti composite coating surfaces
图3 为Ag-ZnO/Ti 复合涂层样品的XRD 谱图。图3 中仅能观察到3-Ag/Zn 组和4-Ag/Zn 组中Ag(111)晶面和Ag(220)晶面的衍射峰,未观察到ZnO 的结晶峰,可能与其含量较低有关。涂层表面纳米颗粒的数量和粒径尺寸上有所增长,是因为Ag 在涂层表面上形成了更多的成核位点,有利于纳米颗粒的形成并吸附更多的Ag,从而快速长大,因此,Ag-ZnO/Ti 复合涂层中的Ag 倾向于以纳米颗粒堆垛的形式长大,从而形成连续薄膜或涂层。

图3 Ag-ZnO/Ti 复合涂层的XRD 谱图Fig.3 XRD patterns of the Ag-ZnO/Ti composite coatings
表2 总结了各组样品EPMA 表征结果,随着拼接靶材中Ag 靶体积比的增大,Ag 质量分数由0.77%增长到了3.63%。尽管ZnO 靶材体积不变,但涂层中Zn 质量分数出现了微量的增长,这是因为溅射气氛中活跃的Ag 与ZnO 靶材发生碰撞,从而将更多的动能传递给了ZnO,使其挣脱表面结合能成为离位原子并溅射在基底表面。

表2 Ag-ZnO/Ti 复合涂层中Ag、Zn 和Ti 的质量分数Tab.2 Mass fractions of Ag,Zn and Ti in Ag-ZnO/Ti composite coatings
由图4 复合涂层的 AFM 图可知,随着Ag 质量分数的递增,纳米颗粒的数目逐渐增多,表面逐渐粗糙,与SEM 结果一致,证实了Ag 对Ag-ZnO/Ti 复合涂层表面形貌的影响。其中,3-Ag/Zn 组样品表面出现纳米粒子团聚现象,4-Ag/Zn 组中团聚现象消失,表面的纳米颗粒密度更高,均匀性更好。

图4 Ag-ZnO/Ti 复合涂层的AFM 图Fig.4 AFM images of the Ag-ZnO/Ti composite coatings
表3 为复合涂层表面轮廓算数平均偏差。由表3 可知,Ag-ZnO/Ti 复合涂层的表面粗糙度随着涂层中Ag 含量的增加而不断升高。当Ag 质量分数为3.63%时,样品组表面粗糙度为6.71 nm,达到了最大。据Bollen 等[15]的研究结果显示,当表面粗糙度小于0.2 μm 时,此表面对附着在其上的细菌总量影响不大。尽管4 组样品的表面粗糙度不断增大,但由于均远远小于0.2 μm,因此并不会导致更多的细菌在其表面粘附。
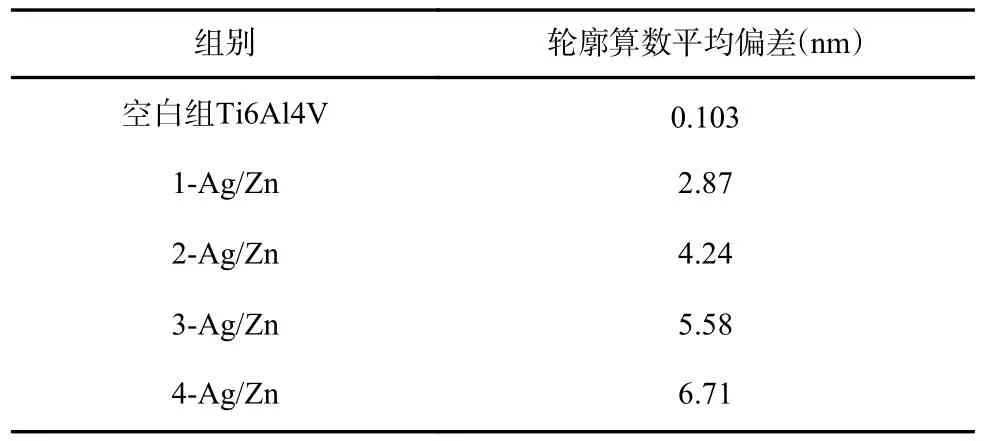
表3 Ag-ZnO/Ti 复合涂层表面轮廓算数平均偏差Tab.3 Arithmetic mean deviation of the Ag-ZnO/Ti composite coatings
2.2 润湿性能
表面润湿性是与生物材料相关的一项重要性能,材料与水的接触角与细菌的粘附之间存在直接关系[16],据报道,细菌更倾向于在亲水性表面粘附[17]。图5 为样品表面与液相的接触角,随着Ag 质量分数的增加,Ti6Al4V 表面由亲水表面转变为疏水表面,其中,4-Ag/Zn 组疏水性最佳,有利于抑制细菌的粘附。根据Wenzel's 方程,当材料表面的接触角大于90o时,增加材料表面粗糙度会使其接触角也随之增大[18]。本研究各组样品接触角变化与其表面粗糙度的变化相符合。
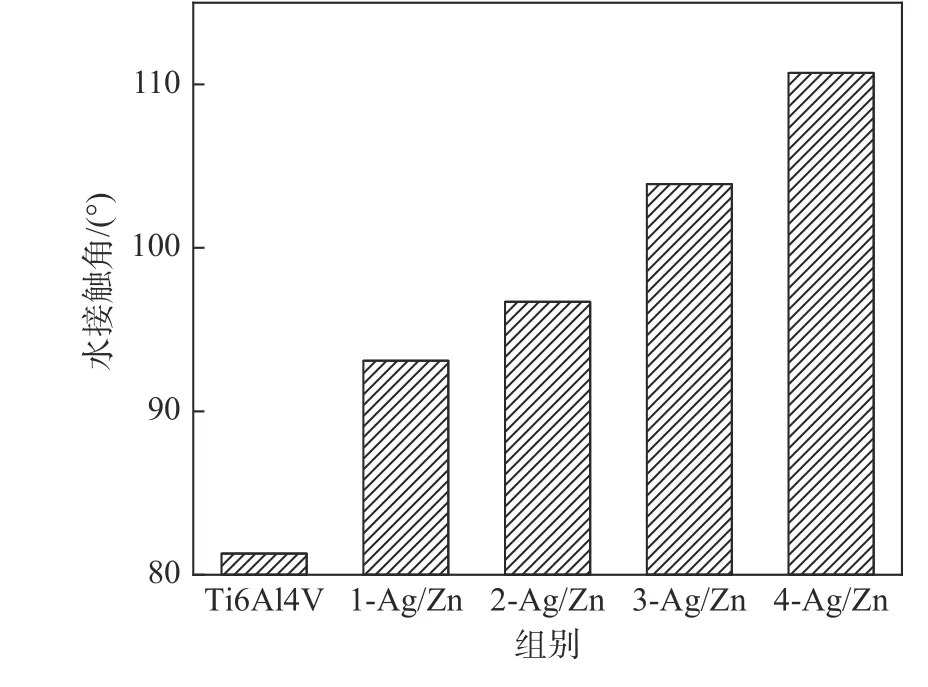
图5 Ag-ZnO/Ti 复合涂层表面与水的接触角Fig.5 Water contact angles on the surface of Ag-ZnO/Ti composite coatings
2.3 Ag+和Zn2+释放速率
图6 为各组样品在PBS 中浸泡72 h 释放出的Ag+和Zn2+的浓度,涂层中的Ag 和Zn 在富含水分的环境中能以金属离子的形式连续释放到周围的介质中。由图6(a)可知,Ag+在36 h 内快速释放,36 h 后,Ag+的释放速率减缓,直到72 h 时仍保持在相对较高的水平未出现明显下降,基本符合理想的离子释放曲线。Kim 等[19]研究发现当Ag+的浓度超过300 mg/L 时才能引起轻度肝损伤。相比于Ag+,图6(b)中Zn2+释放速率增长较为稳定,直到48 h 时达到了最高,但整体Zn2+的浓度大大低于Ag+的浓度,因此,各组样品在72 h 内的离子释放浓度均为安全浓度。
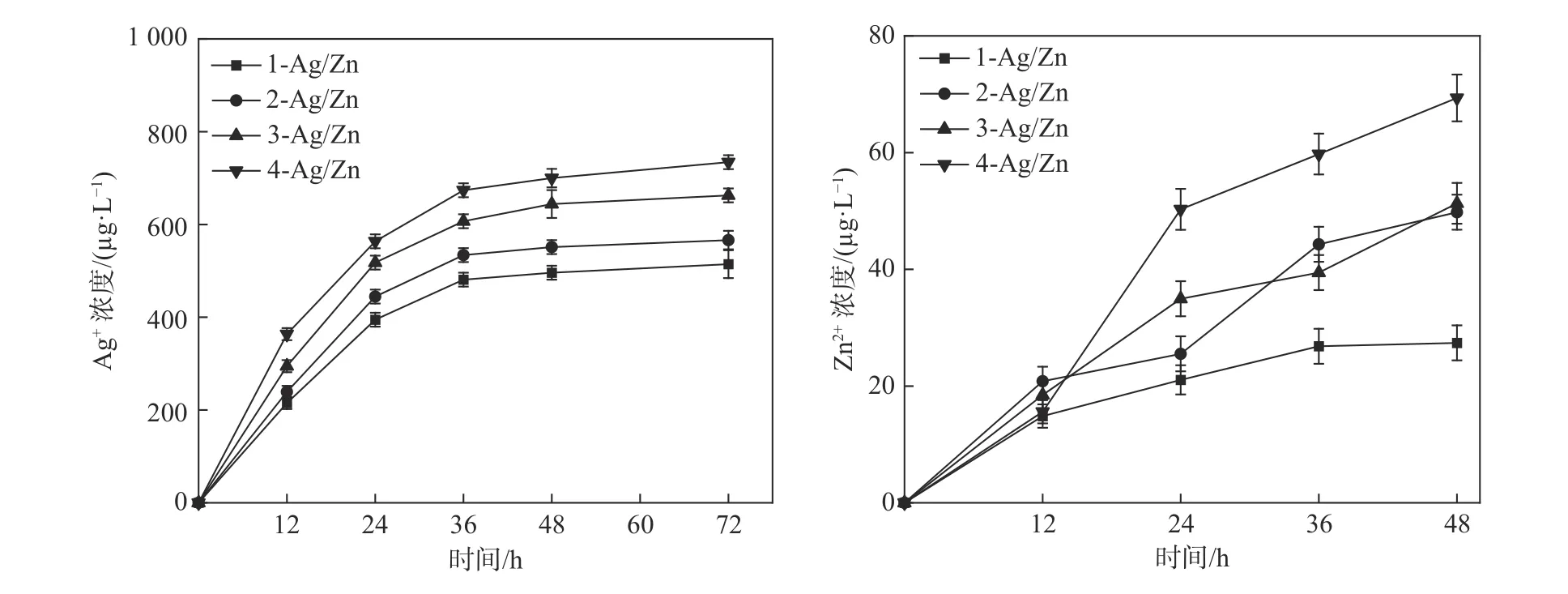
图6 Ag-ZnO/Ti 复合涂层浸泡不同时间释放出的金属离子浓度Fig.6 The concentrations of metal ions released by the Ag-ZnO/Ti composite coating samples soaked in different time
2.4 细胞毒性
图7 为背景多孔板、空白组Ti6Al4V 以及各组涂层分别在24、72、120 h 时测得的吸光度,对应的RGR已在表4 中给出。含Ag 涂层组之间无显著性差异(P>0.05),4 组样品与空白组Ti6Al4V 的吸光度差异无统计学意义(P>0.05)。

表4 Ag-ZnO/Ti 复合涂层与rBMSCs 细胞共培养不同时间的RGRTab.4 The RGR of rBMSCs cocultured with Ag-ZnO/Ti composite coating in different time
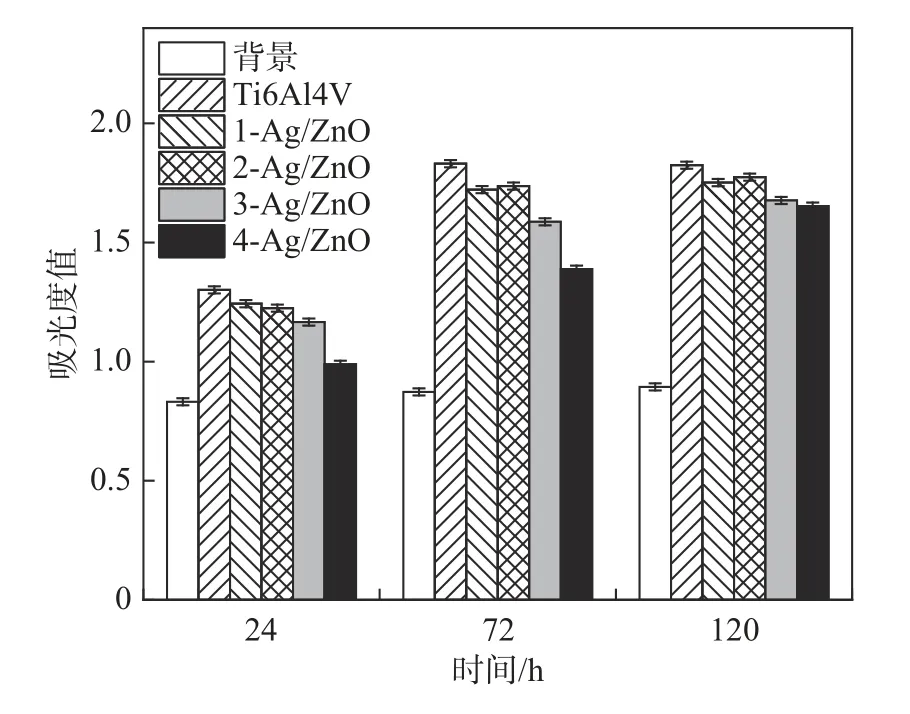
图7 Ag-ZnO/Ti 复合涂层与rBMSCs 细胞共培养不同时间吸光度的比较Fig.7 Comparison of absorbances of Ag-ZnO/Ti composite coating and rBMSCs co-cultured in different time
生物相容性是与生物材料相关的最重要的性能之一。表5 中1-Ag/Zn 组和2-Ag/Zn 组的RGR均在75%以上,对应的细胞毒性仅为Ⅰ级,符合安全的毒性标准,可用于动物试验等进一步研究。3-Ag/Zn 组在72 h 内的RGR表明其对人体可能存在安全风险,其毒性等级为Ⅱ级,而在120 h 后达到了Ⅰ级的安全标准。4-Ag/Zn 组的吸光度在24、72、120 h 的时间点均为最低,其中在24 h 的RGR仅为33.51%,毒性等级达到了Ⅲ级,表明该涂层对生物细胞存在着极高的安全风险,不符合人体安全标准。因此,以该组涂层中Ag 质量分数1.85%的作为本研究的临界安全含量,即2-Ag/Zn 组涂层。

表5 Ag-ZnO/Ti 复合涂层平板菌落计数结果Tab.5 Sample plate colony count results of Ag-ZnO/Ti composite coatings
2.5 抗菌性能
各组样品平板涂布抑菌结果如图8 所示。涂覆Ag-ZnO/Ti 复合涂层后,试验组对金黄色葡萄球菌表现出显著的抗菌效果,能够杀灭绝大部分的细菌,平均抑菌率在90%以上。其中,虽然1-Ag/Zn 试验组的Ag 质量分数仅为0.77%,但仍达到了97.7%以上的抑菌率。如图9 所示,根据国家标准《HG/T 3 950-2007》中关于抗菌涂料的规定可达到Ⅱ级抗菌性,而4-Ag/Zn 试验组的平板表面已几乎看不到细菌菌落。整体4 组试验组表现出随涂层中Ag 含量增加而明显提高的抗菌性能,其中2-Ag/Zn 组、3-Ag/Zn 组和4-Ag/Zn 组的抑菌率分别约为99.03%、99.62%、99.98%,都具有Ⅰ级的抗菌性能。

图9 Ag-ZnO/Ti 复合涂层对金黄色葡萄球菌的抗菌率Fig.9 Antibacterial ratios of Ag-ZnO/Ti composite coatings against Staphylococcus aureus
据报道[20],当细菌在植入体表面形成生物膜后其耐药性会大幅增加。生物膜会充当细菌的保护层阻挡来自宿主免疫系统和抗菌剂的杀伤作用[21],而携带纳米粒子抗菌剂的涂层可以穿透细菌生物膜[22],为植入部位提供较高初始浓度的抗菌剂,并在伤口愈合前持续释放[23]。纳米Ag 和纳米ZnO 的抗菌机制可以归纳为以下几点:
(1)降低细菌细胞膜电位差使其功能受损:细菌的细胞膜一般处于负电位,很容易通过静电作用吸附Ag+和Zn2+等金属离子导致自身细胞膜电位失衡,使膜去极化并改变其通透性。当电位差降低过多时可导致细胞膜破裂,使细菌死亡[24]。
(2)与细菌细胞内的生物分子结合使其结构受损:Ag+和Zn2+能够与细菌细胞内的蛋白质和DNA结合,使其结构异常进而导致功能受损,最终使细菌细胞无法行使正常的生理功能而死亡[25]。
(3)介导活性氧(reactive oxygen species,ROS)的产生会诱导氧化应激:Ag+和Zn2+通过产生ROS 间接发挥抗菌作用[26],ROS 不仅能导致细菌的细胞膜脂质过氧化,还能攻击细菌细胞内的生物分子,导致蛋白质羰基化、DNA 断裂等严重后果,诱导细菌的急性死亡。
3 结论
本试验探究了Ag 含量的变化对Ag-ZnO/Ti 复合涂层微观形貌和抗菌性能的影响,具体结论如下:
(1)采用射频磁控溅射技术制备的Ag-ZnO/Ti 复合涂层表面质量良好,通过提高拼接靶材中Ag 的体积比,涂层表面纳米颗粒数量显著增加,表面粗糙度增大,当Ag 质量分数达到1.85%时,其表面粗糙度也达到了最大,Ra为4.24 nm。同时,其疏水性得到增强,与水的接触角最大达到了96.7o,有助于减少细菌的粘附。
(2)Ag-ZnO/Ti 复合涂层释放出的Ag+浓度在36 h 时已接近最大值,直到72 h 仍保持小幅增长。Zn2+的浓度在48 h 时达到最大,且仍有上升趋势。
(3)Ag-ZnO/Ti 复合涂层可以显著改善Ti6Al4V材料的抗菌性能。样品的抗菌率与靶材中Ag 的含量成正比,然而基于生物相容性的考虑,当靶材体积比为Ag∶ZnO∶Ti=2∶2∶96 时,RGR在75%以上,毒性等级为I 级,符合生物材料的安全标准,同时,样品抗菌率高达99.62%,具有I 级抗菌性。

