抑制钙结合蛋白S100A4表达缓解小鼠脓毒血症相关肺损伤的研究*
陈科,莫诗卉,张丁山,何菁菁,晏世荣,吴通前,余芳
(贵州医科大学附属医院 1.临床检验中心,2.临床研究中心,贵州 贵阳 550004)
脓毒血症是临床常见的感染性疾病,由病原微生物或其毒素入血所致。2020年国内40 家重症监护治疗病房(intensive care unit,ICU)数据显示,其发病率为20.6%,而病死率为35.5%,严重者可达50%[1]。脓毒血症机制复杂,感染早期即可出现免疫功能失衡,导致细胞因子风暴,进而引起多器官衰竭[2],脓毒血症患者最常见肺损伤,且与患者预后密切相关[3],因此,深入了解脓毒血症相关肺损伤可能为疾病诊疗和患者管理提供新的见解。
S100A4 属于钙结合蛋白S100 家族,是一种多功能的分泌型蛋白,可参与多种生物调节活动,并且促进炎症进展,在肿瘤、纤维化、过敏等多个疾病过程中均有不同的病理作用[4]。氯硝柳胺(Niclosamide)被认为是S100A4 转录抑制剂,通过抑制S100A4 可能缓解肌萎缩侧索硬化、肾纤维化和结肠癌转移[5-7]。已有研究发现,肺S100A4 在小鼠肺纤维化模型中表达升高,而Niclosamide 可降低其表达,并缓解肺纤维化进展[8]。在哮喘模型小鼠中,肺S100A4 表达明显增加,经S100A4 抗体预处理可显著降低肺部炎症[9]。然而Niclosamide 是否通过抑制肺S100A4 表达从而缓解脓毒血症相关肺损伤,及其潜在机制尚不清楚。因此,本研究拟通过复制脓毒血症模型小鼠,研究肺S100A4 与脓毒血症相关肺损伤的潜在关联,并探索Niclosamide 对脓毒血症相关肺损伤的潜在调控机制,旨在进一步了解脓毒血症相关肺损伤机制,为临床诊疗和患者管理提供潜在选择。
1 材料与方法
1.1 实验动物与模型复制
实验用小鼠购自北京维通利华实验动物技术有限公司。将12 只4~8 周雄性C57BL/6 小鼠随机分为对照组(Con 组)、脓毒血症组(LPS 组)、Niclosamide对照组(Nic 组)及Niclosamide 预处理组(LPS+Nic组),每组3 只。所有小鼠均喂养于SPF 级动物房中,自由饮食。适应性喂养1周后,复制小鼠脓毒血症模型。所有动物实验均经过贵州医科大学伦理学审批。实验动物生产许可证号:SCXK(京)2021-0011,实验动物使用许可证号:SYXK(黔)2018-0001。模型复制:Con 组小鼠腹腔注射无菌生理盐水(200 μL/20 g 体重),LPS 组小鼠腹腔注射LPS(20 mg/20 g 体重),Nic 组腹腔注射Niclosamide(20 mg/20 g 体重),LPS+Nic 组小鼠在给予LPS 刺激前1 h 腹腔注射Niclosamide。12 h 后麻醉处死小鼠。固定小鼠,剪开颈部皮肤使气管暴露,使用一次性注射器吸取600 μL 生理盐水,从气管插入反复冲洗,收取支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)置于-80 ℃冰箱冷冻保存备用。打开胸腔,收取左肺速冻,右肺浸泡于4%多聚甲醛,脱水、石蜡包埋后切片用于苏木精-伊红(hematoxylin and eosin staining,HE)染色及免疫组织化学染色。
1.2 BCA蛋白定量检测小鼠BALF总蛋白含量
预先配好BCA反应液,取50 μL BALF加入100 μL BCA 反应液,37 ℃避光孵育30 min,于562 nm 波长处读取光密度(optical density,OD)值,根据标准曲线计算各组小鼠BALF 总蛋白含量。
1.3 酶联免疫吸附试验检测小鼠肺匀浆上清液S100A4蛋白含量
采用双抗体夹心酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测肺匀浆上清液S100A4。将鼠S100A4 抗体(1∶500,武汉Proteintech 公司)在ELISA 包被液(NaHCO3-Na2CO3缓冲液,pH=9.6)中稀释,以每孔50 μL 的体积加入96 孔板中,4 ℃包被过夜,包被完成后含吐温-20 的磷酸盐缓冲液(PBST)洗涤3 遍,加入300 μL 5%牛血清白蛋白4 ℃封闭过夜,PBST 洗涤3 遍,加入稀释的肺匀浆上清液50 μL,4 ℃孵育过夜,PBST 洗涤3 遍后再加入磷酸盐缓冲液(PBS)稀释的兔S100A4 抗体(1∶1 000,英国Abcam公司),4 ℃孵育过夜,PBST洗涤3遍后加入5%牛血清白蛋白稀释的辣根过氧化物酶偶联羊抗兔IgG二抗(1∶1 000,英国Abcam公司),37 ℃孵育1 h。洗涤后加入四甲基联苯胺显色液(北京索莱宝科技有限公司),37 ℃显色30 min,加入100 μL 终止液(北京索莱宝科技有限公司)立即使用Multiscan sky酶标仪(美国Thermo Fisher公司)于波长450 nm处读取OD值。
1.4 HE染色
将石蜡切片置于二甲苯中脱蜡2 次,5 min/次,再经梯度乙醇(100%、90%、70%和50%)水化,每个梯度3 min,蒸馏水浸泡2 min。滴加适量苏木素染色1 min,流水冲洗;滴加分化液30 s,流水冲洗;滴加伊红染色1 min,流水冲洗;滴加反蓝液10 s,流水冲洗,烘干后滴加中性树脂封片。显微镜下观察并采集图像。
1.5 免疫组织化学染色
按照上述操作水化切片后,置于抗原修复液中微波加热10 min,洗去修复液,滴加适量5%山羊血清,室温封闭1 h,甩去血清后,滴加适量兔源一抗,4 ℃孵育过夜,PBS 洗涤3 次,5 min/次,滴加适量羊抗兔二抗,37 ℃孵育1 h,PBS洗涤3次,5 min/次,滴加适量二氨基联苯胺底物液,反应2 min 后,洗去底物。烘干后滴加中性树脂封片于显微镜下观察并采集图像。
1.6 Western blotting 检测Occlduin、STAT3、MAPK3蛋白相对表达量
取20 mg 小鼠肺组织,加入200 μL RIPA 裂解液,冰上超声裂解至无明显组织块,冰上静置30 min后以12 000 r/m 离心10 min,取上清液加入苯甲基磺酰氟后置于-80 ℃冰箱冷冻保存备用。取适量蛋白液与PBS、蛋白上样缓冲液混合,100 ℃变性10 min,用于后续电泳。根据试剂盒配置聚丙烯酰胺凝胶,进行SDS-PAGE 凝胶电泳。电泳条件为:浓缩胶80 V,分离胶130 V;转膜条件为0.45 μm PVDF膜,湿转280 mA,70 min。随后经5% 脱脂奶封闭1 h,一抗4 ℃孵育过夜,二抗37℃孵育1 h 及ECL显影。以β-actin 和GAPDH 作为内参蛋白检测Occlduin、STAT3、MAPK3 蛋白相对表达量。
1.7 统计学方法
数据分析采用GraphPad 8.0.2 统计软件。Western blotting 检测和免疫组织化学染色图像采用Image J 和IHC Tool box 进行半定量测量。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠BALF 总蛋白含量和肺组织匀浆上清液S100A4水平比较
BCA 检测结果显示,各组小鼠BALF 总蛋白含量比较,经方差分析,差异有统计学意义(P<0.05)。与Con 组比较,LPS 组BALF 中总蛋白含量升高(P<0.05);与LPS 组比较,LPS + Nic 组BALF 中总蛋白含量降低(P<0.05)。ELISA 检测结果显示,各组肺组织匀浆上清液S100A4 的OD 值比较,经方差分析,差异有统计学意义(P<0.05)。Con 组与LPS 组肺组织匀浆上清液S100A4 的OD 值比较,差异无统计学意义(P>0.05);与LPS 组比较,LPS + Nic 组肺组织匀浆上清液S100A4 的OD 值下降(P<0.05)。见表1。
表1 各组小鼠BALF总蛋白含量、肺组织匀浆上清液S100A4水平比较 (n=3,±s)
表1 各组小鼠BALF总蛋白含量、肺组织匀浆上清液S100A4水平比较 (n=3,±s)
注:①与Con组比较,P<0.05;②与LPS组比较,P<0.05。
组别Con组LPS组Nic组LPS + Nic组F 值P 值ODS100A40 0.90±0.18 1.35±0.70 0.97±0.34 0.81±0.13②3.075 0.042 BALF 总蛋白/(mg/mL)0.53±0.19 0.81±0.41①0.42±0.06 0.49±0.11②4.776 0.007
2.2 Niclosamide缓解脓毒血症肺损伤
HE 染色结果显示,Con 组和Nic 组未观察到炎症细胞浸润,肺泡结构清晰,无间质水肿;LPS 组肺支气管周围大量炎症细胞浸润,肺泡结构模糊;LPS +Nic 组支气管周围炎症细胞浸润减少,肺泡结构较LPS 组清晰。见图1。

图1 各组小鼠肺组织病理改变 (HE染色)
2.3 小鼠肺支气管上皮细胞S100A4表达
免疫组织化学染色结果发现,肺S100A4 主要表达于支气管上皮细胞而非肺泡上皮细胞。且各组肺支气管上皮细胞S100A4 表达比较,经方差分析,差异有统计学意义(P<0.05)。与Con 组比较,LPS 组肺支气管上皮细胞S100A4 表达升高(P<0.05);与LPS 组相比,LPS + Nic 组肺支气管上皮细胞S100A4 表达下降(P<0.05)。 见表2和图2。
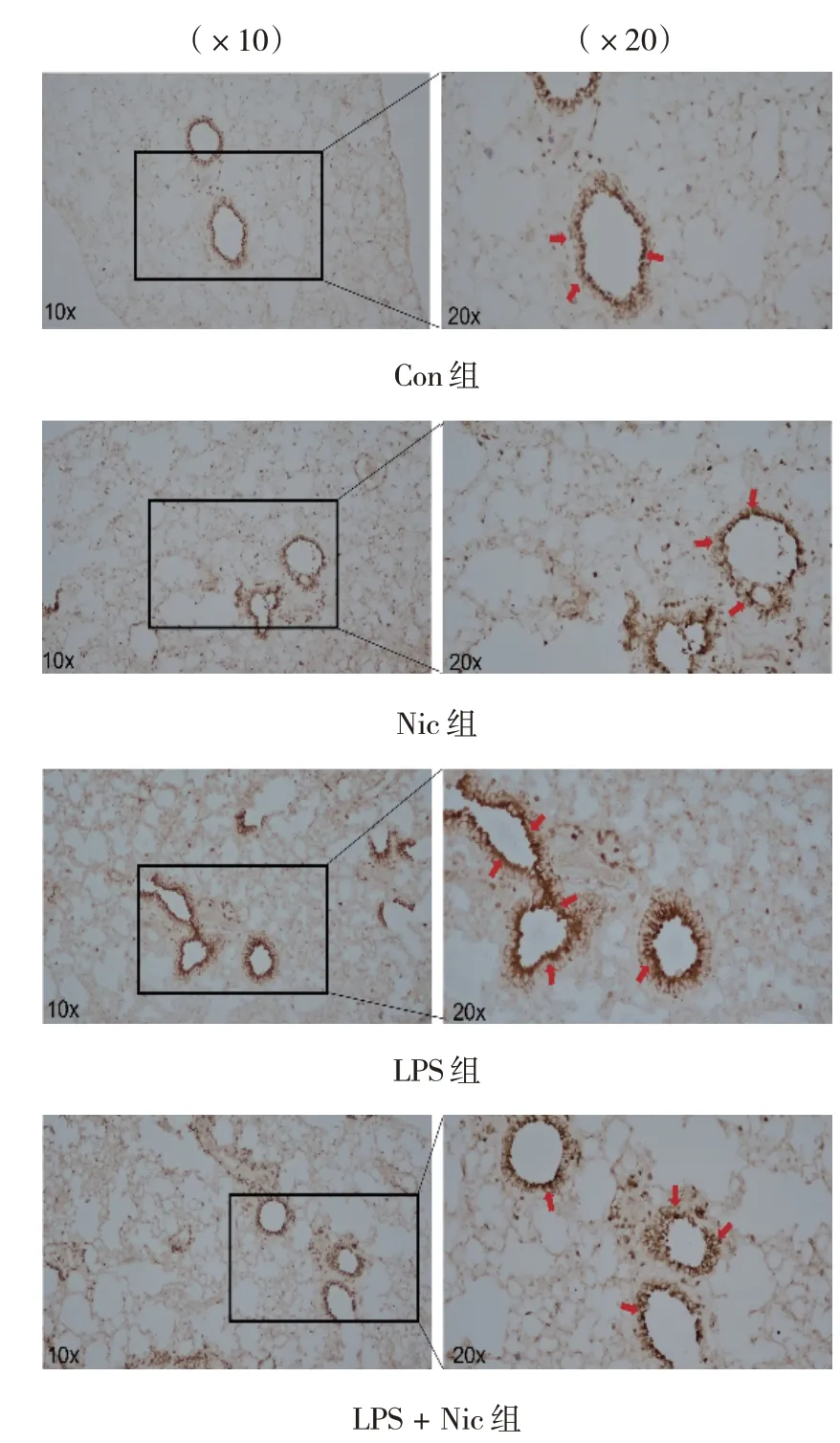
图2 各组小鼠肺组织S100A4表达 (免疫组织化学染色)
表2 各组小鼠肺组织S100A4表达比较(n=3,±s)
表2 各组小鼠肺组织S100A4表达比较(n=3,±s)
注:①与Con组比较,P<0.05;②与LPS组比较,P<0.05。
组别Con组LPS组Nic组LPS + Nic组F 值P 值ODS100A4 1.52×108±1.05×107 3.21×108±1.57×107①1.34×107±8.16×106 1.98×108±7.50×106②98.870 0.000
表3 各组小鼠肺组织Occlduin表达比较(n=3,±s)
表3 各组小鼠肺组织Occlduin表达比较(n=3,±s)
注:①与Con组比较,P<0.05;②与LPS组比较P<0.05。
组别Con组LPS组Nic组LPS + Nic组F 值P 值ODOccludin 值0.20±0.02 0.17±0.01①0.24±0.03 0.21±0.02②21.93 0.000
2.4 不同处理后小鼠肺组织Occludin表达
免疫组织化学染色结果显示,各组Occludin的OD 值比较,经方差分析,差异有统计学意义(P<0.05)。与Con 组比较,LPS 组支气管上皮细胞紧密连接蛋白Occludin 的OD 值降低(P<0.05);与LPS 组相比,LPS + Nic 组紧密连接蛋白Occludin 的 OD 值升高(P<0.05)。 见表 3和图3。
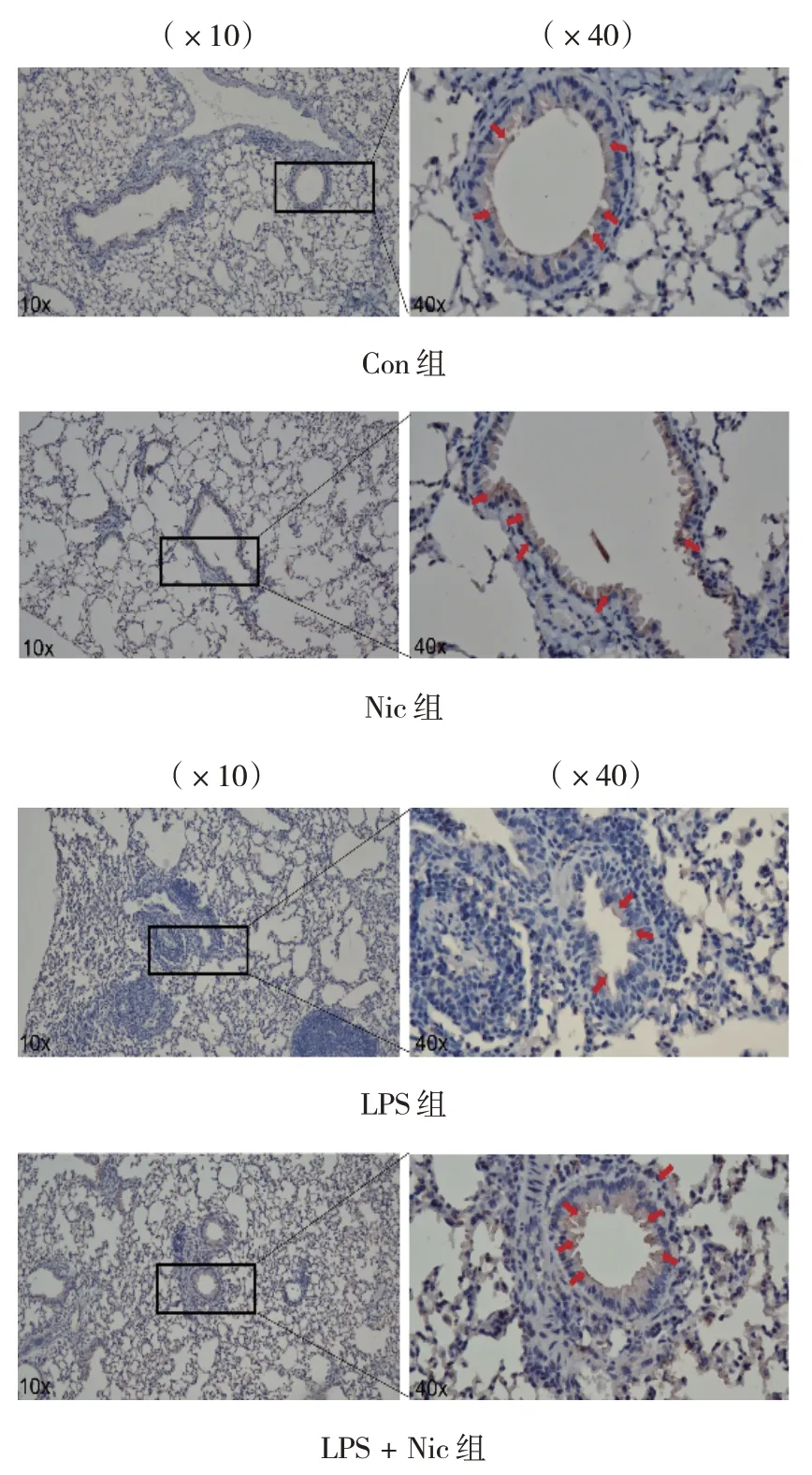
图3 各组小鼠肺组织Occludin表达 (免疫组织化学染色)
2.5 Niclosamide可能下调STAT3和MAPK3缓解肺部炎症
Western blotting 检测结果显示,各组Occludin、STAT3、MAKP3蛋白相对表达量比较,经方差分析,差异均有统计学意义(P<0.05)。与Con 组比较,LPS 组Occludin 蛋白相对表达量降低(P<0.05),STAT3 和MAKP3蛋白相对表达量升高(P<0.05)。见表4和图4。
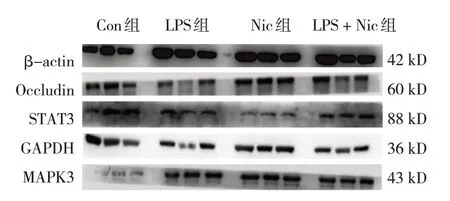
图4 各组小鼠肺组织Occludin蛋白表达
表4 各组小鼠肺组织Occlduin、STAT3、MAPK3蛋白相对表达量比较(n=3,±s)
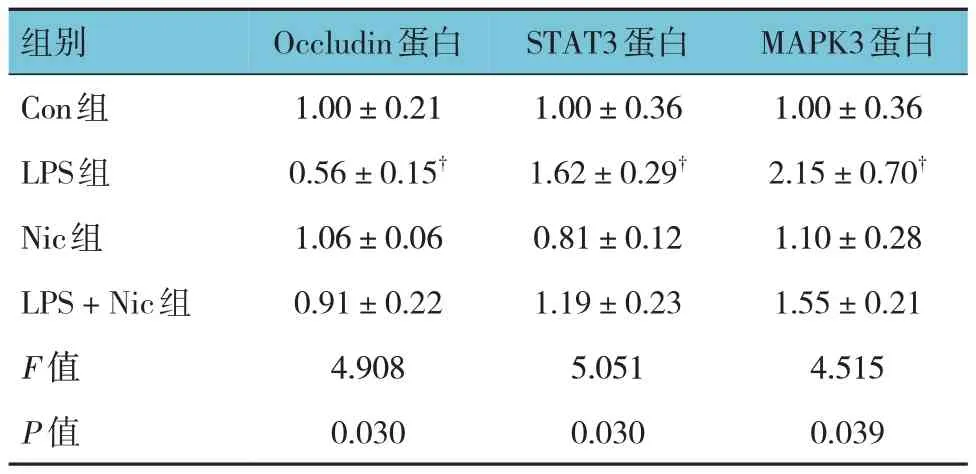
表4 各组小鼠肺组织Occlduin、STAT3、MAPK3蛋白相对表达量比较(n=3,±s)
注:†与Con组比较,P<0.05。
组别Con组LPS组Nic组LPS + Nic组F 值P 值MAPK3蛋白1.00±0.36 2.15±0.70†1.10±0.28 1.55±0.21 4.515 0.039 Occludin蛋白1.00±0.21 0.56±0.15†1.06±0.06 0.91±0.22 4.908 0.030 STAT3蛋白1.00±0.36 1.62±0.29†0.81±0.12 1.19±0.23 5.051 0.030
3 讨论
脓毒血症是目前ICU 最常见的死亡原因[1],且脓毒血症的早期诊断和患者管理仍是ICU 面临的巨大挑战[10]。脓毒血症发病急且机制复杂,常伴随多器官损伤,在损伤器官中,肺是最先衰竭也是最常衰竭的器官,使得急性肺损伤成为脓毒症患者死亡的最关键预后因素之一[3],因此进一步了解脓毒血症相关肺损伤机制,可能为疾病诊断和患者管理提供新的方向和思路。
S100A4 属于钙结合蛋白S100 家族,已被证实参与肿瘤侵袭、血管生成和炎症调节等病理生理现象[4]。一些研究曾使用S100A4 或S100 家族蛋白作为炎症指标[8,11-12],初步说明S100A4 或S100 家族蛋白对炎症过程具有一定意义。已有研究发现,S100A4 在小鼠脓毒血症模型的多种器官中表达升高[11,13-14],但缺乏具体的调节机制。本研究结果表明,抑制S100A4 表达可一定程度上缓解肺部炎症,提示S100A4 在脓毒血症肺损伤的潜在的调节作用。另外,研究观察到炎症细胞主要浸润于支气管周围,Niclosamide 预处理后炎症细胞浸润减少,笔者推测支气管上皮细胞S100A4 表达可能存在变化。为进一步研究S100A4 在肺部炎症中的表达模式,通过免疫组织化学染色发现肺支气管上皮细胞高表达S100A4,而肺泡上皮细胞S100A4 表达稍低。这可能解释ELISA 结果显示S100A4 水平轻微升高,而免疫组织化学染色半定量结果显示肺支气管S100A4 明显升高。此外,已有实验已经表明,S100A4 参与上皮细胞向间充质细胞转移[15-16],提示S100A4 可能通过调节肺支气管上皮细胞功能影响炎症进展。
肺支气管上皮细胞功能对肺组织炎症有重要意义。肺支气管上皮细胞通过分泌黏液阻止异物入侵,分泌蛋白酶、趋化因子、细胞因子等物质调节炎症过程,且依赖多种紧密连接蛋白(如ZO-1、Occludin、Claudin 等)维持支气管屏障完整性,以防止组织受异物侵入和维持组织微环境[17]。紧密连接蛋白丢失可能导致炎症细胞浸润和蛋白渗出。已有大量研究表明,Occludin 在肺组织炎症中表达降低,恢复其表达水平可一定程度上缓解组织炎症[18]。本研究结果显示,炎症细胞主要浸润在支气管周围,且支气管上皮细胞高表达S100A4,Niclosamide可一定程度上抑制支气管上皮细胞S100A4 表达和缓解肺部炎症。由此笔者推测,支气管上皮细胞S100A4 可能参与肺支气管上皮细胞损伤。通过免疫组织化学染色和Western blotting 检测发现Occludin 在LPS 诱导的急性肺损伤中表达显著降低,而Niclosamide 预处理可一定程度上恢复其表达。但2 种检测方法均显示单独给予Niclosamide 似乎轻微上调Occludin 表达,提示Niclosamide 可能促进Occludin 表达阻止炎症细胞浸润。但目前尚无文献报道Niclosamide 对Occludin 的调控作用,是否经S100A4 参与也仍待研究。
S100A4 抑制剂Niclosamide 可缓解脓毒血症相关肺损伤,减轻肺部炎症,但涉及的信号分子或通路未知。已有研究表明,Niclosamide 可通过多种信号途径调节炎症,如JAK/STAT3、PI3K/Akt、MAPK 或NF-κB 信号通路[19-22]。本研究发现LPS 诱导的急性肺损伤中STAT3 和MAPK3 表达显著上调,Niclosamide 预处理可一定程度降低STAT3 和MAPK3表达水平。提示Niclosamide 可能通过STAT3 和MAPK3 调节S100A4 表达,进而影响炎症发生。但Niclosamide 是否直接或经S100A4 调控Occludin 表达,仍需深入研究。
综上所述,本研究初步证明S100A4 抑制剂Niclosamide 可能通过STAT3 或MAPK3 信号下调S100A4 和恢复Occludin 表达,进而抑制脓毒血症相关肺损伤发生,但完整调控过程仍需深入研究。S100A4 在脓毒血症相关肺损伤中可能存在一定作用,或可为临床提供新的研究思路和方向。

