不同温度凝胶对大鼠寒区皮肤放射损伤修复的研究*
刘颖,王思潼,王秋
(北部战区总医院 1.急诊医学科,2.核医学科,辽宁 沈阳 110016)
皮肤是人体覆盖面积最大、具有重要屏障及保护作用的器官,也因此成为极易发生损伤的部位。机体全身或局部受到放射线外照射或放射性核素沾染时,皮肤首当其冲。皮肤受电离辐射照射引起的损伤统称皮肤放射损伤。因此,关于皮肤损伤的研究也越来越受到重视。虽然大部分皮肤损伤可自然愈合,但皮肤放射损伤依靠自身的力量较难愈合,成为威胁患者生命的主要因素[1-2]。目前针对皮肤放射性损伤的细胞生物学机制及救护策略研究已逐步深入。我国疆域广袤,寒区面积占陆地面积的43.5%,部分区域冬季室外温度在-20 ℃~-30 ℃的时间可长达2 个月以上。寒区生活着大量的居民和官兵,但低温环境下皮肤放射损伤的变化特点及救护策略尚不明确,需要进一步研究[3-4]。血管内皮生长因子(vascular endothelial growth factor,VEGF)能有效促进血管再生,α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)特异表达于血管平滑肌细胞,胶原蛋白Ⅰ(CollagenⅠ)和胶原蛋白Ⅲ(Collagen Ⅲ)是参与皮肤修复的重要蛋白,人血小板衍生生长因子D(platelet-derived growth factor D,PDGFD)和转化生长因子- β(transforming growth factor-β,TGF-β)参与细胞生长和分化调节。检测上述蛋白和生长因子水平能够有效验证皮肤放射性损伤干预后的促愈合效果[5-7]。因此,本研究拟复制寒区皮肤放射损伤大鼠模型,观察其损伤特点,并探讨不同温度水凝胶对寒区皮肤放射损伤的修复作用。
1 材料与方法
1.1 实验动物及材料
20 只健康雄性SD 大鼠购自沈阳艾科赛斯生物科技有限公司,实验动物生产许可证号:SCXK2019-0010,实验动物使用许可证号:SYXK20190002。甲壳素纳米纤维促修复凝胶由中国科学院金属研究所自制并提供。VEGF、α-SMA、Collagen Ⅰ、Collagen Ⅲ和GAPDH 抗体购自英国Abcam 公司。
1.2 研究方法
1.2.1 实验分组及模型复制20 只SD 大鼠随机分为4 ℃凝胶组和37 ℃凝胶组,每组10 只。所有大鼠于-20 ℃低温环境饲养1 周后,用2%戊巴比妥钠(1.5 mL/kg)腹腔麻醉大鼠,于背部两侧采用锶-90照射10 min 复制SD 大鼠寒区皮肤放射损伤模型。4 ℃凝胶组和37 ℃凝胶组大鼠右侧损伤采用相应温度凝胶覆盖干预,左侧不做任何处理作为模型对照(自身对照)。伤后第0、7、14、21、28、35 和42 天观察大鼠皮肤修复情况;于实验终点麻醉处死所有大鼠,收集皮肤组织样本进行后续检测。
1.2.2 锶-90照射后大鼠的一般情况观察记录大鼠的饮食摄水及体重变化;记录大鼠照射区皮肤变化并采用皮肤半定量评分评估皮肤状况:1.0 分为正常皮肤;1.5 分为轻度红斑、干燥;2.0 分为中度红斑、干燥;2.5 分为明显红斑、干燥脱屑;3.0 分为干燥脱屑、轻度干燥结痂;3.5 分为干燥脱屑、结痂,表皮少量结痂;4.0 分为斑片状湿润脱屑,中度结痂;4.5 分为融合性湿性脱屑、溃疡,大量深的结痂;5.0 分为开放性伤口、全层皮肤脱落。
1.2.3 组织病理学检测将大鼠皮肤组织样本室温下固定于10%甲醛缓冲液中,并通过徕卡微系统组织处理器(ASP 300S,德国徕卡公司)将其包埋在石蜡中。进行4 μm 厚的切片后,用苏木精和伊红染色,并在光学显微镜下观察组织形态。
1.2.4 Western blotting 检测在大鼠皮肤组织样本中加入裂解液,研磨成匀浆,12 000 r/min 离心20 min,取上清液,采用BCA 按说明书操作进行组织总蛋白测定后,将蛋白样品经SDS-聚丙烯酰胺凝胶电泳并转移至PVDF 膜上,室温封闭1 h,GAPDH 为内参,分别用VEGF、α-SMA、CollagenⅠ、CollagenⅢ和GAPDH 一抗4 ℃孵育过夜。TBST 漂洗3 次,加入相应二抗,室温孵育1 h。TBST 漂洗3 次,用ECL Western 印迹试剂盒进行化学发光检测VEGF、α-SMA、CollagenⅠ、CollagenⅢ蛋白的表达,Image J 图像分析软件对条带灰度值进行测量分析。
1.2.5 酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)严格按照说明书操作。将大鼠皮肤组织样本匀浆后,10 000 r/min 离心20 min,收集上清液,加样,37 ℃孵育30 min,洗涤后加入50 μL 酶标试剂,37 ℃孵育30 min,显色,终止,测定光密度值并分别计算PDGFD 和TGF-β 水平。
1.3 统计学方法
数据分析采用SPSS 22.0 统计学软件。计量资料用均数±标准差(±s)表示,两组比较采用独立样本t检验,多组比较采用单因素方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠一般情况比较
4 ℃凝胶组和37 ℃凝胶组大鼠照射后第14 天与第0 天的体重比较,差异有统计学意义(P<0.05);照射后第14 天大鼠体重较第0 天降低。4 ℃凝胶组和37 ℃凝胶组大鼠同一天的体重比较,差异无统计学意义(P>0.05)。见表1。
表1 大鼠照射后第0天与第14天体重比较(n=10,g,±s)
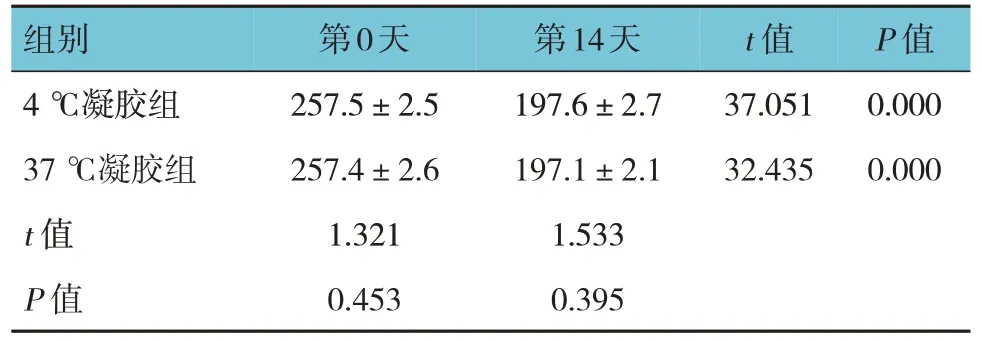
表1 大鼠照射后第0天与第14天体重比较(n=10,g,±s)
组别4 ℃凝胶组37 ℃凝胶组t 值P 值第0天257.5±2.5 257.4±2.6 1.321 0.453 t 值37.051 32.435 P 值0.000 0.000第14天197.6±2.7 197.1±2.1 1.533 0.395
自身对照、4 ℃凝胶组和37 ℃凝胶组大鼠照射第0 天、第7 天、第14 天的皮肤损伤评分比较,差异有统计学意义(P<0.05);照射后第7 天和第14 天皮肤损伤评分高于第0 天。自身对照、4 ℃凝胶组和37 ℃凝胶组大鼠照射第7 天和第14 天的皮肤损伤评分组间比较,差异有统计学意义(P<0.05)。见表2。第14 天出现皮肤损伤后,大鼠性情暴躁,精神亢奋,活动增多。
表2 大鼠照射后不同时间皮肤损伤评分(分,±s)

表2 大鼠照射后不同时间皮肤损伤评分(分,±s)
组别自身对照4 ℃凝胶组37 ℃凝胶组F 值P 值F 值861.312 781.122 809.326 P 值0.000 0.000 0.000第0天1.14±0.03 1.11±0.02 1.11±0.02 1.011 0.341第7天2.51±0.10 1.79±0.11 1.29±0.05 789.822 0.000第14天3.71±0.13 2.44±0.12 1.82±0.03 738.213 0.000
2.2 大鼠创面愈合情况
照射后,大鼠均出现不同程度的皮肤损伤。照射后第21 天,大鼠自身对照左侧出现显著性红斑、脱皮,皮肤轻微破损但无渗出液,皮肤损伤达最大伤口破损、局部脓肿,伴有渗出液;照射后第42 天,大鼠自身对照左侧创面有新生上皮长出,与正常皮肤相似。不同温度凝胶干预后,大鼠不同时间点的皮肤损伤程度均有所减轻,与自身对照比较,37 ℃凝胶组大鼠促创面愈合效果最显著。见图1。
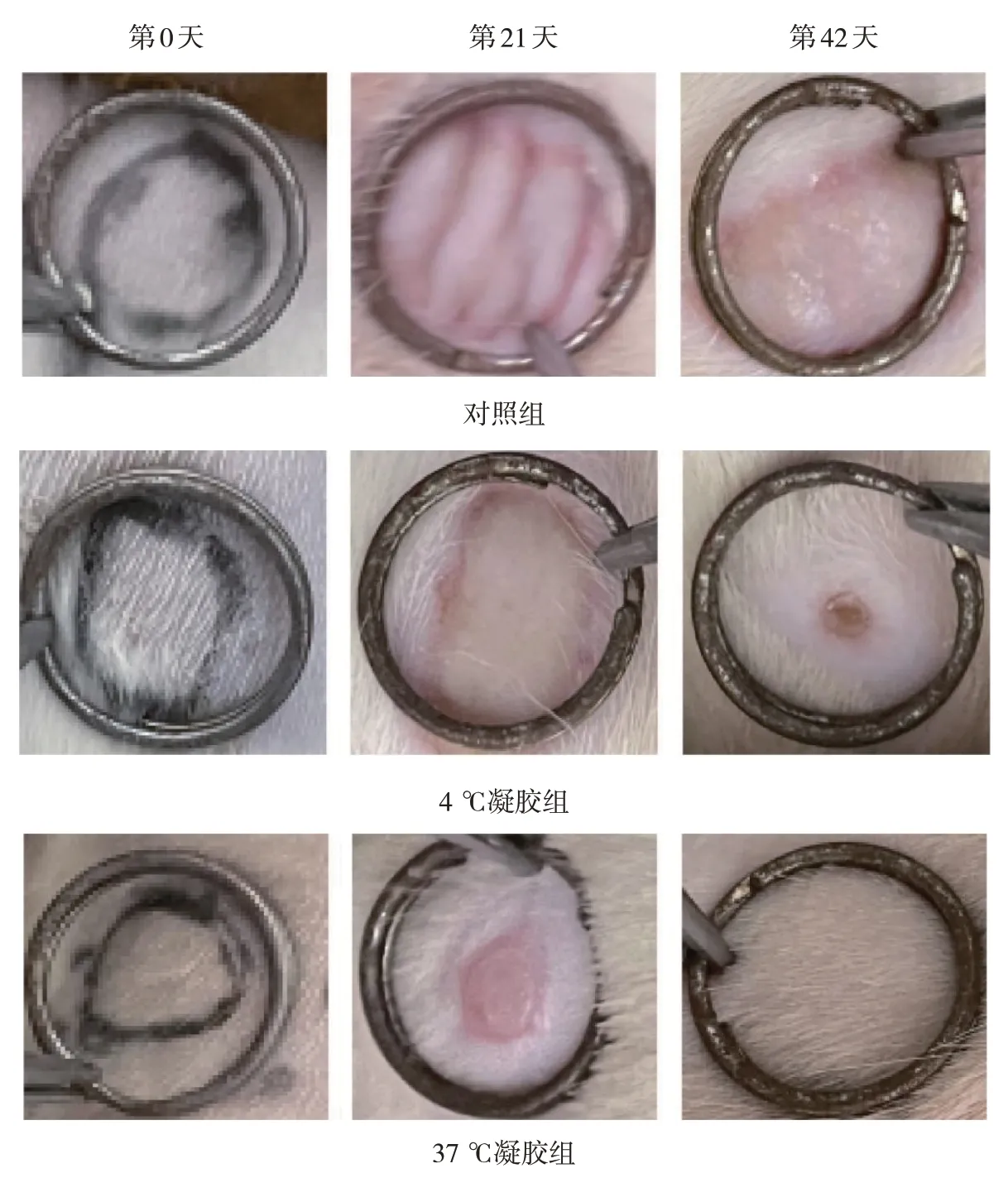
图1 大鼠创面愈合情况
2.3 37 ℃凝胶减轻大鼠皮肤放射损伤病理改变
HE 染色结果显示,照射后大鼠表皮明显增厚,鳞状上皮细胞数量增多,少见鳞状上皮细胞胞质空泡化;真皮层可见少量纤维细胞,并伴有淋巴细胞点状浸润,毛囊、皮脂腺等附属器官减少。与自身对照比较,凝胶干预后皮肤组织愈合加快,表皮层较薄,真皮层内可见大量的皮肤附属器如皮脂腺、毛囊、汗腺等,37 ℃凝胶组上皮恢复最明显。见图2。
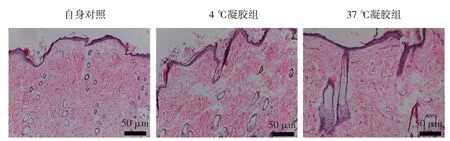
图2 大鼠皮肤放射损伤病理改变 (HE染色×200)
2.4 37 ℃凝胶促进大鼠皮肤放射损后血管和胶原生成相关蛋白表达
Western blotting 检测结果显示,自身对照、4 ℃凝胶组和37 ℃凝胶组大鼠皮肤组织的血管和胶原生成相关蛋白VEGF、α-SMA、CollagenⅠ和CollagenⅢ蛋白相对表达量比较,差异有统计学意义(P<0.05);凝胶干预后,37 ℃凝胶组大鼠皮肤组织中VEGF、α-SMA、CollagenⅠ和CollagenⅢ蛋白相对表达量显著升高。见图3 和表3。

图3 大鼠皮肤放射损伤后血管和胶原生成相关蛋白表达
表3 大鼠皮肤组织中血管和胶原生成蛋白相对表达量比较 (±s)
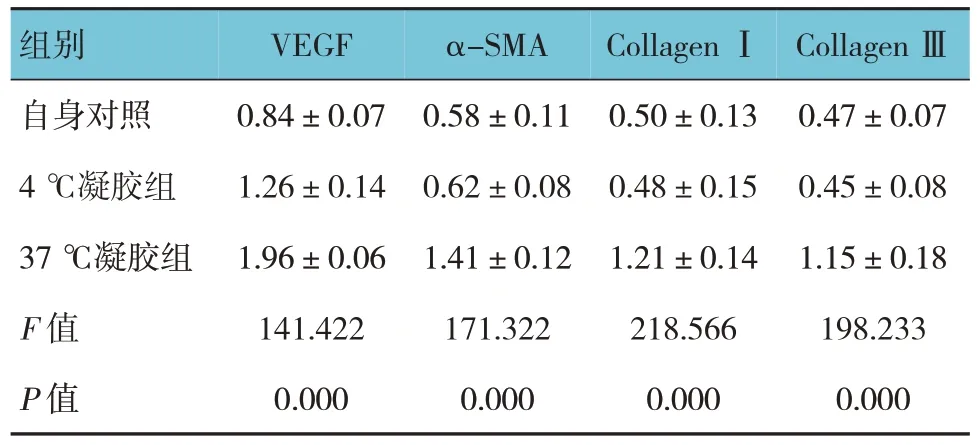
表3 大鼠皮肤组织中血管和胶原生成蛋白相对表达量比较 (±s)
组别自身对照4 ℃凝胶组37 ℃凝胶组F 值P 值VEGF 0.84±0.07 1.26±0.14 1.96±0.06 141.422 0.000 α-SMA 0.58±0.11 0.62±0.08 1.41±0.12 171.322 0.000 Collagen Ⅰ0.50±0.13 0.48±0.15 1.21±0.14 218.566 0.000 Collagen Ⅲ0.47±0.07 0.45±0.08 1.15±0.18 198.233 0.000
2.5 37 ℃凝胶促进大鼠皮肤放射损后生长因子分泌
ELISA 检测结果显示,自身对照、4 ℃凝胶组和37 ℃凝胶组大鼠皮肤组织的PDGFD、TGF-β 水平比较,差异有统计学意义(P<0.05);凝胶干预后PDGFD、TGF-β 水平升高,37 ℃凝胶组皮肤组织中PDGFD、TGF-β 显著升高。见表4。
表4 大鼠皮肤组织中生长因子水平比较 (±s)
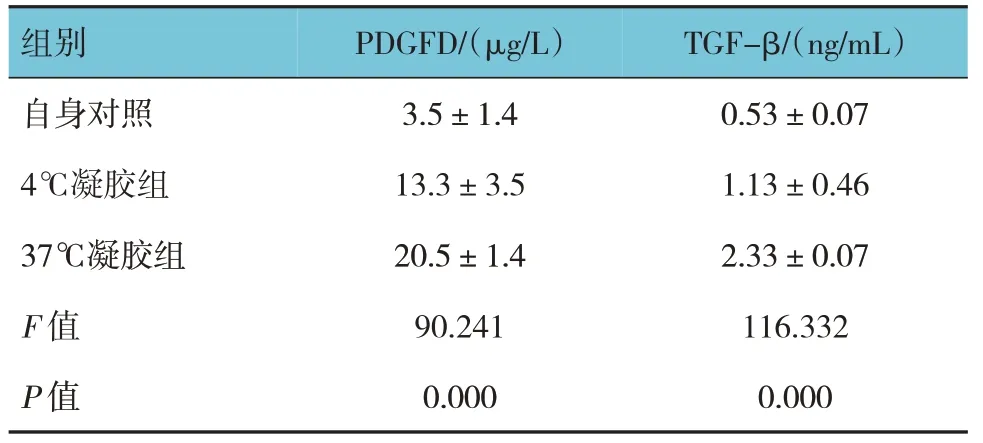
表4 大鼠皮肤组织中生长因子水平比较 (±s)
组别自身对照4℃凝胶组37℃凝胶组F 值P 值PDGFD/(μg/L)3.5±1.4 13.3±3.5 20.5±1.4 90.241 0.000 TGF-β/(ng/mL)0.53±0.07 1.13±0.46 2.33±0.07 116.332 0.000
3 讨论
寒冷环境的刺激会对人体多种组织器官产生影响,包括呼吸系统、血液循环系统和心血管系统等。和常温条件下相比,暴露在寒冷环境下的皮肤放射损伤危险性更高,但目前有关寒区皮肤放射损伤的特点和救治方法尚不清楚[8-9]。本研究采用SD大鼠复制寒区皮肤放射损伤动物模型,观察皮肤损伤特点,通过病理学和检测大鼠皮肤组织的血管和胶原生成相关蛋白VEGF、α-SMA、CollagenⅠ和Collagen Ⅲ表达,以及大鼠皮肤组织的PDGFD、TGF-β 水平,进一步明确了不同温度凝胶对寒区皮肤放射损伤修复的作用。
甲壳素纳米纤维促修复凝胶在创面愈合时间,皮肤附属结构修复方面展示出了理想的效果。分析原因可能是水凝胶能够提供湿性愈合环境,其特殊性对干燥坏死的伤口具有更大的应用前景。此外,水凝胶形态能够对伤口环境进行物理保护,防止细菌的渗透,还能起到舒缓和冷却的作用,从而减轻疼痛,加快血管和胶原生成,促进组织修复,加快伤口愈合[10-11]。对单纯的寒冷损伤首先考虑复温,基于此本研究验证了寒冷环境下皮肤放射性损伤后不同温度凝胶复温并促修复作用。37 ℃凝胶效果最显著。快速融化复温是冻伤急救的重要措施,也是冻伤治疗的关键,也可以直接影响各种治疗的效果,以及组织能否保留或保留多少的问题。冻伤冻结组织应立即用温水浸泡,以使冻区迅速解冻,缩短冻结期。本研究结果发现,37 ℃凝胶组大鼠干预后皮肤损伤愈合相关蛋白VEGF、α-SMA、CollagenⅠ、CollagenⅢ表达和生长因子PDGFD,TGF-β 水平较自身对照和4 ℃凝胶组升高;证明在凝胶的作用基础上37 ℃复温可能对寒区皮肤放射损伤救治发挥有益作用[12-14]。
综上所述,本研究明确低温环境下,锶-90 照射后造成大鼠皮肤损伤;37 ℃凝胶相比于4 ℃凝胶更有益于寒区皮肤放射损伤愈合。本研究结果有助于提高寒区皮肤放射损伤的认识,为寒区皮肤放射损伤寻找有效的修复策略提供理论基础。

