单克隆接种/成像设备VIPS在CHO工程细胞株单克隆筛选中的应用
谢涛,彭秀娥,孙青,张朝,陈文烨,张宽
石药集团巨石生物制药有限公司石药集团新型药物制剂与辅料国家重点实验室,河北 石家庄 050000
近年,重组蛋白类药物成为多种疾病的有效治疗手段[1-2]。工程细胞株开发是重组蛋白类药物开发的基础,对蛋白类药物的安全性和有效性具有较大影响。工程细胞株的单克隆源性指用于制备产品的细胞要求来源于同一祖细胞,是影响产品质量的关键因素,获取工程细胞株单克隆源性的证明是药物研发整体控制策略的关键步骤[3-4]。传统单克隆筛选采用有限稀释法,克隆形成率较低,为确保获得足够的候选克隆,每次实验均需接种30~50块96孔板,且进行连续2轮筛选,工作量极大[5-8]。采用单克隆筛选仪器ClonePix 并基于半固体培养基进行单克隆挑选可提高克隆形成率,但也需进行连续2 轮筛选或另加1 轮有限稀释法筛选亚克隆,才可提供充分的单克隆源性证明,耗时较长(6~8 个月)[9-11],无法满足目前新药研发进度。流式细胞分选、单细胞打印机等联用单克隆成像系统的单克隆筛选方法可有效缩短细胞株开发时间,提高单克隆筛选的合规性[12-16]。近期推出的单细胞光导系统Beacon 和英国Solentim 公司生产的单克隆接种/成像设备VIPS(Verified In-situ Plate Seeding)实现了单克隆接种、拍照一体化,可在短期内获得单克隆细胞株,并能提供有效的单克隆源性证明[17-20]。
VIPS 可在小于1 psi 的压力下进行单细胞接种,但由于不同细胞株对接种压力的耐受及生长培养基的适应性不同,导致克隆形成率存在较大差异,为获得足够的候选克隆,需针对细胞株进行单克隆生长培养基组合优化。在克隆筛选过程中,单克隆源性照片是项目合规性的关键证据,不同品牌96 孔板结构上的轻微差异可导致拍照时光学折射率不同,出现重影、模糊、拼接偏差等现象,尤其在板孔边缘尤为明显,需在确定96 孔板型号的前提下摸索最适培养基添加体积,达到最佳拍照效果。本研究以CHO来源的稳转细胞池为研究对象,对不同基础培养基和添加剂组合进行优化,并通过调整单细胞培养基体积,提高克隆形成率,确保单克隆成像清晰。以期建立应用VIPS 进行CHO 工程细胞株单克隆筛选的方法。
1 材料与方法
1.1 细胞 稳定转染不同目的基因的CHO 工程细胞池Cell pool 1、Cell pool 2、Cell pool 3、Cell pool 4均由石药集团巨石生物制药有限公司制备,均于液氮中保存。
1.2 主要试剂及仪器 CD CHO Medium购自美国Gibco公司;L-蛋氨酸亚砜酰亚胺(L-methionine sulfoximine,MSX)购自美国Sigma公司;MediumⅠ、MediumⅡ、Supplement a、Supplement b及Supplement c均为市售产品;单克隆接种/成像设备VIPS购自英国Solentim公司。
1.3 细胞培养 将Cell pool 1 于37 ℃水浴中快速解冻复苏,用含50 μmol/L MSX 的CD CHO Medium 重悬,200 ×g离心5 min;弃上清,再次重悬,按0.3 ×106个/mL 的密度接种至30 mL 含50 μmol/L MSX的CD CHO Medium中,移至125 mL摇瓶,于37 ℃,5%CO2环境下,120 r/min 摇床培养,每3~4 d 进行细胞传代,传代接种密度为(0.2~0.3)×106个/mL。细胞传代培养至少2~3 次,细胞活率≥95%时用于后续试验。
1.4 CHO 工程细胞株单克隆筛选方法的建立 将Cell pool 1 密度调节至(1.0~1.4)× 104个/mL,取2.5 mL 加至VIPS 的细胞池中,启动设备的单细胞接种程序,将单细胞接种至载有不同组合及体积(见表1)培养基的96 孔板中,随后VIPS 进行拍照,并按下式计算单克隆接种率;于接种后2h及7、10 和14 d 再次拍照,记录96 孔板中细胞图像,作为单克隆源性证明,并按下式计算克隆形成率及变异系数(CV),根据图像信息,生成细胞增殖曲线,由细胞增殖曲线斜率和峰值的差异获得单克隆增殖速率。


表1 单克隆生长培养基的组合及体积Tab.1 Combinations and volume of monoclonal growth medium
1.5 CHO工程细胞株单克隆筛选方法适用性的验证将Cell pool 2、Cell pool 3、Cell pool 4 按1.4 项方法传代,细胞密度均调节为(1.0~1.4)× 104个/mL,取2.5 mL,加至VIPS 细胞池,采用最佳单克隆生长培养基组合及体积进行单克隆接种和培养,统计单克隆接种率、克隆形成率、单克隆增殖速率,并评价单克隆图像效果。
2 结果
2.1 CHO工程细胞株单克隆筛选方法的建立
2.1.1 单克隆接种率 1~18 号Cell pool 1 的单克隆接种率均值为78%,标准差为5%,CV为6%,见表2。表明不同培养基的接种率稳定。
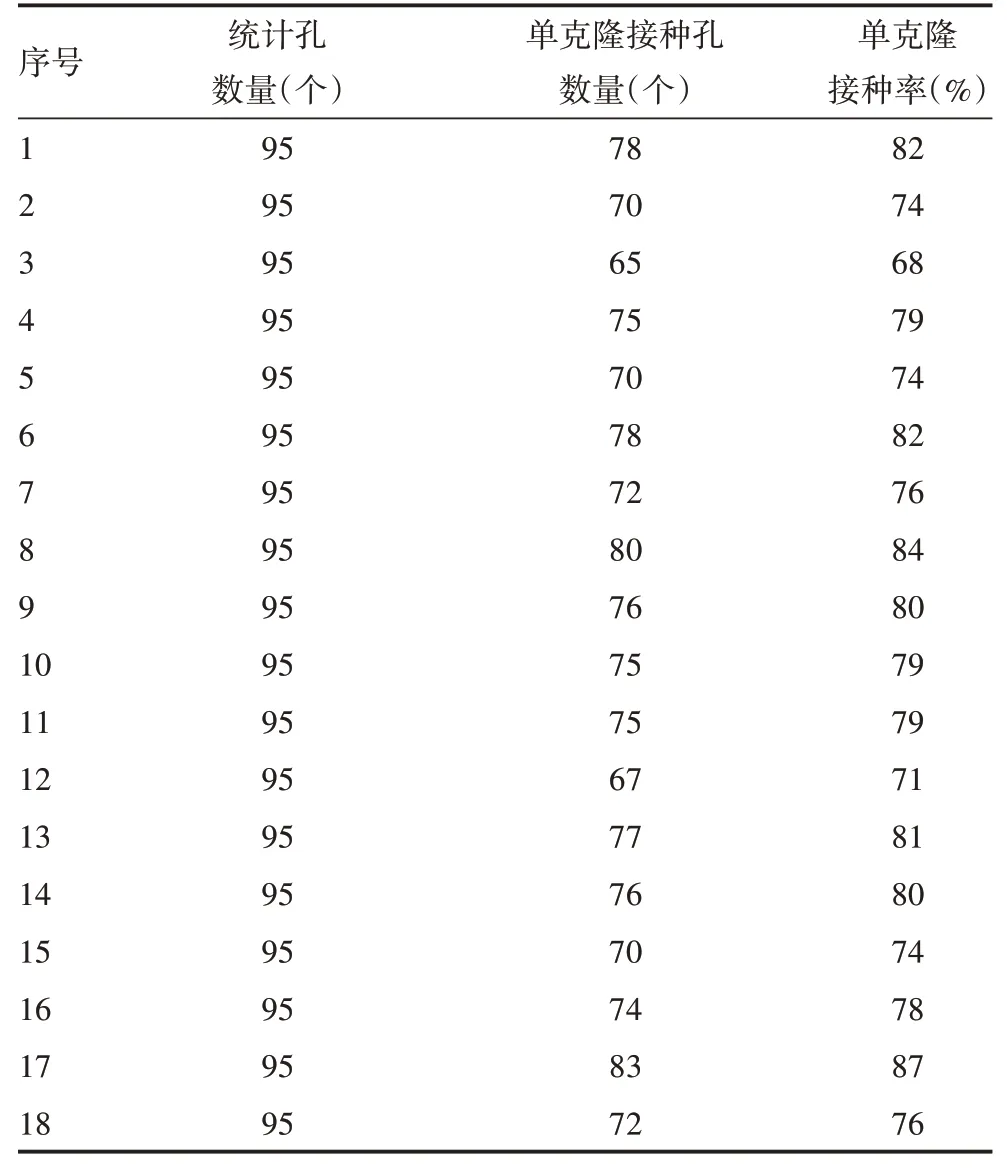
表2 Cell pool 1单克隆接种率统计表Tab.2 Statistics of monoclonal inoculation rate of Cell pool 1
2.1.2 克隆形成率 1~8、17和18号培养条件下Cell pool 1 未观察到克隆形成,9~16 号可观察到克隆形成,表明MediumⅠ、CD CHO Medium 及含添加剂的CD CHO Medium 组合培养基不适合该细胞株的单克隆生长,确定MediumⅡ为最优基础培养基。与基础培养基MediumⅡ(78%)比较,添加Supplement a的组合培养基培养Cell pool 1的克隆形成率均值(43%)下降45%,添加Supplement b 和Supplement c 的克隆形成率均值(85%和79%)分别上升9%和2%。见表3。
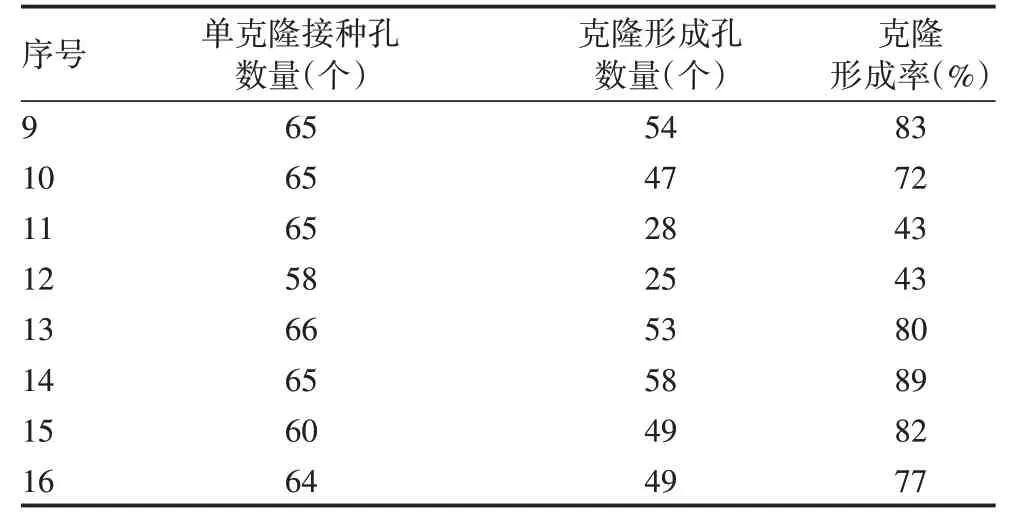
表3 Cell pool 1克隆形成率统计表Tab.3 Statistics of clone formation rate of Cell pool 1
2.1.3 单克隆增殖速率 与基础培养基组MediumⅡ比较,添加Supplement a和Supplement b的培养基培养细胞的增殖速率提高,且细胞数量增加2 倍以上;添加Supplement c的培养基培养的细胞增殖数量变化较小,部分孔板图像见图1。表明Supplement a 和Supplement b 添加剂与基础培养基组合均可大幅提高细胞的增殖速率,但添加Supplement a使克隆形成率下降45%(2.1.2 项结果);添加Supplement b 的孔底杂质较多,无法获得清晰的单克隆源性图像证明。因此,两者均不能作为添加剂用于单克隆细胞筛选。根据上述结果确定单独使用MediumⅡ为最适单克隆生长培养基。
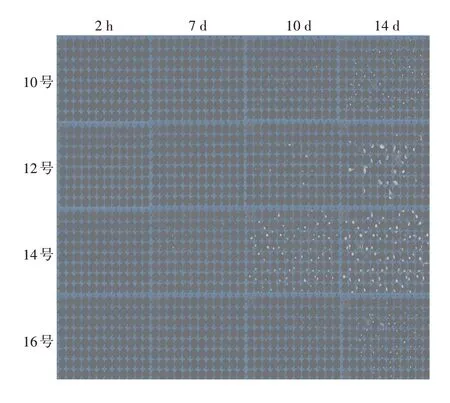
图1 Cell pool 1部分单克隆培养板的图像展示Fig. 1 Image display of part monoclonal culture plates of Cell pool 1
2.1.4 单克隆图像效果 接种后2h及7、10 和14 d的细胞单克隆源性图像显示,培养基体积为200 μL/孔的细胞单克隆源性图像有重影现象,100 μL/孔的图像效果明显好转,见图2。100 及200 μL/孔接种克隆形成率均值分别为72%(9、11、13、15号)和70%(10、12、14、16号),表明两种接种体积对细胞增殖的影响较小。确定最佳培养体积为100 μL/孔。

图2 不同培养基体积培养细胞的成像效果比较Fig. 2 Comparison of imaging effects of cells in different medium volumes
2.2 CHO工程细胞株单克隆筛选方法适用性的验证
2.2.1 单克隆接种率 Cell pool 2、Cell pool 3、Cell pool 4 单克隆接种率均值为78%,标准差为2%,CV为2%,表明不同细胞池单克隆接种率稳定,见表4。
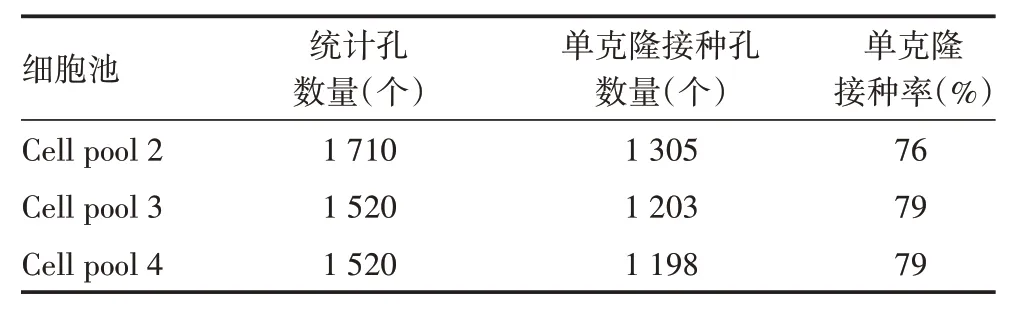
表4 不同细胞池的单克隆接种率Tab.4 Clone inoculation rate of different cell pools
2.2.2 克隆形成率 Cell pool 2、Cell pool 3、Cell pool 4 克隆形成率均值为67%,标准差为3%,CV为5%,表明不同细胞池克隆形成率稳定,见表5。
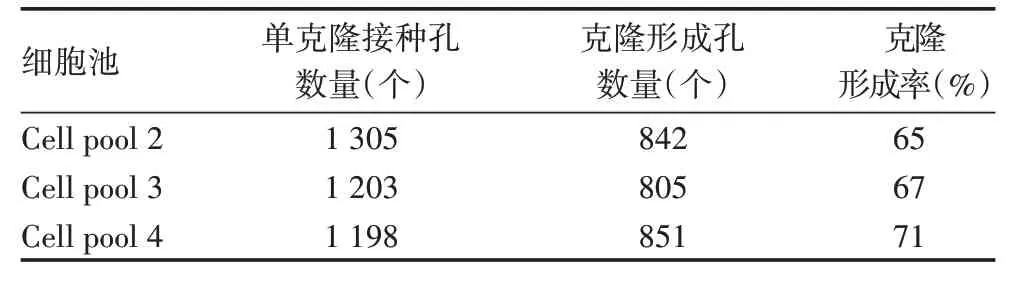
表5 不同细胞池的克隆形成率Tab.5 Clone formation rate of different cell pools
2.2.3 单克隆增殖速率 Cell pool 2、Cell pool 3、Cell pool 4细胞均能正常增殖,增殖速率略有差异。部分孔板图像见图3。

图3 接种不同细胞池孔板的细胞增殖情况Fig. 3 Proliferation of cells in well plates inoculated with different cell pools
2.2.4 单克隆图像效果 Cell pool 2、Cell pool 3、Cell pool 4均可观察到完整的细胞由1个分裂成2个,2个分裂成4 个,直至呈现细胞群的清晰图像。单克隆细胞分裂增殖过程见图4。

图4 单克隆细胞分裂增殖过程Fig.4 Process of monoclonal cell division and proliferation
3 讨论
人用药品注册技术要求国际协调会(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH)Q5D指出,生产重组产品的细胞克隆应为源自一个祖细胞且含有所需序列的转染细胞。工程细胞株的单克隆源性关系到产品产量和质量的稳定性,因此,生产用工程细胞株的单克隆源性受到监管机构的高度重视[21-23]。本研究通过调整孔板培养体积,可获得清晰的单克隆源性影像证据,满足监管机构的要求。前期试验研究发现,每孔添加150、180、200 μL 的单克隆生长培养基,在孔边缘细胞均出现重影,而添加100 μL 时重影现象明显减少或消失。本研究也发现,每孔培养体积由200 μL 改为100 μL 后,孔底重影区域变小,即使细胞处于重影区域,重影现象也并不明显,能够达到分辨单细胞的要求。但100 μL 的体系较小,在孔板培养过程中需密切关注环境湿度,避免出现因培养基过量蒸发导致体系渗透压升高,从而出现细胞死亡的情况。
培养基成分决定了细胞的生长环境,直接影响细胞的生长、蛋白的产量及质量,培养基的筛选优化广泛应用于工程细胞株生产的各阶段[24-25]。本研究针对单个细胞体外培养不易生长的特点,优化了多种单克隆生长培养基组合,结果表明,单克隆生长培养基对单个细胞生长状态影响显著,Medium Ⅱ与Supplement b组合既能提高克隆形成率又能提高单克隆增殖速率,但孔底杂质较多,无法获得清晰的单克隆源性图像证明,尝试增加37 ℃混匀时间及采用0.22 μm滤膜过滤等方式均未能解决板底杂质多的问题(未发表)。推测原因可能为两种试剂中部分成分产生反应形成沉淀,该问题有待进一步研究解决。在采用MediumⅡ进行单克隆接种时发现,少量细胞在接种后出现贴壁现象,细胞培养7 d 后,该现象逐渐消失。这种现象可能与MediumⅡ成分有关,今后将通过改变MediumⅡ浓度、更换96孔板材质等方法进一步优化。
综上所述,本研究建立了使用VIPS进行工程细胞株单克隆筛选的方法,并在不同细胞池中进行了验证,单克隆接种率和克隆形成率均稳定,且单克隆源性图像效果清晰,可满足监管机构的要求。本研究为单克隆筛选过程中出现的问题提供了新的解决思路。

