水稻抗倒伏候选基因的鉴定与功能分析

摘要 为进一步挖掘控制水稻抗倒伏的基因,以524 份水稻种质资源为材料,采用GWAS(genome-wideassociation analysis)鉴定与抗倒伏性状显著关联的位点qRLG7,通过基因表达水平分析和候选基因关联分析确定调控水稻抗倒伏性的候选基因,在分析候选基因的表达特征和启动子区自然变异基础上利用CRISPRCas9技术构建2 个候选基因的突变体家系,考察转基因材料的抗倒伏性状。结果显示,编码肌醇-1-单磷酸酶的2 个串联排列基因LOC_Os07g37220 和LOC_Os07g37230 在离茎秆基部5 cm 节间中的表达量显著高于其余候选基因,而且这2 个候选基因的表达量在极端抗倒伏和易倒伏2 组材料中存在极显著差异;通过候选基因关联分析发现这2 个基因启动子区的SNP 与离基部5 cm 茎秆直径(CD5)的表型值显著关联,且基于显著关联SNP 的2种单倍型的CD5 表型值存在显著差异,这2 个候选基因的2 种单倍型启动子活性检测结果也表明2 种单倍型之间存在极显著差异;2 个基因的功能缺失突变体植株在基部节间抗折力、茎秆厚度、茎秆直径以及株高和穗质量等性状方面与野生型对照存在显著差异。结果表明,候选基因LOC_Os07g37220 和LOC_Os07g37230 具有一定的抗倒伏功能。
关键词 水稻; 抗倒伏; 关联分析; 候选基因; 肌醇-1-单磷酸酶(IMP)
中图分类号 S511.330 文献标识码 A 文章编号 1000-2421(2024)02-0075-10
水稻作为禾本科作物之一,是我国60% 以上人口的主粮,也是全世界最主要的粮食作物之一,在粮食安全中占据重要的地位。在谷类作物中倒伏一直是限制作物高产稳产的最主要障碍之一,倒伏在很大程度上不仅影响粮食的产量和质量并且大大增加了成熟后收获的困难程度。20 世纪60 年代,育种家在水稻中引入半矮秆基因sd-1,使用sd-1 基因降低植株高度从而降低了倒伏风险[1]。然而,矮化育种在降低植株高度的同时限制了植株冠层光合作用、导致生物量减少,从而限制了产量的进一步提高[2]。在生产过程中遇到大风暴雨等极端天气时,具有大穗的高产品种更容易倒伏。在田间管理中为了进一步提高水稻的产量,普遍采用高种植密度和重施肥技术,也会导致植株茎秆强度降低,植株可能再出现倒伏现象。因此,培育抗倒伏品种是保证水稻高产稳产的关键。
作物倒伏通常是由于外力作用使植株直立性失去平衡造成植物茎基部节间弯曲或断裂[3]。植物抗倒伏性主要取决于植株上部(上部叶、茎和种子)的质量和下部的推力。因此,在影响水稻抗倒伏相关的因素中,株高作为重要的因素被广泛研究[4-5]。许多关于水稻茎秆与抗倒伏性的研究发现其抗倒伏能力与基部茎的硬度或茎的细胞壁厚度呈正相关。例如,抗倒伏品种比易倒伏品种具有更厚的秆壁[6-8]。应用半矮秆性状和提高基部茎的机械强度已被认为是提高作物抗倒伏性的有效途径[9]。但由于抗倒伏性状遗传基础比较复杂,影响因素众多,前人对抗倒伏评价指标也有不同的描述,因此,利用丰富的水稻核心种质资源研究抗倒性的遗传变异和抗倒伏基因克隆的报道较少[10]。
本研究对全基因组关联分析(genome-wide associationanalysis,GWAS)鉴定得到的与抗倒伏性状显著关联的位点qRLG7,通过基因表达水平分析和候选基因关联分析确定调控水稻抗倒伏GWAS 鉴定到与水稻抗倒伏相关位点的候选基因进一步分析并确定候选基因的功能。在分析候选基因的表达特征和启动子区自然变异基础上利用CRISPR-Cas9 技术构建2 个候选基因的突变体家系,进行抗倒伏相关性状的表型考察,旨在为进一步挖掘和利用水稻抗倒伏候选基因用于水稻遗传改良提供参考。
1 材料与方法
1.1 试验材料
本研究使用的524 份水稻自然种质资源群体来自华中农业大学作物遗传改良全国重点实验室,具体品种信息参见RiceVarMap2 网站(http://ricevarmap.ncpgr.cn/),遗传转化的受体水稻品种为中花11(Zhonghua 11, ZH11)。
1.2 全基因组关联分析
本研究通过利用因子变换的混合线性模型(FaST-LMM)进行全基因组关联分析,其中覆盖水稻全基因组的SNP(single nucleotide polymorphisms)数量为2 863 169 个[去除次要等位基因频率(minorallele frequency,MAF)lt; 0.05 的位点]。根据GEC工具计算的有效SNP,将全基因组阈值设置为P =1.66×10-6。根据单倍型的频率,利用Plink 计算出连锁不平衡(linkage disequilibrium, LD)的统计指标r2。当r2 衰减到0.2 时,认为关联信号可能出现在变异体/基因上游150 kb 或下游150 kb 范围内,选择300 kb 距离作为识别重叠标记-性状关联信号的范围。为了减少线性混合模型由于过度补偿相关性(亲缘关系)而带来的假阴性,Q 矩阵是根据使用ADMIXTURE程序在水稻基因组上随机分布的188 165个SNP 计算得出的。
1.3 候选基因筛选
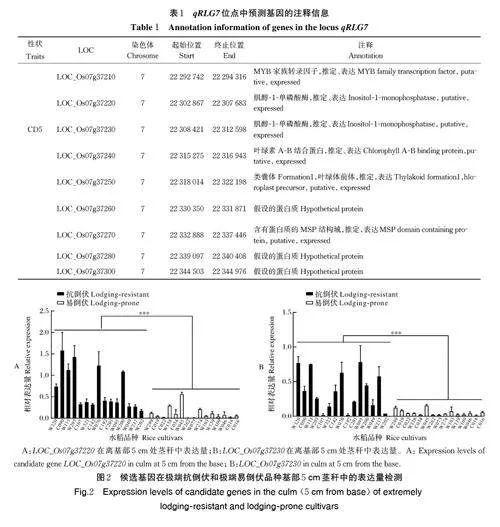
利用524 份水稻种质资源对17 个倒伏相关性状进行GWAS 并在第7 号染色体鉴定到1 个与水稻抗倒伏相关的显著关联位点(sf0722312558)[11]。根据GWAS 结果,对鉴定得到的抗倒伏关联位点的leadSNPs 上下游各取LD 值大小的区间[12],利用RiceSNP-SeeK Database( https://iric.irri.org/)获取区间内的信息,初步预测该关联位点的候选基因,并根据国家水稻数据库(https://www.ricedata.cn/)对候选基因进行注释。
1.4 候选基因单倍型分析
用于候选基因关联分析的524 份水稻种质资源的基因型数据从RiceVarMap2 数据库(http://ricevarmap.ncpgr. cn/)[13]中下载。利用TASSEL5 软件[14]进行候选基因关联分析。利用Haploview 4.2软件绘制单倍型分析中的LD 图谱。
1.5 不同单倍型启动子活性检测及表达量检测
启动子活性差异分析利用双荧光素酶报告基因来完成。将构建好的载体转化大肠杆菌感受态细胞,挑选阳性菌落,扩大培养后使用QIAGEN PlasmidMidi Kit 抽提高质量的质粒用于转化水稻原生质体[15],暗培养16~20 h 后,用酶标仪(TECAN,美国)测定F-LUC(firefly luciferase)和R-LUC(renilla luciferase)的荧光信号值,计算LUC 相对活性(DF-LUC/DR-LUC值),统计分析不同单倍型启动子是否存在显著性,进一步判断各SNP 对启动子活性的影响。
水稻组织总RNA 的抽提采用TRIzol Reagent(Invitrogen) 法。参照CooK Gene 公司提供的反转录试剂盒 (OneStep gDNA Removal)反转录合成20μL cDNA,并将cDNA 模板用去RNA 酶水稀释5~10 倍后取2 μL 用于Real-time PCR 反应的模板,加入0.2 mol/L 基因特异性引物,5 μL SYBR GreenMaster( Roche),总反应体系为10 μL,每个样品设置4 次重复,以水稻Ubiquitin 基因为内参基因,使用Step One Plus Real-Time PCR System( Applied Biosytems)仪器运行PCR 程序并进行结果分析,具体方法参照使用说明书。
1.6 转基因材料的载体构建及遗传转化
1)CRISPR-Cas9 载体构建。按照CRISPRPLANT指南设计候选基因LOC_Os07g37220 和LOC_Os07g37230 的向导RNA,选择2 条位置适合的向导RNA,在RNAfol Weds server 网站中分析向导RNA 的茎环结构。将包括两端向导RNA 片段的重叠延伸PCR 产物链接到稳定转化载体中,测序正确的载体用于后续的农杆菌转化。
2)启动子活性检测与载体构建。通过全基因组关联分析得到lead SNP 结合水稻524 份核心种质资源的CD5 表型数据,在Ricevarmap2 网站(http://ricevarmap.ncpgr.cn/) 中查询水稻524 份种质资源的基因型,进行基因型分型,从中选择2 个不同单倍型的代表品种金枝糯(Jinzhinuo)和珍汕97B(Zhenshan97B),以LOC_Os07g37220 和LOC_Os07g37230 基因的起始密码子的第1 个碱基为起始,截取上游1.5 kb 的序列作为基因的启动子分别扩增1 487 bp和1 351 bp 启动子片段,设计含相关酶切位点的特异性引物将不同单倍型的启动子连接到被 KpnⅠ和BamHⅠ酶切的pGreenII 0800-LUC 载体上。
3)遗传转化。本研究中的粳稻遗传转化采用Hiei 等[15]建立的农杆菌高效遗传转化方法。将筛选得到的抗性愈伤组织转移到分化培养基上,在光照条件下分化40 d 左右再生出植株;将再生植株转移到生根培养基中,光照培养7 d 左右诱导生根,炼苗3~5 d 后移栽到土壤中。
1.7 表型测定与方法
水稻抽穗后25 d 进行水稻抗倒伏相关性状的测定,每重复抽穗数达到总穗数的 80% 定义为全抽穗。每个重复选取 5 株,选取3 个重复共15 株测定相关表型数据,共采集 9 个倒伏相关性状的数据,表型测定参照Guo 等[10]的方法略有改进。
选取主茎从地上部到穗顶端(不带芒)长度记为株高,同时计算各节间长度。重心高是将测量株高的主茎找到一个平衡支点,测量茎秆基部到平衡支点的长度记为重心高度。截取主茎基部各节间,茎秆去除叶鞘,并保持新鲜不失水,用游标卡尺测量椭圆形中空茎秆的长短轴的外径记为茎秆直径,将测完茎秆直径后剪掉的各节间,再用游标卡尺的尖端测对应节间茎秆壁厚,茎秆抗折力用 YYD-1 测定仪测定。将剪掉的各节间茎秆中部放置于茎秆测定仪凹槽内,固定基部节间两支点的距离 5 cm,在节间中点施力使其折断,力的大小即为该节间抗折力。
1.8 数据分析
先利用Microsoft Excel 2010 对获得的表型数据进行初步整理,再利用SPSS 软件和Prism 8 进行统计学分析,用皮尔森卡方检验(Pearson chi-square)和费舍尔精确检验(Fisheries,exacttest)进行数据的比较分析,分析结果利用R 语言绘制热图。
2 结果与分析
2.1 GWAS数据分析及候选基因的鉴定
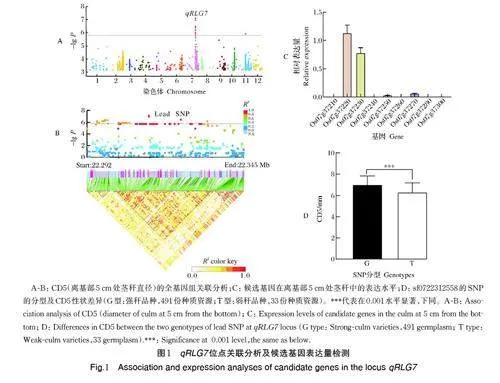
基于已发表的524 份水稻种质资源全基因组关联分析结果,使用混合线性模型(P =1.66×10-6)在第7 号染色体上鉴定到与基部10 cm 抗折力(bendingresistance,BS)、基部 5 cm 茎秆直径(5 cm stem diameterat the base,CD5) 、基部第一节间茎秆直径(CD1)、基部第二节间茎秆(CD2)具有极显著的关联信号(lead SNP 为sf0722312558),将该显著位点命名为qRLG7(图1A)。qRLG7 区间内(22.292~22.345Mb)共预测到9 个有差异表达的基因(图1B 和表1)。通过qRT-PCR 检测,该区间内在离基部5 cm 处茎秆有表的达9 个基因中Os07g37220 和Os07g37230 这2个基因的表达量极显著高于其余7 个基因(图1C)。LOC_Os07g37220 和LOC_Os07g37230 基因被预测编码肌醇-1- 单磷酸酶(inositol monophosphatase,IMP)。qRLG7 位点的lead SNP 被分为2 个主要的基因型(G/T),524 份水稻种质资源中基因型为G 的水稻在离基部5 cm 处的茎秆直径(CD5)显著大于基因型为T 的水稻的CD5(图1D)。
2.2 候选基因在极端品种茎秆的表达量检测
为进一步推定qRLG7 位点的抗倒伏候选基因,利用已发表的524 份水稻核心种质资源抗倒伏相关表型数据,选择极端抗倒伏和极端易倒伏种质资源各15 份,通过qRT-PCR 测定LOC_Os07g37220 和LOC_Os07g37230 在离基部5 cm 茎秆中的表达水平(图2A、B)。结果显示,这2 个基因在极端抗倒伏品种中离基部5 cm 处茎秆的表达量平均值极显著高于在极端易倒伏品种中相应位置的表达量平均值,且绝大部分抗倒伏品种中这2 个基因的表达量明显高于易倒伏品种中的表达量。这一结果表明LOC_Os07g37220 和LOC_Os07g37230 可能为qRLG7 位点的水稻抗倒伏候选基因。
2.3 候选基因的关联分析及单倍型分析
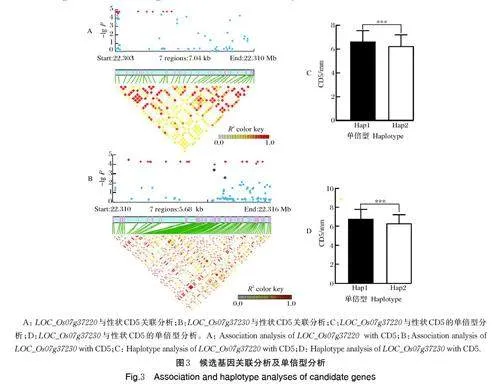
由于LOC_Os07g37220 和LOC_Os07g37230 在极端品种茎秆中的表达量存在显著差异,分析这2 个基因与CD5 之间的关联情况。从RiceVarMap2 网站(http://ricevarmap. ncpgr. cn/) 数据库中提取LOC_Os07g37220 和LOC_Os07g37230 基因2 kb 的启动子及整个编码区的SNP,去除其中稀有变异(SNP 频率小于0.05)后,分别剩下82 个SNP 和103个SNP 用于候选基因关联分析。LOC_Os07g37220和LOC_Os07g37230 分别有24 个SNP 和19 个SNP超过了Bonferroni 校正的阈值(分别为6.1×10-4 和4.85×10-4)与CD5 的表型值显著关联(图3A、B)。LOC_Os07g37220 的24 个显著关联的SNP 中有3 个位于启动子区, LOC_Os07g37230 的19 个SNP 中有8 个位于启动子区。对这2 个候选基因的启动子区显著关联的SNP 进行单倍型分析,分别得到2 个主要的单倍型,且单倍型Hap1 的CD5 表型值显著大于单倍型Hap2(图3C、D)。
2.4 候选基因的启动子活性检测
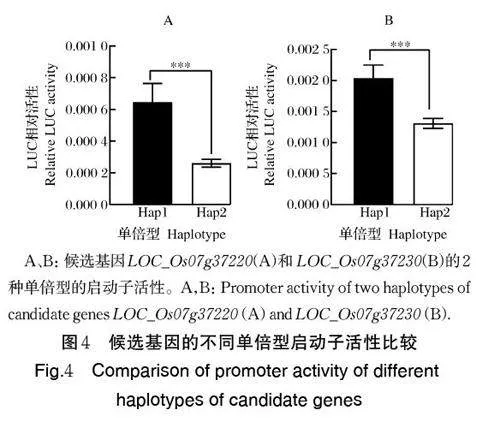
考虑到2 个候选基因在极端品种基部5 cm 处茎秆中的表达量有显著差异,而且候选基因关联分析结果又显示启动子区与CD5 表型值存在显著关联,推测LOC_Os07g37220 和LOC_Os07g37230 的启动子区的序列变异可能导致了基因表达量的变化,进而导致了CD5 的表型差异。为验证这一推论,以qRLG7 位点lead SNP 的2 种基因型(G/T)(图1D)为基础,结合2 个候选基因的启动子区2 个单倍型(G-Hap1、T-Hap2),根据已有的水稻自然群体CD5表型数据,选择2 个不同单倍型的代表品种 Jinzhinuo和Zhenshan 97B 为材料扩增这2 个基因相应的启动子。以起始密码子的第1 个碱基为起始,截取上游1.5 kb 左右的序列作为基因的启动子,构建强单倍型 (Hap1)和弱单倍型 (Hap2) 启动子驱动的双荧光素酶报告系统并利用水稻原生质体双荧光报告系统研究LOC_Os07g37220 和LOC_Os07g37230启动子活性。双荧光素酶报告系统结果显示,Hap1的启动子活性极显著高于Hap2,说明Hap1 属于高表达的单倍型(图4A、B),这与极端品种基部5 cm茎秆处表达量检测以及候选基因关联分析结果相吻合。
2.5 候选基因突变体构建及表型鉴定
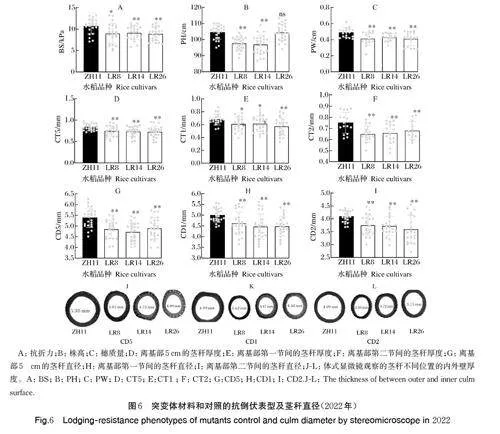
为了进一步验证候选基因LOC_Os07g37220 和LOC_Os07g37230 的功能,利用CRISPR-Cas9 技术对这2 个基因进行同时突变,产生了3 个突变体家系(LR8、LR14、LR26),靶位点信息及编辑情况见图5A。于2021 和2022 年对抽穗25 d 后的ZH11 及突变体家系水稻植株进行抗倒相关性状表型考察。结果显示,与对照(ZH11)相比,3 个突变体家系的抗折力、穗质量、离基部5 cm 的茎秆厚度、离基部第一节间的茎秆厚度、离基部第二节间的茎秆厚度、离基部5 cm 处茎秆直径、离基部第一节间的茎秆直径、离基部第二节间的茎秆直径极显著或显著水平降低,LR8和LR142 个突变体家系的株高极显著低于对照,而LR26 家系的株高与对照株高无显著差异(图5B-J)和(图6A-I)。为了进一步观察3 个突变体与对照茎秆的差异,通过体视显微镜观察到3 个突变体家系的 CD5、CD1、CD2 明显小于对照(图6J-L)。这些结果表明,LOC_Os07g37220 和LOC_Os07g37230 具有一定的抗倒伏功能。
3 讨论
抗倒伏是保证水稻高产稳产的重要性状之一,近几年来一些育种家开始开展水稻抗倒伏育种。 然而,水稻育种始终面临着高产和抗倒伏之间的权衡[17]。许多研究表明,植物茎秆强度是抗倒伏的主要因素[8 , 18]。一些研究人员通过利用强壮茎秆的等位基因进行品种改良,但由于茎秆强度和谷物产量之间的负相关关系,并没有成功[19]。到目前为止,矮化植株一直是提高水稻抗倒伏的主要目标,半矮秆基因如sd-1 和Rht1 分别解决了水稻和小麦的倒伏问题,然而,在一些携带矮秆基因Rht1 和Rht2 的小麦品种中,仍然观察到倒伏现象[20]。
为了揭示水稻茎秆强度的遗传背景,已经检测到一些数量性状位点(QTLs)和茎秆强度相关的基因,在大麦[21]、玉米[22]、水稻[23]和拟南芥[20]中鉴定了许多茎秆强度缺失突变体,例如大麦的脆杆突变体bc 与野生型相比,纤维素的含量减少了80%,导致茎秆抗折力降低[24]。玉米Bk2 基因的突变体通过减少次生细胞壁中纤维素的沉积来影响玉米的茎秆强度[22]。水稻突变体bc1 在次级细胞壁的合成中不仅纤维素含量降低,而且木质素水平增加导致机械强度降低[25]。在拟南芥中,不规则木质部突变体(irx1-irx3)在次生壁中纤维素含量减少,使成熟茎的硬度降低,最终导致茎秆机械强度降低而出现倒伏现象[26]。除这些基因外,在籼稻品种中检测出 SCM1和SCM2 2 个QTL,SCM2 与APO1 相似,通过编码含F-box 结构域的蛋白质来调控茎秆直径和茎秆形态[18],在热带粳稻中检测到SCM3 和SCM4 2 个QTL [27],具有这些QTL 或基因的优势等位基因的品种表现出较大的抗折力和弯矩力,从而使植株抗倒伏。对于温带粳稻品种,仅检测到与半矮秆基因sd1 的等位SD1 与茎秆厚度相关的基因[28]。然而,使用染色体片段代换系(CSSL)和重组自交系(RIL)进行的QTL 结果表明,除SD1 外温带粳稻品种中存在与茎秆强度相关的某些基因[28-29]。之前的研究均使用了CSSL 和RIL 的QTL 分析[30],然而,这些双亲QTL 分析仅考虑来自2 个品种的等位基因,不可能识别与茎秆强度相关的多个基因。近年来,随着二代测序技术的进展,利用高通量测序技术进行全基因组关联研究,为分析水稻重要性状的遗传结构和寻找重要基因提供了有力工具。
本研究基于候选基因关联分析、单倍型分析和功能注释,逐步缩小候选区间,在qRLG7 的22.292~22.345 Mb 区间内鉴定到与水稻抗倒伏相关性状(CD5)的2 个候选基因(LOC_Os07g37220 和LOC_Os07g37230),这2 个基因编码IMP。同时缺失这2 个基因的突变体植株相比于对照其BS、PH、PL、CT5、CT1、CT2、CD5、CD1、CD2 等抗倒性相关性状显著或极显著降低。表明这2 个候选基因可能具有正调控水稻抗倒伏的功能,但该基因调控抗倒性的分子机制还需要进一步研究。IMP 是一种可溶性Li+ 敏感的蛋白质,IMP 在肌醇生物合成的最后一步催化肌醇-3-磷酸的去磷酸化,IMP 还可以使其他肌醇磷酸化合物去磷酸化,在肌醇的从头合成和循环利用中都需要IMP,因此,IMP 被认为是所有游离肌醇传导途径的潜在调控点[31]。对于IMP 基因在水稻中的作用和调控仍知之甚少,而且目前尚未报道IMP 基因与植物抗倒伏功能的相关性。本研究发现IMP 功能缺失显著降低了水稻抗倒伏相关性状,可为进一步挖掘和利用水稻抗倒性位点以及抗倒性基因提供参考。
参考文献 References
[1] PENG J,RICHARDS D E,HARTLEY N M,et al‘. Green
Revolution’ genes encode mutant gibberellin response modulators
[J].Nature,1999,400(6741):256-261.
[2] ISLAM M S,PENG S B,VISPERAS R M,et al.Lodging-related
morphological traits of hybrid rice in a tropical irrigated
ecosystem[J].Field crops research,2007,101(2):240-248.
[3] PINTHUS M J. Lodging in wheat,barley,and oats:the phenomenon,
its causes,and preventive measures[J].Advances in
agronomy,1974,25:209-263.
[4] KELLER M, KARUTZ C, SCHMID J, et al. Quantitative
trait loci for lodging resistance in a segregating wheat×spelt
population[J].Theoretical and appliedgenetics,1999, 98(6):
1171-1182.
[5] KELBERT A J,SPANER D,BRIGGS K G,et al.The association
of culm anatomy with lodging susceptibility in modern
spring wheat genotypes[J].Euphytica,2004,136(2):211-221.
[6] TRIPATHI S C,SAYRE K D,KAUL J N,et al.Growth and
morphology of spring wheat (Triticum aestivum L.) culms
and their association with lodging:effects of genotypes,N levels
and ethephon[J]. Field crops research,2003,84(3):
271-290.
[7] KONG E Y,LIU D C,GUO X L,et al.Anatomical and chemical
characteristics associated with lodging resistance in wheat
[J].The crop journal,2013,1(1):43-49.
[8] LIU C,ZHENG S,GUI J S,et al.Shortened basal internodes
encodes a gibberellin 2-oxidase and contributes to lodging resistance
in rice[J].Molecular plant,2018,11(2):288-299.
[9] 袁新捷,刘潇,陈国兴. 水稻核心种质资源茎秆抗倒伏性研究
[J]. 华中农业大学学报,2021,40(1):147-153.YUAN X J,
LIU X,CHEN G X.Stem lodging resistance of rice core germplasm
[J].Journal of Huazhong Agricultural University,2021,
40(1):147-153( in Chinese with English abstract).
[10] GUO Z L,LIU X,ZHANG B,et al.Genetic analyses of lodging
resistance and yield provide insights into post-Green-Revolution
breeding in rice[J].Plant biotechnology journal,2021,19
(4):814-829.
[11] ZHAO J,YANG W,ZHANG S,et al.Genome-wide associa‐
tion study andcandidategen-e analysis of rice cadmium accumulation
in grain in a diverse ricecollection[J/OL].Rice,2018,11
(1): 61[2023-03-18] .https://doi.org/10.1186/s12284-018-
0254-x.
[12] ZHAO H,YAO W,OUYANG Y,et al.Rice VarMap: a comprehensive
database of rice genomic variations[J].Nucleic acids
res,2015,43: 1018-1022.
[13] BRADBURY P J,ZHANG Z W,KROON D E,et al.TASSEL:
software for association mapping of complex traits in diverse
samples[J].Bioinformatics,2007,23(19):2633-2635.
[14] SHEN J,LIU J,XIE K,et al. Translational repression by a
miniature inverted- repeat transposable element in the 3′ untranslated
region[J/OL].Nature communications,2017,8(1):
14651[2023-03-18].https://doi.org/10.1038/ncomms14651.
[15] HIEI Y,KOMARI T. Agrobacterium-mediated transformation
of rice using immature embryos or calli induced from mature
seed[J].Nature protocols,2008,3( 5): 824-834.
[16] MENG B,WANG T,LUO Y,et al.Genome-wide association
study identified novel candidate loci/genes affecting lodging resistance
in rice[J/OL]. Genes,2021,12(5): 718[2023-03-
18].https://doi.org/10.3390/genes12050718.
[17] OOKAWA T,HOBO T,YANO M,et al.New approach for
rice improvement using a pleiotropic QTL gene for lodging resistance
and yield[J/OL]. Nature communications,2010,1:
132[2023-03-18].https://doi.org/10.1038/ncomms1132.
[18] HIRANO K,ORDONIO R L,MATSUOKA M.Engineering
the lodging resistance mechanism of post-Green Revolution
rice to meet future demands[J].Proceedings of the Japan Academy.
Series B:physical and biological sciences,2017,93(4):
220-233.
[19] BERRY P M,SPINK J H,GAY A P,et al.A comparison of
root and stem lodging risks among winter wheat cultivars[J].
The journal of agricultural science,2003,141(2):191-202.
[20] KOKUBO A,KURAISHI S,SAKURAI N.Culm strength of
barley:correlation among maximum bending stress,cell wall
dimensions,and cellulose content[J].Plant physiology,1989,
91(3):876-882.
[21] CHING A,DHUGGA K S,APPENZELLER L,et al.Brittle
stalk 2 encodes a putative glycosylphosphatidylinositol-anchored
protein that affects mechanical strength of maize tissues
by altering the composition and structure of secondary cell
walls[J].Planta,2006,224(5):1174-1184.
[22] AOHARA T,KOTAKE T,KANEKO Y,et al. Rice brittle
culm 5 (brittle node) is involved in secondary cell wall formation
in the sclerenchyma tissue of nodes[J].Plant amp; cell physiology,
2009,50(11):1886-1897.
[23] ZHONG R Q,PEÑA M J,ZHOU G K,et al. Arabidopsis
fragile fiber 8,which encodes a putative glucuronyltransferase,
is essential for normal secondary wall synthesis[J].The plant
cell,2005,17(12):3390-3408.
[24] LI P,LIU Y R,TAN W Q,et al.Brittle culm 1 encodes a COBRA-
like protein involved in secondary cell wall cellulose biosynthesis
in sorghum[J].Plant amp; cell physiology,2019,60(4):
788-801.
[25] TURNER S R,SOMERVILLE C R.Collapsed xylem phenotype
of Arabidopsis identifies mutants deficient in cellulose deposition
in the secondary cell wall[J].The plant cell,1997,9
(5):689-701.
[26] YANO K,OOKAWA T,AYA K,et al. Isolation of a novel
lodging resistance QTL gene involved in strigolactone signaling
and its pyramiding with a QTL gene involved in another
mechanism[J].Molecular plant,2015,8(2):303-314.
[27] OOKAWA T,AOBA R,YAMAMOTO T,et al.Precise estimation
of genomic regions controlling lodging resistance using
a set of reciprocal chromosome segment substitution lines in
rice[J/OL]. Scientific reports,2016,6:30572[2023-03-18].
https://doi.org/10.1038/srep30572.
[28] NOMURA T,ARAKAWA N,YAMAMOTO T,et al.Next
generation long-culm rice with superior lodging resistance and
high grain yield,Monster Rice 1[J/OL].PLoS One,2019,14
(8):e0221424[2023-03-18]. https://doi. org/10.1371/journal.
pone.0221424.
[29] MULSANTI I W,YAMAMOTO T,UEDA T,et al.Finding
the superior allele of japonica-type for increasing stem lodging
resistance in indica rice varieties using chromosome segment
substitution lines[J/OL].Rice,2018,11(1):25[2023-03-18].
https://doi.org/10.1186/s12284-018-0216-3.
[30] PARTHASARATHY L,VADNAL R E,PARTHASARATHY
R,et al.Biochemical and molecular properties of lithiumsensitive
myo-inositol monophosphatase[J]. Life sciences,
1994,54(16):1127-1142.
[31] HALLCHER L M,SHERMAN W R.The effects of lithium
ion and other agents on the activity of myo-inositol-1-phosphatase
from bovine brain[J]. Journal of biological chemistry,
1980,255(22):10896-10901.
(责任编辑:张志钰)

