盐碱胁迫对牛至种子萌发和幼苗生理生化特性的影响





摘要:以牛至(Origanum vulgare L.)种子为试验材料,研究盐(25,50,75,100,125 mmol·L-1):碱(25,50,75,100,125 mmol·L-1)胁迫对牛至种子萌发特性和幼苗生长的影响,为牛至种子育苗和栽培提供依据。结果表明:随着盐碱胁迫浓度升高,牛至种子的发芽率、发芽势、发芽指数、活力指数逐渐降低;牛至幼苗中丙二醛含量升高,脯氨酸和可溶性蛋白含量升高,可溶性糖的含量先升高后降低;超氧化物歧化酶(Superoxide dismulase,SOD)、过氧化物酶(Peroxidase,POD)、过氧化氢酶(Catalase,CAT)活性均为先升高后降低,SOD,CAT活性盐碱浓度均在75 mmol·L-1时达到最大。碱胁迫对牛至种子及幼苗的相对盐害程度大于盐胁迫,在25 mmol·L-1浓度下,碱胁迫对牛至种子的相对盐害率是盐胁迫的2.8倍。综上,盐碱胁迫显著影响牛至种子萌发和幼苗生长,牛至种子萌发和幼苗生长对碱胁迫更为敏感,建议牛至种子盐碱育苗时应选择盐碱度较低的土地(盐浓度lt;50 mmol·L-1、碱浓度lt;25 mmol·L-1)。
关键词:牛至;盐碱胁迫;种子萌发;生理指标
中图分类号:S567.239""" 文献标识码:A"""" 文章编号:1007-0435(2024)06-1882-11
Effects of Saline-Alkali Stresses on Seed Germination and Seedling Physiological
and Biochemical Characteristics of Origanum vulgare
YU Chan, ZHANG Yi-lin, LI Qiu-ying, ZHOU Yan, LI He-min, XIA Zhi*, HUANG Yong*
(Henan Agricultural University, Zhengzhou, Henan Province 450018, China)
Abstract:The seed of Origanum vulgare L. was used as test materials to investigate the effects of salt (25,50,75,100,125 mmol·L-1) and alkali (25,50,75,100,125 mmol·L-1) stress on the germination characteristics of O. vulgare seed and seedling growth. It provides the basis for the breeding and cultivation of O. vulgare seed. The results showed that the germination rate,germination potential,germination index and vitality index of O. vulgare seed gradually decreased with the increase of salt and alkali stress concentration. In O. vulgare seedsling,the content of malondialdehyde increased,the content of proline and soluble proteins increased,and the content of soluble sugars firstly increased and then decreased. The activities of Superoxide dismutase (SOD),Peroxidase (POD),and Catalase (CAT) increased first and then decreased,SOD and CAT activities reached the maximum at 75 mmol·L-1for both salt and alkali concentrations. The relative salt damage of alkali stress on O. vulgare seed and seedling was greater than salt stress,and the relative salt damage rate of alkali stress on O. vulgare seed were 2.8 times higher than salt stress at 25 mmol·L-1 concentration. In conclusion,saline and alkaline stress significantly affected seed germination and seedling growth of O. vulgare,and the seeds germination and seedling growth of O. vulgare were more sensitive to alkaline stress,so it suggested that soil with low salinity and alkali (salt concentrationlt;50 mmol·L-1,alkali concentrationlt;25 mmol·L-1) should be used for cultivation of O. vulgare seed.
Key words:Origanum vulgare L.;Salt and alkali stress;Seed germination;Physiological indicators
我国盐碱化土壤约占世界盐碱地面积的10%[1],土壤盐碱化已成为我国农业粮食安全和农业可持续利用的一大障碍[2],筛选和种植耐盐碱植物是有效利用盐碱土地资源的重要手段之一[3]。盐碱土中可溶性盐离子来自中性盐或碱性盐,将中性盐胁迫称为盐胁迫,碱性盐胁迫称为碱胁迫[4]。盐胁迫一般包括渗透胁迫、离子胁迫和氧化胁迫,而碱胁迫除了这些因素外还包括pH值胁迫[5]。通常土壤碱化与盐化相伴发生,在干旱地区更为明显。研究植物对盐碱胁迫的响应,明确植物耐受盐碱胁迫的机制,对盐碱地区植物的引种栽培和合理利用盐碱地具有重要意义。
牛至(Origanum vulgare L.)为唇形科(Labiatae)牛至属(Origanum)多年生草本芳香植物,以全草入药,其味辛,微温,归肺、胃、膀胱经,具有清暑解表,利水消肿的功效[6]。牛至含有香芹酚和百里香酚等主要活性成分,具有抗氧化、抗菌等药理活性[7]。牛至是一种理想的抗生素替代品,也是世界范围内公认的天然饲料添加剂[8]。牛至主要分布于甘肃、新疆、河南、陕西和江苏等地,多生长于丘陵坡地,路旁以及林下等地[6]。丘陵坡地地势高,保水能力相对较弱,易导致土壤养分、有机质流失和土壤盐碱化等问题[9]。近年来,盐碱胁迫对药用植物生长发育和有效成分含量的影响及耐盐碱机理成为研究的热点[10-12],种子萌发期和幼苗期是植物对外界环境最敏感的阶段,是评价植物抗逆性的重要依据[13]。目前,牛至的研究多集中在牛至精油抗菌抗氧化[14]、化学成分分析[15]等方面,有关牛至对盐碱胁迫的响应和盐碱胁迫对牛至种子萌发、幼苗生长的影响鲜见报道。因此,本文以牛至种子为试验材料,研究盐碱胁迫对牛至种子萌发、幼苗生长和生理的影响,探讨牛至种子萌发对盐碱胁迫的响应,为牛至种子育苗和栽培提供理论参考。
1 材料与方法
1.1 试验材料
供试牛至种子2022年10月购于河南确山牛至种植基地,经河南农业大学中药材系夏至教授鉴定为唇形科植物牛至(Origanum vulgare L.),千粒重为0.039 g,室温储藏。
1.2 试验设计
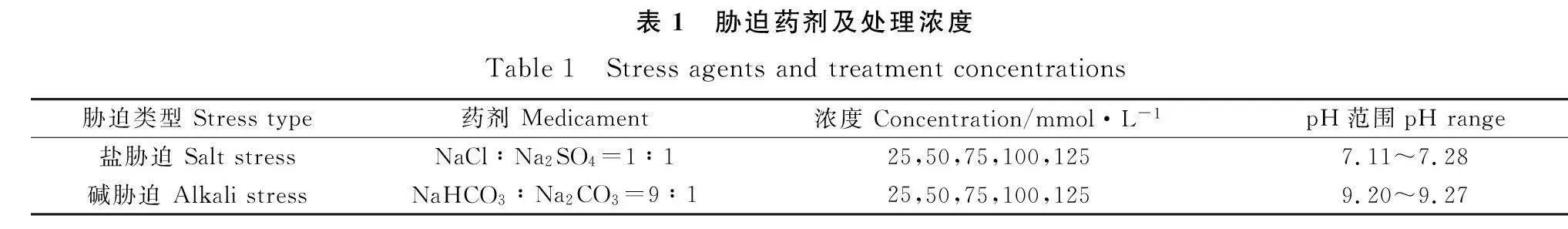
1.2.1 盐碱胁迫处理设置 盐胁迫参照刘晓静的方法[16],采用等摩尔浓度的NaCl和Na2SO4混合中性溶液模拟;碱胁迫参照贾秀峰的方法[17],采用9∶1摩尔比的NaHCO3和Na2CO3混合碱性盐溶液模拟,盐碱浓度分别设为25,50,75,100,125 mmol·L-1,以蒸馏水为对照。药剂及浓度设置见表1。
1.2.2 种子发芽试验 挑选籽粒饱满一致的牛至种子经2.00% H2O2溶液中消毒10 min,用蒸馏水反复冲洗,将种子放置铺有双层滤纸的10 cm培养皿中,每培养皿分别加相应浓度盐碱溶液10 mL,对照加入10 mL蒸馏水,每皿放50粒种子,用封口膜封口,每2 d补充相应的处理液和蒸馏水3 mL。将培养皿放置在人工气候箱中,昼夜温度设为25℃和15℃,空气相对湿度70%,光照强度为2 500 lx,光照时长为12 h·d-1,每处理设4次重复。每天统计发芽种子数量,种子露白即视为发芽,发芽时限为14 d[18],并于第14 d从培养皿中选取生长一致的牛至幼苗5株,测量幼苗茎长、根长和幼苗鲜重。
1.2.3 幼苗生长试验 将牛至种子播种于塑料盆(盆口直径5 cm,深4 cm)中,基质为营养土:蛭石=3∶1,用量为12 g,放置于人工气候箱,光照强度为2 500 lx,昼夜温度设为25℃和15℃,空气相对湿度70%,光照时长为12 h·d-1。待牛至幼苗到4叶期时(第30 d)进行胁迫处理,以蒸馏水为对照,分别浇入等量不同浓度的溶液10 mL,试验过程中各处理的管理措施一致,每盆8株苗,每处理重复5次。牛至幼苗处理后第7 d测定幼苗株高、冠幅,并于上午9:00取幼苗叶片用锡箔纸包裹后迅速转入液氮中,待取样完成后转入-40℃冰箱中保存用于生理指标测定。
1.3 测定指标及方法
1.3.1 种子萌发指标测定 根据统计的发芽数计算日相对萌发率、第14 d的发芽率、第5 d的发芽势、发芽指数、活力指数、相对盐害率,计算方法如下:
日相对萌发率(%)=nSN0×100%[19]
式中:n为相应各日正常发芽粒数,SN0为供试种子总粒数。
发芽率(%)=14 d发芽的种子数总种子数×100%[18]
发芽势(%)=5 d发芽的种子数总种子数×100%[18]
发芽指数(GI)=∑GtDt [18]
式中:Gt为第t天的发芽数,Dt为相应的发芽天数。
活力指数(Vi)=Gi×s[20]
式中:Gi为发芽指数,S为幼苗鲜重
相对盐害率=对照发芽率-胁迫处理发芽率对照发芽率×100%[20]
1.3.2 生长指标测定 用直尺测定幼苗的茎长、根长、冠幅,其中冠幅取两个垂直方向测定值的平均值。用分析天平测定幼苗鲜重,取平均值。
1.3.3 生理指标测定 参照王学奎[21]的方法,采用氮蓝四唑法测定超氧化物歧化酶(Superoxide dismulase,SOD)活性、愈创木酚法测定过氧化物酶(Peroxidase,POD)活性、考马斯亮蓝法测定可溶性蛋白含量和硫代巴比妥酸法测定丙二醛(Malondialdehyde,MDA)含量,采用紫外分光光度计法测定过氧化氢酶(Catalase,CAT)活性,采用蒽酮乙酸乙酯法测定可溶性糖含量和磺基水杨酸法测定游离脯氨酸(Proline,Pro)含量。
1.4 数据处理
利用Microsoft Excel 2022软件整理数据,使用SPSS 27.0软件对数据进行单因素方差分析(One-Way ANOVA)及多重比较(LSD法)(P=0.05),数据取平均值±标准误差,采用Origin绘图软件进行作图。
2 结果与分析
2.1 盐碱胁迫对牛至种子萌发动态的影响
由图1可知,盐胁迫处理后,牛至种子日相对萌发率降低,起始发芽时间推迟,而且随着盐胁迫浓度增加日相对萌发率降低和起始发芽时间推迟时间越多。25 mmol·L-1盐胁迫处理第14 d牛至日相对萌发率51%,与对照间相差不大;50,75,100,125 mmol·L-1盐胁迫处理第14 d牛至日相对萌发率分别比对照低7%,19%,25%和26%。25,50和75 mmol·L-1盐胁迫处理与对照均已在第3 d开始发芽,在第11 d达到最大发芽率。100和125 mmol·L-1盐溶液处理下牛至种子分别在第4、5 d开始发芽,并于第9、10 d达到最大发芽率。
由图2可知,随着碱胁迫浓度增加牛至种子萌发受到抑制作用越强,且达到最大发芽率的时间发生改变。碱胁迫处理后牛至种子日相对萌发率明显降低,25,50,75,100和125 mmol·L-1碱胁迫处理第14 d牛至日相对萌发率分别为54%,45%,37%,30%和21%,比对照降低了21.74%,34.78%,47.10%,57.25%和69.57%。碱胁迫处理和对照均在第3天已开始发芽,但达到最大日相对萌发率的时间不一致。对照在第11天达到最大值,25,50,75,100和125 mmol·L-1处理分别在第7,12,11,12和9天达到最大日相对萌发率。
2.2 盐碱胁迫对牛至种子发芽特性的影响
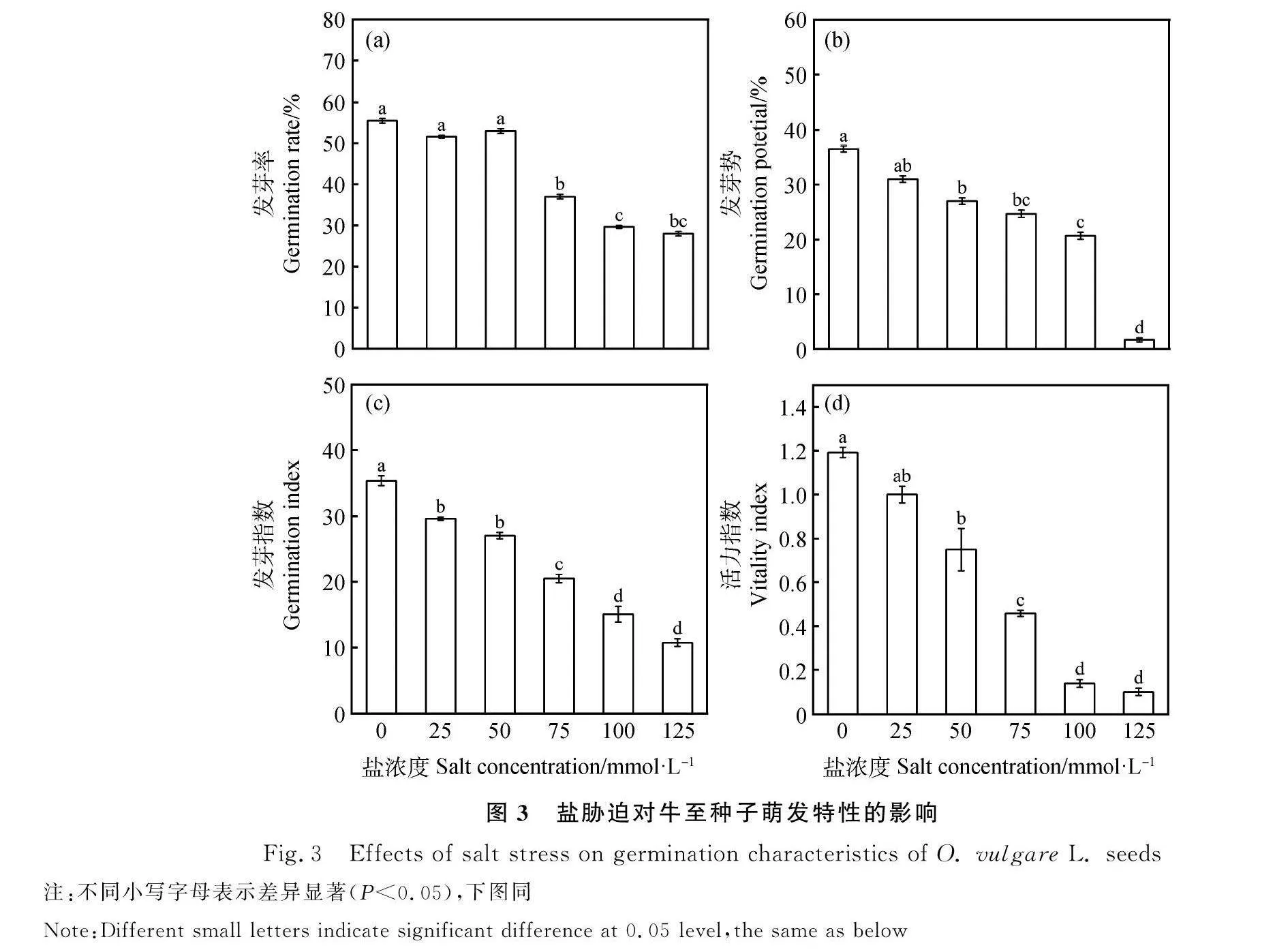
如图3所示,盐胁迫对牛至种子萌发影响较明显,随着盐浓度的增大,牛至种子的发芽率、发芽势、发芽指数和活力指数呈下降趋势。如图3(a)中,在不同浓度盐处理下,其中25和50 mmol·L-1处理后牛至种子发芽率与对照无显著差异(Plt;0.05),75,100和125 mmol·L-1处理后牛至种子的发芽率与对照相比均降低,差异显著(Plt;0.05),降低幅度达18.5%,25.83%和27.5%。图3 (b)中,当盐浓度在25 mmol·L-1时,与对照的发芽势差异不显著。在50,75,100和125 mmol·L-1处理下的发芽势均显著低于对照(Plt;0.05),分别比对照降低了9.5%,11.83%,15.83%和34.83%。图3 (c)中,牛至种子发芽指数与盐浓度的线性方程为:y=-4.953 4x+40.382,R2=0.992 1。5个处理的发芽指数分别为29.60,27.04,20.47,15.05和10.74,分别比对照低了5.77,8.33,14.9,20.32和24.63,差异显著(Plt;0.05),其中25与50 mmol·L-1盐处理间发芽指数差异不显著。图3(d)中,活力指数和盐浓度的线性方程为:y=-0.238x+1.439 4,R2=0.977 3。25 mmol·L-1低浓度盐溶液牛至种子的活力指数与对照间无显著差异,在50,75,100和125 mmol·L-1处理下的活力指数均显著低于对照(Plt;0.05),分别比对照低了37.18%,61.60%,88.30%和91.52%。这表明轻度盐胁迫(盐浓度lt;50 mmol·L-1)对牛至种子的萌发影响不显著,重度盐胁迫(盐浓度gt;50 mmol·L-1)抑制牛至种子的萌发。
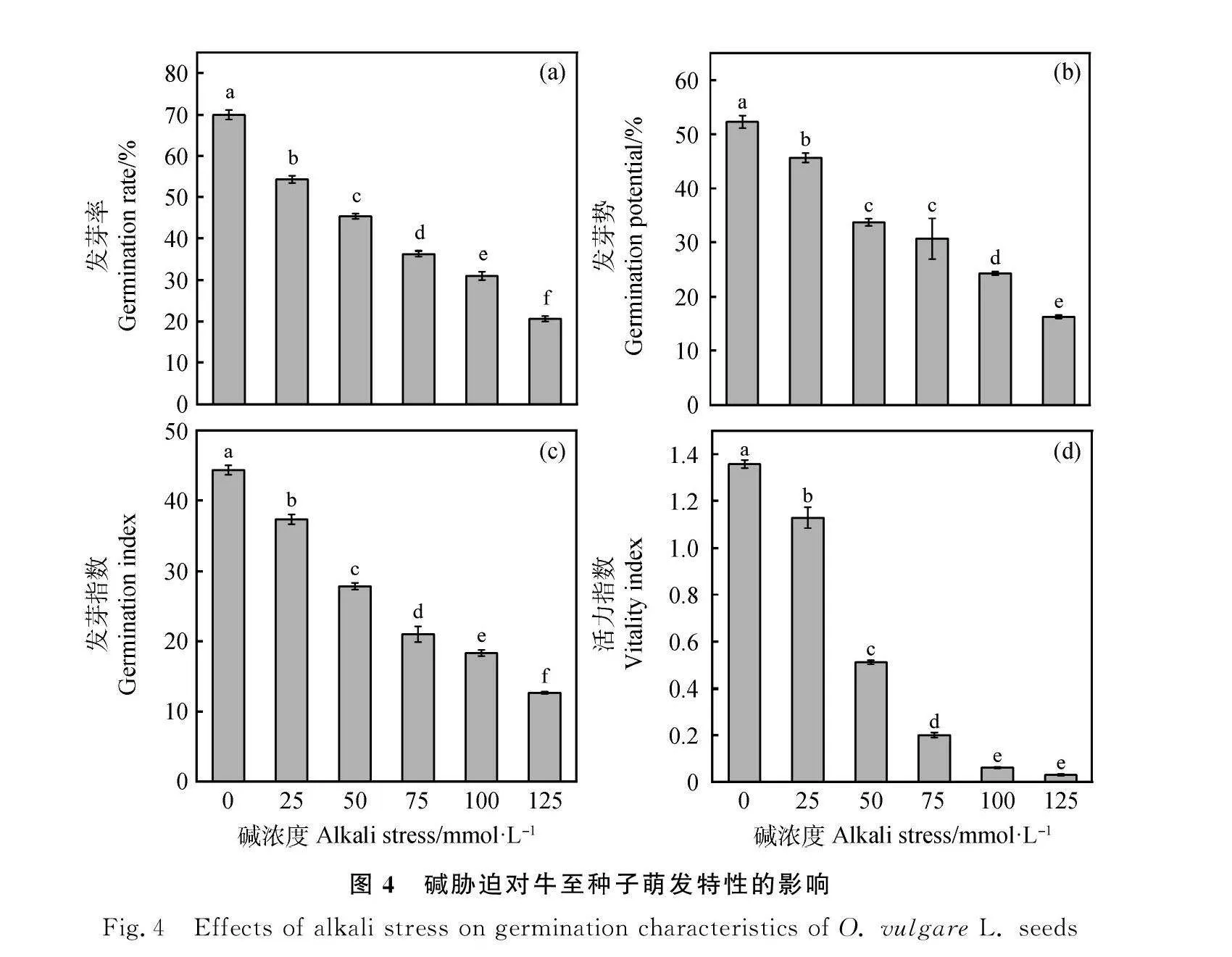
由图4所示,碱胁迫对牛至种子萌发影响比盐胁迫更明显,随着碱浓度的增大,牛至种子的发芽率、发芽势、发芽指数和活力指数均显著降低。如图4 (a)中,5个处理的发芽率均显著低于对照(Plt;0.05),分别比对照降低了15.67%,24.67%,33.67%,39.00%和49.33%。图4(b),25,50,75,100和125 mmol·L-1处理下牛至种子的发芽势分别为46%,34%,31%,24%和16%,分别较对照降低了6.66%,18.66%,21.66%,28.00%和36.00%,彼此间差异达显著水平(Plt;0.05)。图4(c)中,发芽指数与碱浓度的线性方程为:y=-6.490 3x+49.696,R2=0.965 4,碱胁迫处理发芽指数均显著低于对照(Plt;0.05);图4(d),活力指数与碱浓度的线性方程为:y=-0.012x+1.316 8,R2=0.917 1,均呈负相关,碱胁迫处理活力指数均显著低于对照(Plt;0.05)。说明在碱胁迫抑制牛至种子萌发,浓度越高抑制作用越强。
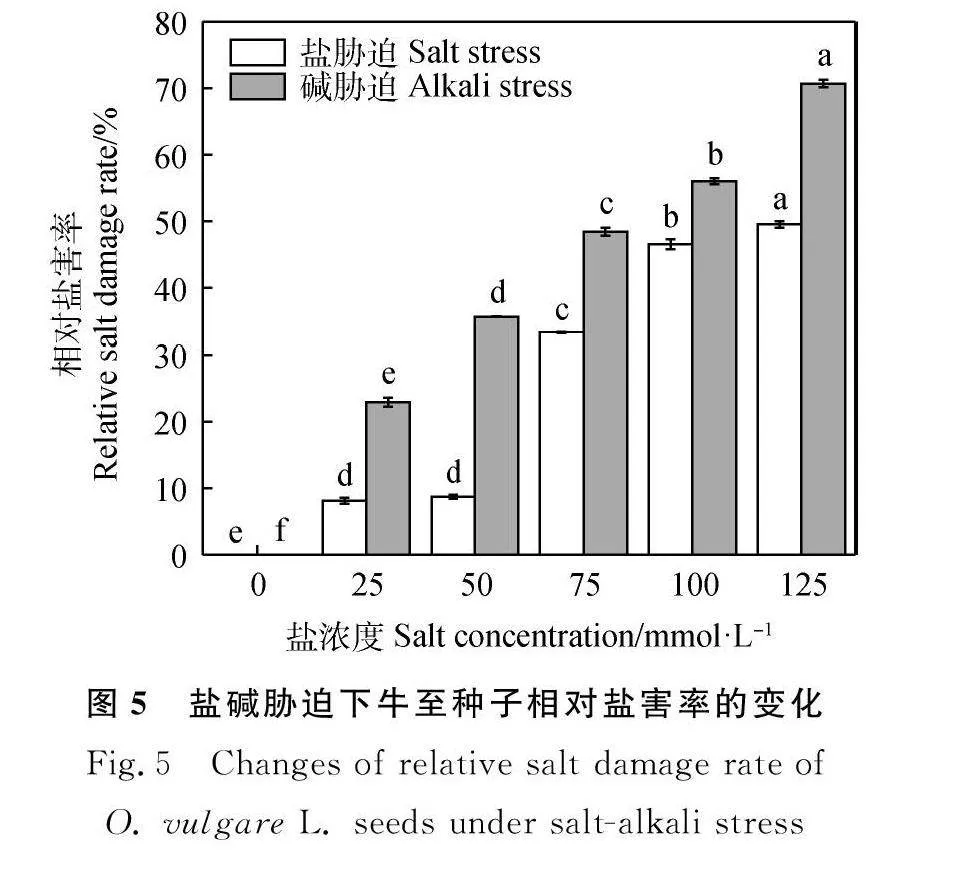
由图5可知,随着盐、碱胁迫浓度增加,相对盐害率逐渐升高。25,50,75,100和125 mmol·L-1的盐、碱胁迫相对盐害率均显著高于对照,且随着浓度增加相对盐害率快速增加,处理间差异达显著水平(Plt;0.05)。在同一浓度下,碱胁迫较盐胁迫对牛至种子的相对盐害率大。在25,50,75,100和125 mmol·L-1浓度的条件下,碱胁迫相比于盐胁迫处理分别升高了14.82%,26.99%,15.13%,9.48%和21.14%。
2.3 盐碱胁迫对牛至幼苗生长的影响
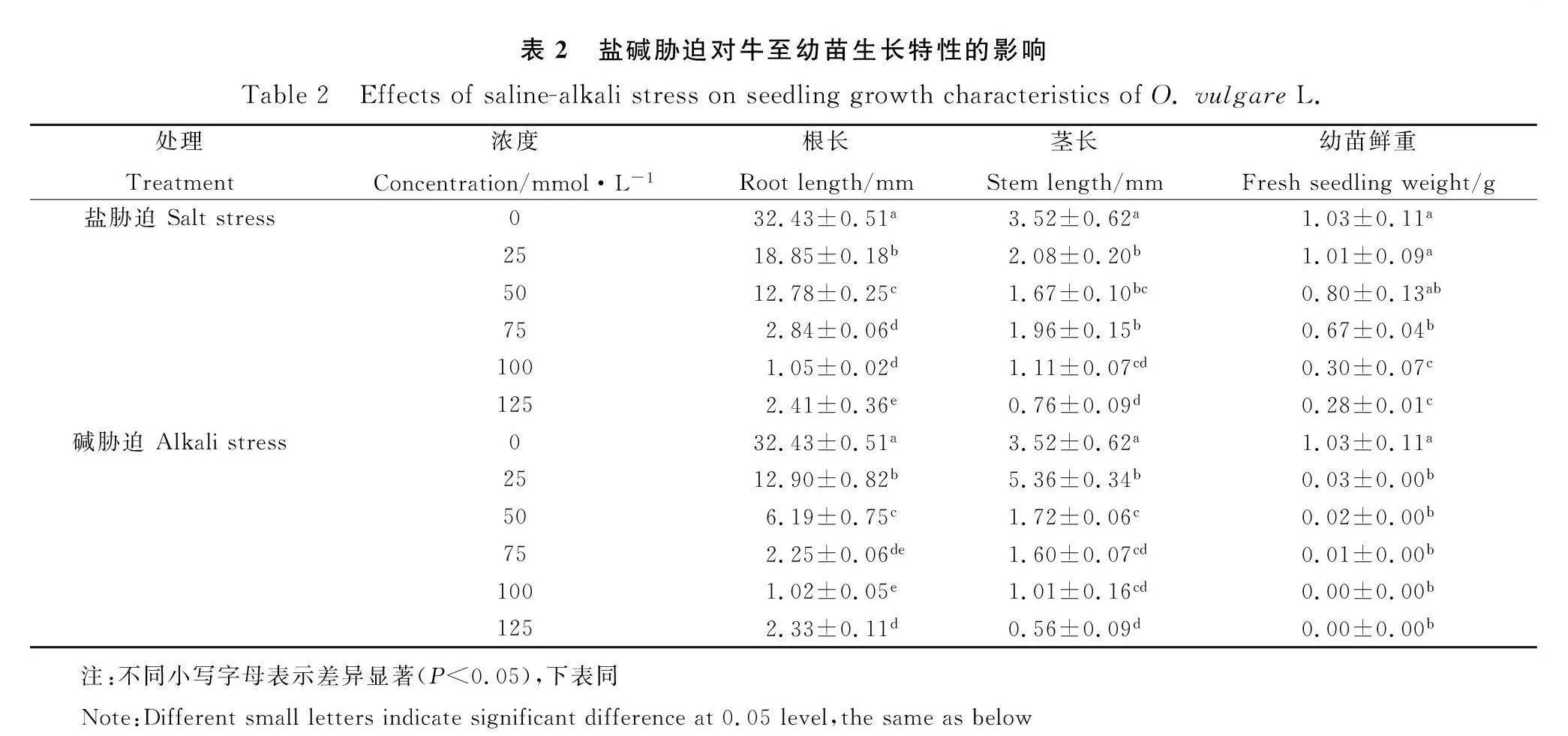
牛至幼苗根长和幼苗鲜重随着盐碱浓度的增大而逐渐变小,当碱浓度增大到一定值时,会直接导致牛至幼苗不生长,表现为致死作用(碱浓度gt;125 mmol·L-1)。由表2可知,25,50,75,100和125 mmol·L-1浓度的条件下,盐碱胁迫牛至根长和茎长均显著低于对照,盐碱胁迫处理间的差异达显著水平(Plt;0.05)。在相同浓度下盐胁迫下的根长和幼苗鲜重均大于碱胁迫。牛至幼苗茎长随着盐碱浓度增加显著降低(Plt;0.05),相同浓度茎长下降幅度较根长下降幅度小。在25 mmol·L-1浓度下,牛至幼苗的根长和幼苗鲜重盐胁迫分别比碱胁迫高5.95 mm和0.98 g;而茎长盐胁迫比碱胁迫低3.28 mm。由此可知,盐碱胁迫抑制牛至幼苗生长,碱胁迫的抑制作用大于盐胁迫。
2.4 盐碱胁迫对牛至幼苗叶片生理指标的影响
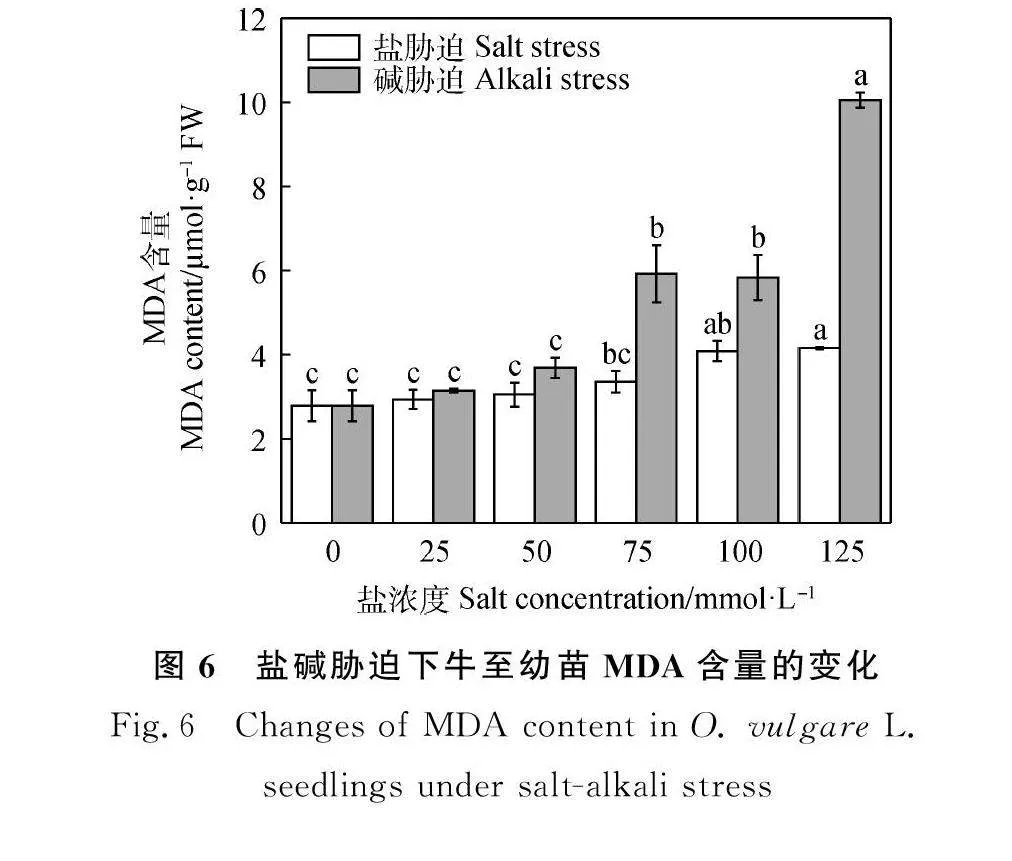
2.4.1 盐碱胁迫对牛至幼苗MDA含量的变化 如图6所示,牛至幼苗叶片MDA含量随着盐碱胁迫浓度的增加逐渐升高。在低浓度盐碱溶液(25和50 mmol·L-1)胁迫下,MDA含量与对照差异不显著。在75,100和125 mmol·L-1浓度下,碱胁迫处理牛至幼苗的MDA含量较盐胁迫分别高2.57,1.75和5.90。当碱溶液浓度为125 mmol·L-1时,MDA含量最大,为10.05 μmol·g-1 FW,该浓度下碱胁迫的MDA含量是盐胁迫的2.42倍。由此说明,相同浓度下,碱溶液比盐溶液对植物造成的伤害更严重。
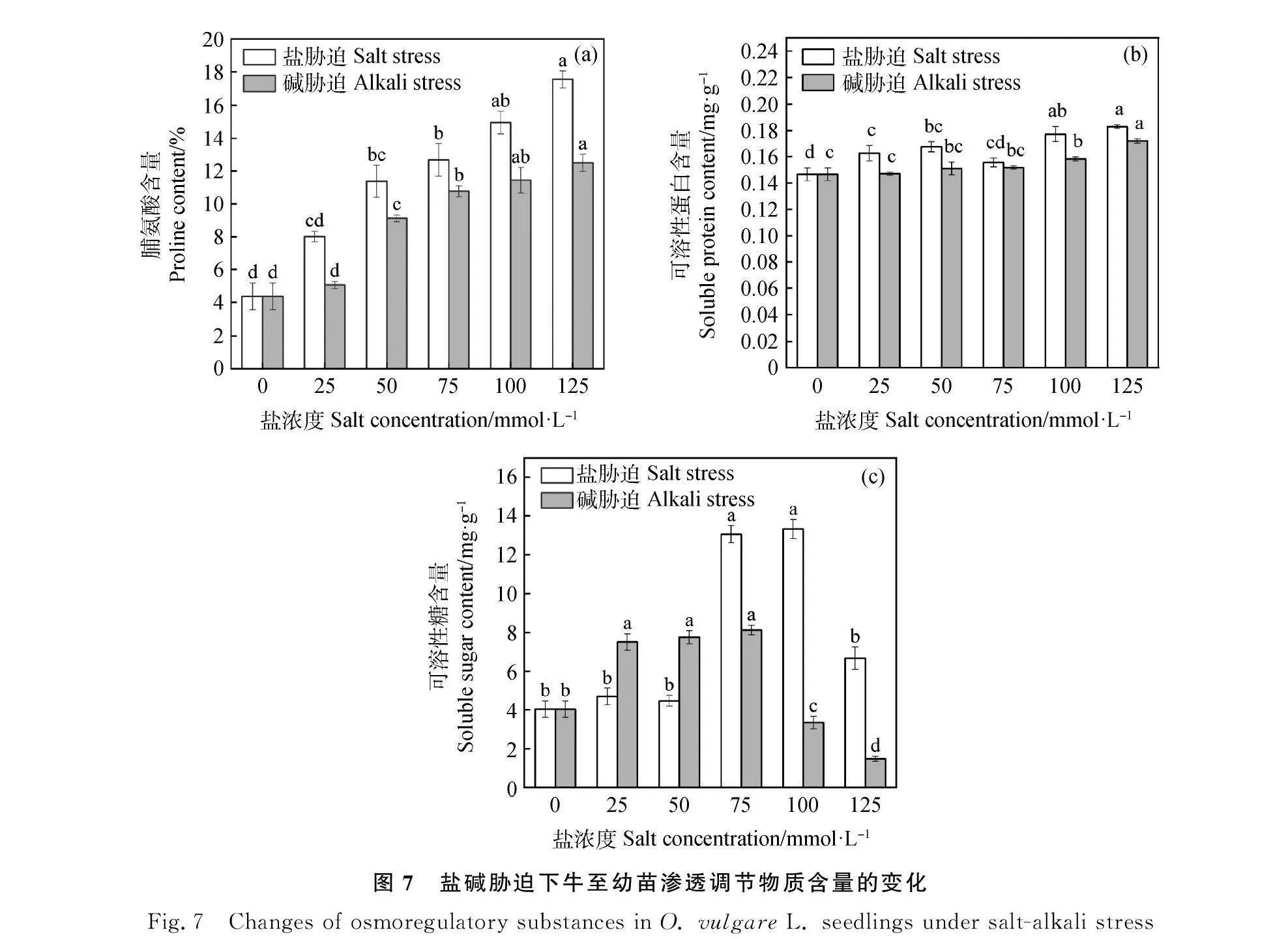
2.4.2 盐碱胁迫对牛至幼苗渗透调节物质含量的影响 由图7可知,随着盐碱胁迫浓度的增加,牛至幼苗脯氨酸和可溶性蛋白含量均逐渐升高,可溶性糖含量呈现先升高后下降的趋势。如图7 (A),当盐、碱浓度为125 mmol·L-1时,脯氨酸的含量达到最大值,均显著高于对照(Plt;0.05),分别是对照的4.02倍和2.86倍。25 mmol·L-1的盐碱胁迫处理脯氨酸含量与对照差异不显著。图7 (B),随着盐浓度的增加,可溶性蛋白呈逐渐升高的趋势,与对照比增幅为11.05%~24.94%,而碱胁迫处理可溶性蛋白含量比对照增加了0.37%~17.37%。图7 (C),盐溶液的浓度在25,50和125 mmol·L-1下,牛至幼苗可溶性糖含量与对照差异不显著,在75和100 mmol·L-1盐胁迫处理牛至幼苗可溶性糖含量分别比对照增加2.24倍和2.3倍(Plt;0.05)。随着碱胁迫浓度增加,可溶性糖的含量呈先上升后下降的趋势,在25,50 和75 mmol·L-1碱胁迫处理可溶性糖的含量显著高于对照和其他处理,处理间差异不显著。由此可知,低浓度的盐碱胁迫牛至幼苗的渗透调节物质含量变化不大,高浓度的盐碱胁迫牛至幼苗渗透调节物质含量升高。
2.4.3 盐碱胁迫对牛至幼苗抗氧化酶活性的影响 由图8可知,随着盐碱胁迫浓度的增加,抗氧化酶活性均呈先升高后下降的趋势。如图8 (a),75 mmol·L-1处理盐碱胁迫处理,SOD的活性最高,显著高于对照和其他盐碱处理(Plt;0.05)。图8(b),随着盐胁迫程度增强,POD的活性呈先增加后降低,在75 mmol·L-1浓度下POD活性最高,显著高于对照和其他盐碱处理(Plt;0.05),其他浓度盐胁迫处理显著高于对照,50,100和25,125 mmol·L-1处理间无显著差异。随着碱胁迫浓度增加POD活性增加,25,50,75和100 mmol·L-1处理与对照间差异不显著。图8(c),随着盐浓度的增加,牛至幼苗CAT活性表现出先升高再降低。在75 mmol·L-1盐浓度下牛至幼苗叶片中CAT活性最高,为1149.42 U·(g·min)-1,显著高于对照(Plt;0.05);在125 mmol·L-1盐溶液浓度下CAT活性最低,为625 U·(g·min)-1,与对照差异不显著。随着碱胁迫浓度的增加,CAT活性大致呈现出先升高后降低的趋势,75 mmol·L-1处理CAT的活性最高,为986.42 U·(g·min)-1,各浓度间与对照的CAT活性差异不显著。
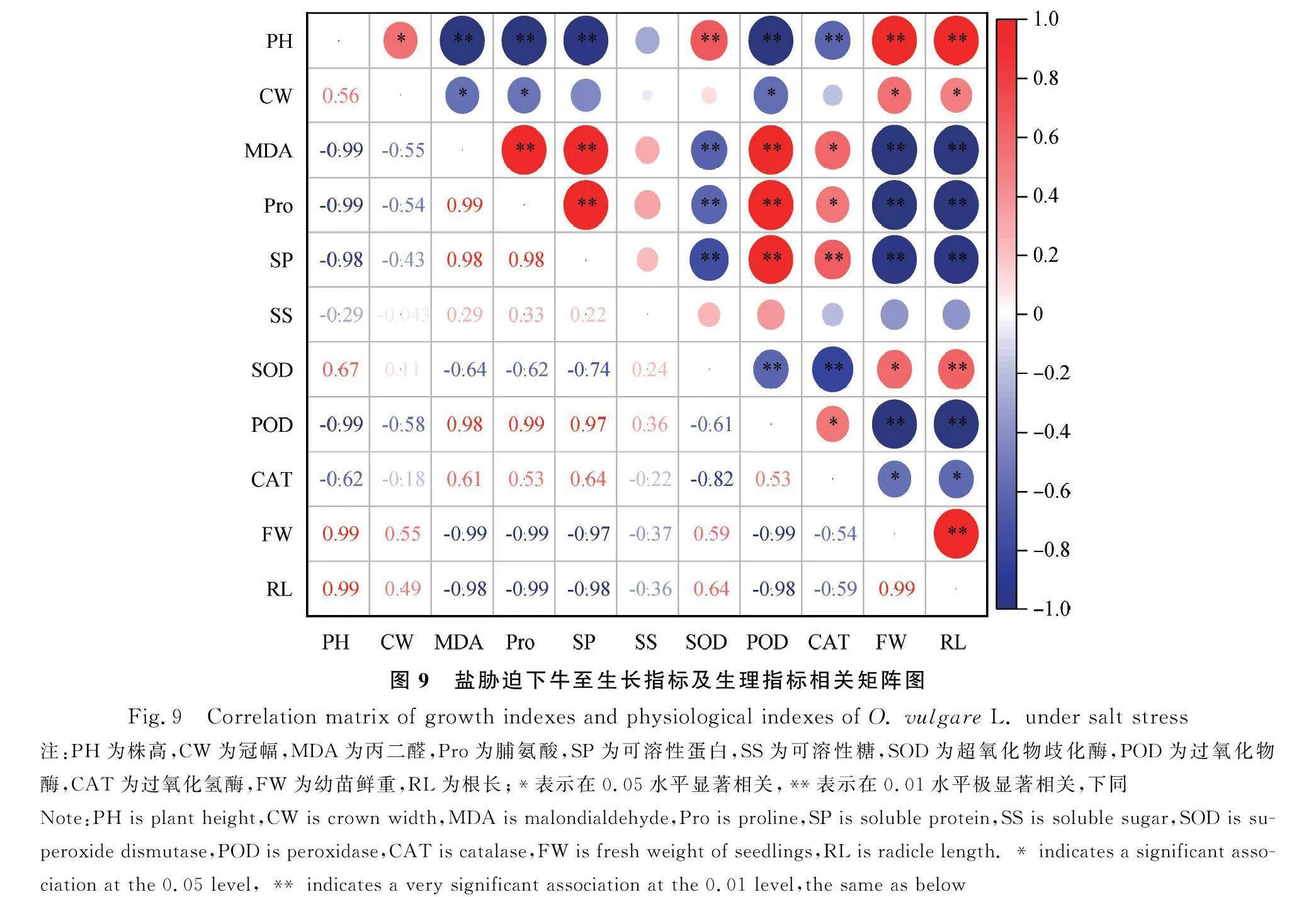
2.5 盐碱胁迫下牛至生长指标及生理指标的相关性分析
2.5.1 盐胁迫下牛至生长指标及生理指标的相关性分析 对牛至株高、冠幅、MDA、渗透调节物质及酶活性等指标进行相关性分析(图9)。株高与MDA、Pro、可溶性蛋白、POD呈极显著负相关(Plt;0.01),相关系数分别为0.99,0.99,0.98,0.99;与CAT呈显著负相关(Plt;0.05),与SOD、相对鲜重、根长呈极显著正相关(Plt;0.01),相关系数分别为0.67,0.99,0.99,与冠幅呈显著正相关(Plt;0.05)。
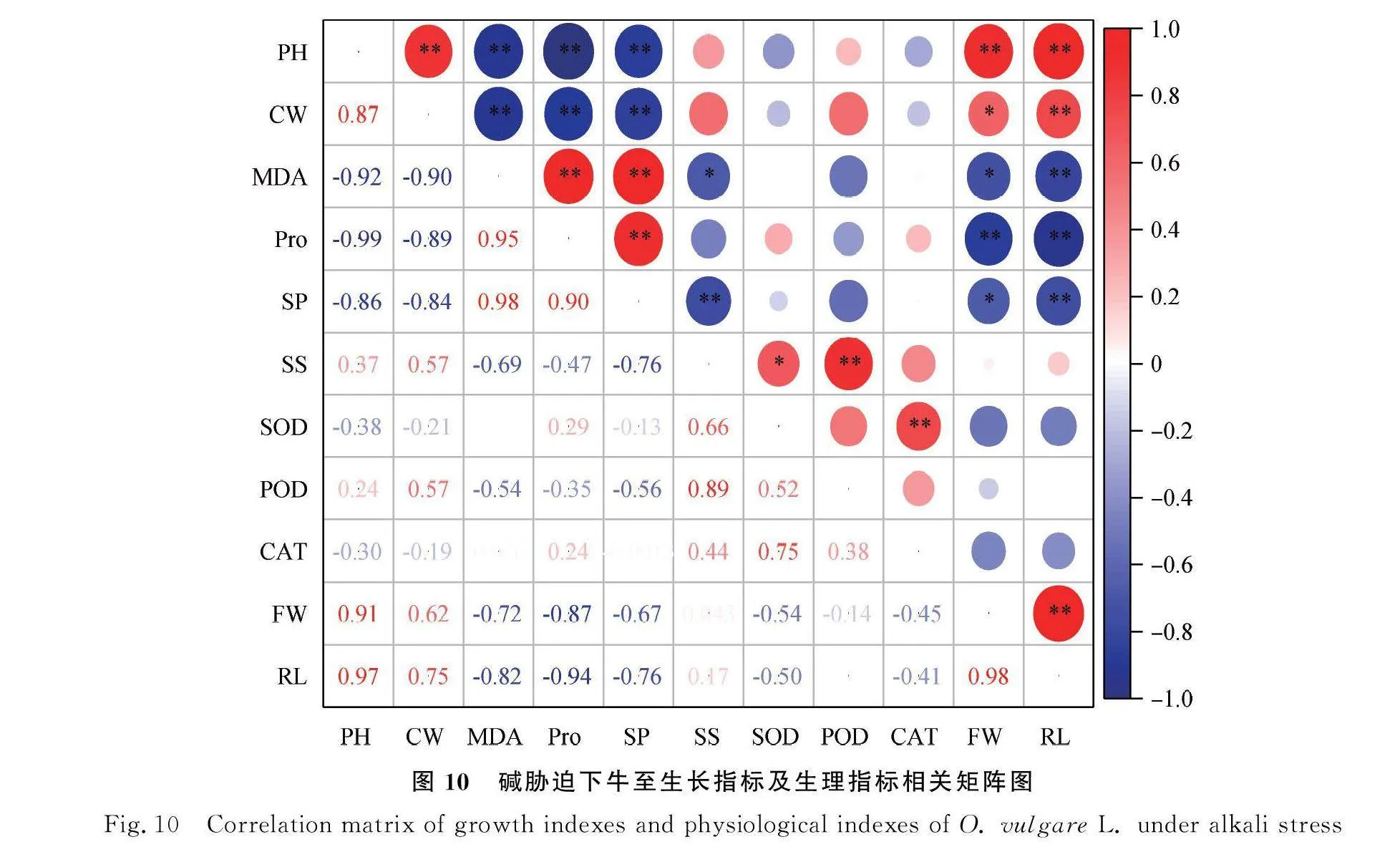
2.5.2 碱胁迫下牛至生长指标及生理指标的相关性分析 对碱胁迫下牛至生长及生理指标进行相关性分析,图10所示,株高与幼苗鲜重、根长呈极显著正相关(Plt;0.01),相关系数分别为0.91,0.97;与MDA,Pro,SP呈极显著负相关(Plt;0.01),相关系数分别为0.92,0.99,0.86。SS与POD呈极显著正相关(Plt;0.01),相关系数为0.89;SOD与CAT呈极显著正相关,相关系数为0.75。
3 讨论
3.1 盐碱胁迫对牛至种子萌发特性的影响
种子的发芽率、发芽势、发芽指数和活力指数是衡量种子质量和活力的重要指标,发芽率、发芽指数越高,表明种子的质量和活力越高,活力指数决定了植株快速、均匀出苗的潜力[22]。牛至种子萌发时间短,但发芽率较低[23]。本研究中,中性盐和碱性盐胁迫对牛至种子发芽势、发芽率、发芽指数、活力指数、相对盐害率均有不同程度的抑制作用。盐碱胁迫对种子萌发的抑制作用主要表现为渗透效应和离子效应[24]。在本试验中,低浓度的盐碱溶液对牛至种子萌发的抑制作用不显著,随着盐碱浓度的升高,抑制作用增强。可能原因一方面是种子处于初始萌发阶段,外界盐分含量的增加致使周围环境的渗透压升高、水势相应降低,产生渗透效应,使胚细胞吸水困难,延迟了种子初始萌发时间[25],另一方面由于离子效应的毒害作用抑制种子的萌发。现有研究发现,在50 mmol·L-1的盐处理下牛至种子的发芽率低于对照,本研究与前人[26]的试验结果一致。本研究中发现,在同一浓度下,碱溶液较盐溶液对牛至种子的相对盐害率大,碱胁迫较盐胁迫对牛至种子的抑制作用更强。这与孙绍营等[27]关于盐碱胁迫对细叶百合种子和郭睿等[28]对油莎豆种子萌发的研究结果一致。
3.2 盐碱胁迫对牛至幼苗MDA及渗透调节物质的影响
MDA是由活性氧水平过高引起的,是脂质过氧化的最终产物,大量积累会严重损伤生物膜,它与酶活性和活性氧密切相关[29]。MDA含量可以反映植物受到胁迫的程度,从而间接评价植物抗逆境的能力。本研究发现,盐碱胁迫下,随着浓度的升高,MDA的含量均上升,且碱胁迫的上升幅度大于盐胁迫,说明碱胁迫对牛至幼苗细胞膜的伤害程度大于盐胁迫,与前人的研究结果一致[30-32]。脯氨酸、可溶性蛋白和可溶性糖是植物生理代谢中重要的渗透调节物质,当植物受到逆境时,自身可通过合成一些渗透调节物质来调节渗透平衡,保护细胞结构抵御逆境胁迫[33]。许多研究表明,碱胁迫比盐胁迫更严重,且具有更大的生态破坏力[34]。本试验中,随着盐、碱胁迫浓度的增加,脯氨酸和可溶性蛋白的含量升高,可溶性糖的含量先升高后降低。说明在牛至在遭受盐碱胁迫时,可通过积累脯氨酸、可溶性蛋白和可溶性糖的合成等途径来调节细胞渗透势,从而保护细胞的结构和功能,这与现有在研究盐碱胁迫对番茄幼苗的影响中发现渗透调节物质脯氨酸、可溶性糖含量升高,可溶性蛋白的含量先升高后降低的结果不同[35]。可能是因为低浓度的盐碱胁迫主要通过增加可溶性糖含量来平衡渗透压,高浓度盐碱胁迫抑制牛至幼苗物质代谢,可溶性糖含量降低,牛至幼苗通过增加游离脯氨酸和可溶性蛋白含量来缓解渗透胁迫对其生长的抑制作用。
3.3 盐碱胁迫对牛至幼苗抗氧化酶的影响
在盐碱胁迫下,植物会诱导产生大量的活性氧,活性氧过量会导致氧化应激,从而破坏细胞膜并导致细胞损伤和死亡[26]。SOD,POD,CAT是控制植物体内活性氧积累最重要的酶,三者相互协同,能够增强植物在逆境胁迫下的忍耐能力,是反映植物抗逆性大小的重要指标[34]。本试验中牛至幼苗SOD,POD,CAT活性随着盐、碱浓度的升高先升高后降低,在低浓度时植物体内活性氧含量逐渐升高,清除活性物质的酶活性也相应升高,随着盐碱浓度的增加,植物体内活性氧的含量达到一定的程度后,损坏植物细胞,导致无法产生更多的抗氧化酶,因此抗氧化酶活性呈现出下降的趋势。李晓荣等人[36]在盐碱胁迫下发现植物体内ROS积累,SOD,POD,CAT活性先增强后降低,李哲等人[37]研究发现椒盐薄荷幼苗在一定的盐胁迫下,植株可提高抗氧化酶活性来缓解胁迫引起的氧化损伤,随着盐浓度的提高,抗氧化酶活性升高后降低,与本研究结果一致。
4 结论
牛至种子在萌发过程中对盐胁迫具有一定的耐受性,种子在25,50 mmol·L-1盐胁迫下可以正常萌发,但在高浓度的盐胁迫下牛至种子萌发和幼苗生长受到抑制。碱性胁迫抑制牛至种子萌发和幼苗生长,高浓度碱胁迫对牛至抑制作用大于盐胁迫。因此,牛至具有一定的耐盐碱能力,低浓度的盐碱胁迫(盐浓度lt;50 mmol·L-1、碱浓度lt;25 mmol·L-1)牛至种子可以正常萌发生长,高浓度的盐碱胁迫抑制牛至种子萌发和幼苗生长。
参考文献
[1] 赵秀芳,谢志远,张涛,等. 我国盐碱地修复技术的现状与特点[J]. 环境卫生工程,2017,25(2):94-96
[2] 胡一,韩霁昌,张扬. 盐碱地改良技术研究综述[J]. 陕西农业科学,2015,61(2):67-71
[3] 吴振振,张旭龙,马淼. 栽培甘草对盐碱地土壤理化性质及微生物功能多样性的影响[J]. 农学学报,2016,6(7):24-29
[4] 石德成,殷立娟. 盐(NaCl)与碱(Na2CO3)对星星草胁迫作用的差异[J]. Journal of Integrative Plant Biology,1993,35(2):144-149
[5] 刘杰,张美丽,张义,等. 人工模拟盐、碱环境对向日葵种子萌发及幼苗生长的影响[J]. 作物学报,2008(10):1818-1825
[6] 王东东,沙拉买提·艾力,徐海燕,等. 维吾尔族药牛至药材质量标准[J]. 中国实验方剂学杂志,2015,21(16):32-35
[7] SUNTRES Z,COCCIMIGLIO J,ALIPOUR M. The bioactivity and toxicological actions of carvacrol[J]. Critical Reviews in Food Science and Nutrition,2015,55(3):304-318
[8] MARTUCCI J F,GENDE L B,NEIR L M,et al. Oregano and lavender essential oils as antioxidant and antimicrobial additives of biogenic gelatin films[J]. Industrial Crops and Products,2015(71):205-213
[9] 虎陈霞,傅伯杰,陈利顶. 浅析退耕还林还草对黄土丘陵沟壑区农业与农村经济发展的影响——以安塞县为例[J]. 干旱区资源与环境,2006(4):67-72
[10]李玉梅,姜云天,曲广男. 盐胁迫对东北藿香种子萌发的影响[J]. 中药材,2019,42(11):2491-2496
[11]管志勇,陈发棣,陈素梅,等. NaCl胁迫对菊花花序形态及生理指标的影响[J]. 西北植物学报,2009,29(8):1624-1629
[12]KACHUR K,SUNTRES Z. The antibacterial properties of phenolic isomers,carvacrol and thymol[J]. Critical Reviews in Food Science and Nutrition,2019,60(18):3042-3053
[13]齐琪,马书荣,徐维东. 盐胁迫对植物生长的影响及耐盐生理机制研究进展[J]. 分子植物育种,2020,18(8):2741-2746
[14]CAO Y S,JIN F,ZHU L Y,et al. Antimicrobial mechanism of plant essential oils and its active ingredients[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(1):376-388
[15]刘艳,黄红燕,李金荣,等. 天然植物“抗生素”牛至资源及繁育研究进展[J]. 中国野生植物资源,2020,39(9):51-56
[16]贾秀峰. 苏打盐碱胁迫对两种苜蓿种子萌发影响及品种耐性综合分析[J]. 草地学报,2019,27(6):1511-1517
[17]黄勇,郭猛,张红瑞,等. 盐胁迫对石竹种子萌发和幼苗生长的影响[J]. 草业学报,2020,29(12):105-111
[18]李天永,严子柱,姜生秀. 两种独行菜种子萌发对不同浓度NaCl胁迫的响应[J]. 草地学报,2021,29(1):88-94
[19]李双男,郭慧娟,王晶,等. 不同盐碱胁迫对棉花种子萌发的影响[J]. 种子,2018,37(1):38-45
[20]李安辉,吕泽良,韩忠明,等. 不同碱性盐处理对防风种子萌发、幼苗生长及其生理特性的影响[J]. 中药材,2023(8):1870-1875
[21]王学奎. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2006:167-280
[22]孙昌高,方坚,徐秀瑛. 唇形科药用植物种子发芽的研究[J]. 中国现代应用药学,2001(4):276-279
[23]陆玉建,高春明,郑香峰,等. 盐胁迫对拟南芥种子萌发的影响[J]. 湖北农业科学,2012,51(22):5099-5104
[24]高暝,李毅,种培芳,等. 渗透胁迫下不同地理种源白刺的生理响应[J]. 草业学报,2011,20(3):99-107
[25]LIOPA-TSAKALIDI A,ZAKYNTHINOS G,VARZAKAS T,et al. Effect of NaCl and GA3 on Germination and Seedling Growth of eleven medicinal and aromatic crops[J]. Journal of Medicinal Plant Research,2011,5(17):4065-4073
[26]孙绍营,王健鸿,王静文,等. 盐碱胁迫对细叶百合种子萌发和幼苗生长的影响[J]. 江苏农业科学,2022,50(24):106-112
[27]郭睿,郭晨荔,唐榕,等. 盐碱胁迫对油莎豆种子萌发的影响[J]. 新疆农垦科技,2021,44(6):54-57
[28]LIANG X,FANG S,JI W,et al. The positive effects of silicon on rice seedlings under saline-alkali mixed stress[J]. Communications in Soil Science and Plant Analysis,2015,46(17):2127-2138
[29]巩志勇,辛建华,商小雨,等. 盐碱胁迫下香椿幼苗光合及抗逆生理特性[J]. 西北植物学报,2021,41(7):1199-1209
[30]唐榕,梁培鑫,郭晨荔,等. 盐碱胁迫对油莎豆幼苗生长和生理性状的影响[J]. 浙江农业科学,2022,63(3):528-533
[31]于爽,高剑,杨新宇,等. 盐碱胁迫对龙葵种子萌发及幼苗生长的影响[J]. 江苏农业科学,2019,47(17):162-165
[32]钱玥,李思源,饶良懿. 盐碱胁迫对菊芋渗透调节及抗氧化酶系统的影响[J]. 干旱区研究,2023,40(9):1465-1471
[33]LI R,SHI F,FUKUDA K. Interactive effects of salt and alkali stresses on seed germination,germination recovery,and seedling growth of a halophyte Spartina alterniflora (Poaceae)[J]. South African Journal of Botany,2010,76(2):380-387
[34]WANG P,ABC ZJX,ZHANG Y,et al. Over-expression of spermidine synthase 2 (SlSPDS2) in tomato plants improves saline-alkali stress tolerance by increasing endogenous polyamines content to regulate antioxidant enzyme system and ionic homeostasis[J]. Plant Physiology and Biochemistry,2022(192):172-185
[35]MITTLER R,VANDERAUWERA S,GOLLERY M,et al. Reactive oxygen gene network of Plants[J]. Trends in Plant Science,2004,9(10):490-498
[36]李晓荣,姚世响,陈莎莎,等. 藜异型性种子后代植株盐响应生理机制[J]. 生态学报,2015,35(24):8139-8147
[37]李哲,吴晓青,魏艳丽,等. NaCl胁迫对椒样薄荷生长及抗氧化系统的影响[J]. 广东农业科学,2014,41(3):46-51
(责任编辑 刘婷婷)

