MRI对2型糖尿病胰腺变化的研究价值

[摘要] 目的:采用MRI多序列扫描,前瞻性研究2型糖尿病(T2DM)胰腺脂肪含量、胰腺体积(胰体比)和胰腺形态的变化,综合评估各影像指标与T2DM的相关性,总结T2DM胰腺变化的主要特征。方法:招募50例T2DM患者(T2DM组)和50例非糖尿病志愿者(对照组),均行上腹部MRI检查。测量并比较胰体比、胰腺脂肪含量及胰腺边缘形态分级。结果:T2DM组胰体比[(36.38±9.62)cm3/m2]小于对照组[(46.94±8.67)cm3/m2],差异有统计学意义(Plt;0.001);T2DM组胰腺脂肪含量[(6.17±2.89)%]大于对照组[(3.64±3.47)%],差异有统计学意义(Plt;0.05);T2DM组胰腺边缘形态分级(1.80±1.03)高于对照组(1.26±0.99),差异无统计学意义(P=0.440)。结论:T2DM患者主要表现为脂肪含量增加和胰腺体积缩小。MRI多序列扫描能精准评估T2DM患者的胰腺脂肪含量和胰腺体积的改变。
[关键词] 2型糖尿病;磁共振成像;胰腺;体积;脂肪
Value of MRI in study of pancreatic changes in type 2 diabetes mellitu
YUAN Yongfeng1,WANG Zhongqiu1,YANG Meng2,ZENG Liang1,GAO Xifa1,WU Huiming1
1Department of Radiology,Affiliated Hospital of Nanjing University of Traditional Chinese Medicine,Nanjing 210029,China;2Department of Radiology,Nanjing Drum Tower Hospital,Affiliated Hospital of Medical School,Nanjing University,Nanjing 210008,China
[Abstract] Objective:To explore the changes of pancreatic fat content,pancreatic volume and pancreatic morphology in patients with type 2 diabetes mellitus (T2DM) by using MRI multi-sequence scan. To comprehensively evaluate the correlation between various imaging indexes and T2DM,and summarize the main characteristics of pancreatic changes in T2DM. Methods:50 T2DM patients and 50 non-diabetic volunteers were recruited for upper abdominal MRI. The ratio of pancreatic volume to body surface area,pancreatic fat content and the morphological grading of pancreatic margin were measured. Results:The ratio of pancreatic volume to body surface area in T2DM group was (36.38±9.62)cm3/m2,which was statistically lower than that in the control group of (46.94±8.67)cm3/m2 (Plt;0.001). The pancreatic fat content in T2DM group was (6.17±2.89)%,which was statistically higher than that in the control group of (3.64±3.47)% (Plt;0.05). The morphological grading of pancreatic margin in T2DM group was (1.80±1.03),which was statistically higher than that in the control group of (1.26±0.99)(P=0.440). Conclusions:T2DM patients have an increase in pancreatic fat content and a decrease in pancreatic volume. MRI multi-sequence scan can provide accurate evaluation for the changes of pancreatic fat content and volume.
[Key words] Type 2 diabetes mellitus;Magnetic resonance imaging;Pancreatic;Volume;Fat
DOI:10.3969/j.issn.1672-0512.2024.04.013
[基金项目] 国家自然科学基金项目(82171925);江苏省教育教学“十四五”规划2021年度高教重点课题(B/2021/01/44);江苏省中医院创新发展基金专项课题(Y2020CX08)。
[通信作者] 王中秋,Emial:zhq2001us@163.com。
2型糖尿病(T2DM)是糖尿病的主要类型(90%~95%),预计到2030年,全球糖尿病患者将达6.43亿,每年因其死亡约500万人[1]。T2DM增加了心血管疾病、神经病变、肾病和视网膜病变等的风险,给患者及其家庭造成了巨大的经济负担。识别出高危人群并引导其改变生活方式,可预防或推迟T2DM的发病[2]。因此,糖尿病的早期诊断并及时治疗尤为重要。
85%的T2DM患者是由胰岛β细胞无法补偿外周组织中的胰岛素抵抗所引起[3],因此胰腺变化是T2DM发病的重要环节。本研究旨在探讨MRI多序列扫描对T2DM患者胰腺变化的研究价值。
1" 资料与方法
1.1" 一般资料
2021年3月至2022年10月南京中医药大学附属医院招募50例T2DM患者(T2DM组)和50例非糖尿病志愿者(对照组)。2组男女比例均为1∶1。采集2组性别、年龄、体质量、身高、腰围、糖尿病病史、糖尿病家族史、吸烟、酗酒等信息。T2DM的诊断按照WHO(1999)分类标准[4]:在直系亲属中有1人患糖尿病,则为有糖尿病家族史;平均每天吸烟gt;10支为吸烟;平均每日饮酒量gt;50 g或周饮酒量gt;400 g为酗酒。本研究经医院伦理委员会批准,患者均同意并签署知情同意书。
1.2" 纳入及排除标准
纳入标准:①年龄20~75岁;②无胰腺疾病及相关病症;③血尿脂肪酶、淀粉酶等相关生化指标无异常;④胰腺形态正常,无胰腺水肿及周围脂肪间隙积液征象;⑤无恶性肿瘤病史。
排除标准:①长期卧床患者;②哺乳期及怀孕期妇女;③有胰腺手术史;④近6个月新发严重脑梗死、心肌梗死者;⑤有MRI检查禁忌证不适合检查的患者。
1.3" 仪器与方法
采用GE Architect 3.0 T MRI扫描仪,体线圈和16通道相控阵腹部线圈。患者取仰卧位,双手上举,足先进,均匀一致呼吸。采用平静呼气后屏气扫描。扫描范围:从膈肌上缘至胰头下缘,包括全部胰腺组织。扫描序列与参数:T1WI采用水脂分离容积加速采集三维肝脏加速容积采集(3D liver acquisition with volume acceleration,3D LAVA)同反相位序列,层厚3 mm,无间隔,矩阵320×320,平均次数1,最短TR,最短TE;T2WI采用快速自旋回波螺旋桨采集(FSE propeller)序列,层厚4 mm,层距1 mm,矩阵320×320,平均次数2,自动TR,TE 60 ms;多回波迭代水脂不对称回波分解与最小二乘估计(iterative decomposition of water and fat with echo asymmetry and least squares estimation quantification sequence,IDEAL IQ)采用3点法多回波水脂分离序列,层厚4 mm,无间隔,矩阵320×320,平均次数1,最短TR,最短TE。
1.4" 图像分析与参数测量
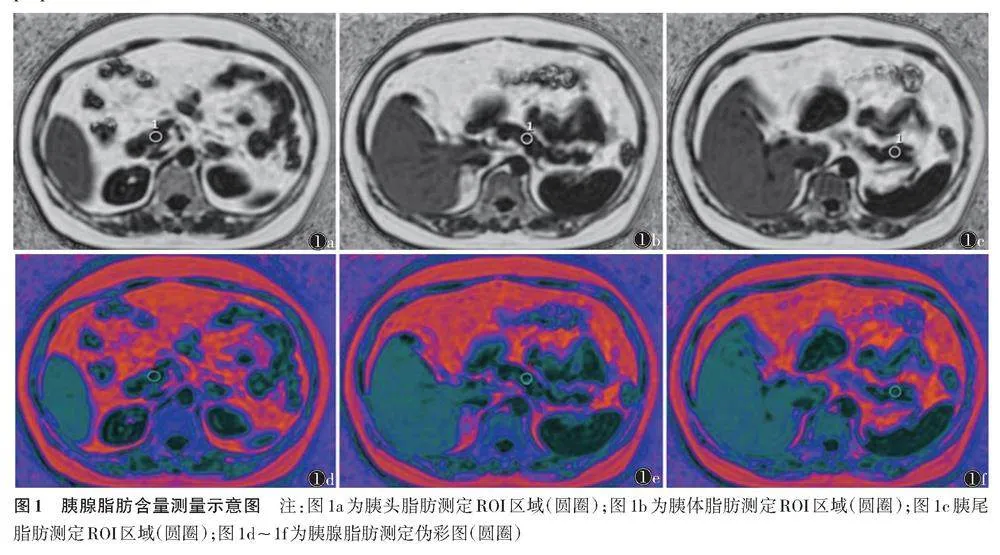
将图像传至GE AW4.7工作站行后处理。由2位具有5年以上工作经验的影像医师采用双盲法对图像行独立分析评估,最后汇总取平均值。T2WI序列用于观察胰腺整体信号,排除占位性病变及胰腺炎等。在3D LAVA序列的水相图上沿胰腺边缘勾画得到面积值,将所有层面融合成3D胰腺图像自动得到胰腺的体积值,勾画时避开门静脉、脾动脉、脾静脉等血管。在IDEAL IQ序列的脂肪分数图上勾画ROI,大小0.5~1.0 cm2,以胰腺实体部分为主,避开血管、扩张胰管及胰腺边缘脂肪浸润部位,分别测量胰头部、胰体部及胰尾部的脂肪含量(图1)。
采用5级(0~4级)半定量不规则量表,在3D LAVA序列水相图上根据胰腺边缘形态及锯齿状结构对胰腺形态进行评级。评级标准:0级,胰腺饱满,边缘光整,无明显锯齿状结构;1级,胰腺边缘较光整,锯齿状结构1~3个;2级,胰腺边缘不整,锯齿状结构4~6个;3级,胰腺边缘毛糙,脂肪浸润明显,锯齿状结构7~10个;4级,胰腺各部分脂肪浸润严重,锯齿状结构gt;10个。测量肝左内叶、肝右外叶和肝右后叶的脂肪含量,ROI大小1.0~2.0 cm2。胰腺脂肪含量和肝脏脂肪含量分别取所测脏器所有ROI的平均值。
计算男女体表面积(S):S男(m2)=0.005 7×身高(cm)+0.012 1×体质量(kg)+0.088 2;S女(m2)=0.007 3×身高(cm)+0.012 7×体质量(kg)-0.210 6。单位体表面积的胰腺体积用胰体比表示:胰体比(cm3/m2)=胰腺体积(cm3)/体表面积(m2)。
1.5" 统计学方法
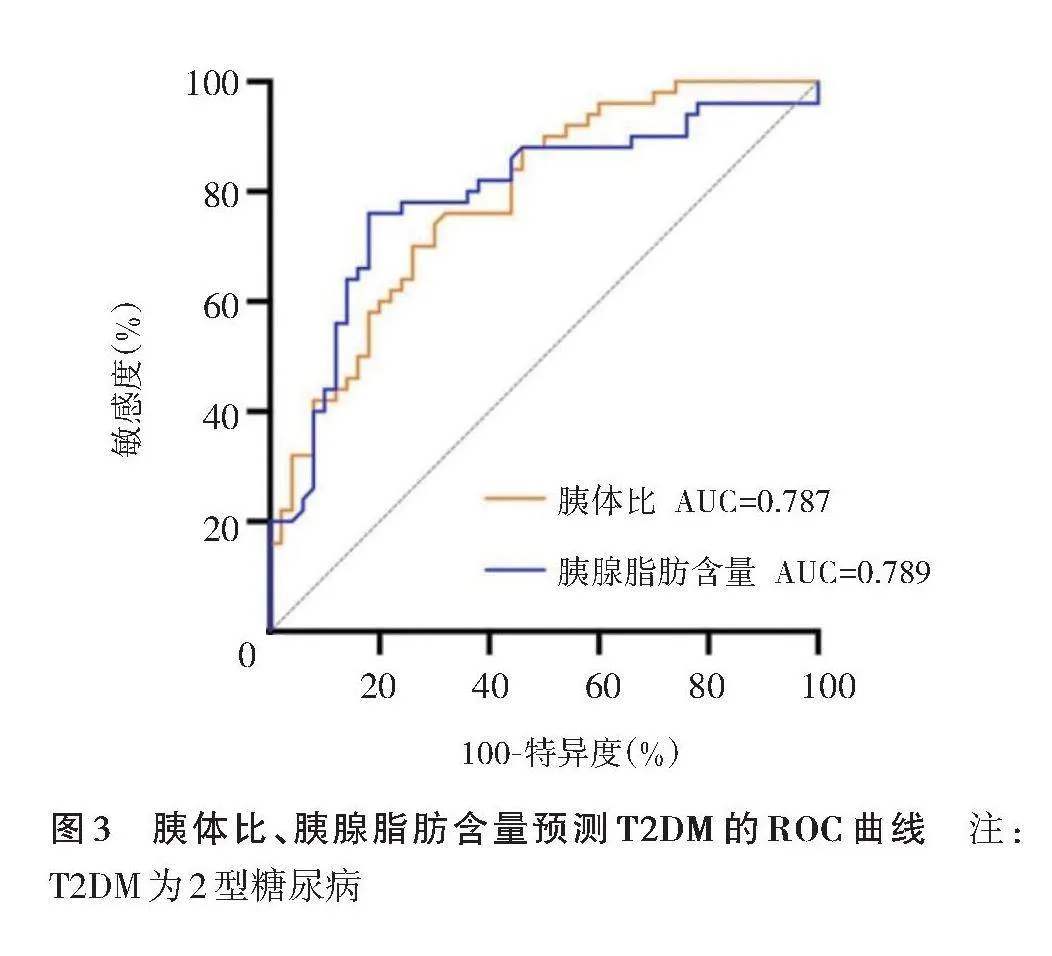
使用SPSS 24.0软件行数据分析。计量资料以x±s表示;2组间年龄、BMI比较行独立样本t检验。采用二元logistic回归模型确定胰腺脂肪含量、胰体比、胰腺边缘形态分级等指标与T2DM的关系。绘制ROC曲线,比较胰体比和胰腺脂肪含量对T2DM的诊断效能。以Plt;0.05为差异有统计学意义。
2" 结果
2.1" 2组一般资料比较
T2DM组50例,男女各25例;年龄22~70岁;平均(49.5±8.8)岁;BMI为(25.5±3.5)kg/m2;糖尿病病程6个月至20年,平均(6.89±5.57)年。对照组50例,男女各25例;年龄23~74岁,平均(48.3±12.5)岁;BMI为(24.4±3.7)kg/m2。
T2DM组与对照组的年龄差异及BMI差异均无统计学意义(t=-0.545,P=0.587;t=-1.576,P=0.118)。
2.2" 2组各指标与T2DM关系比较
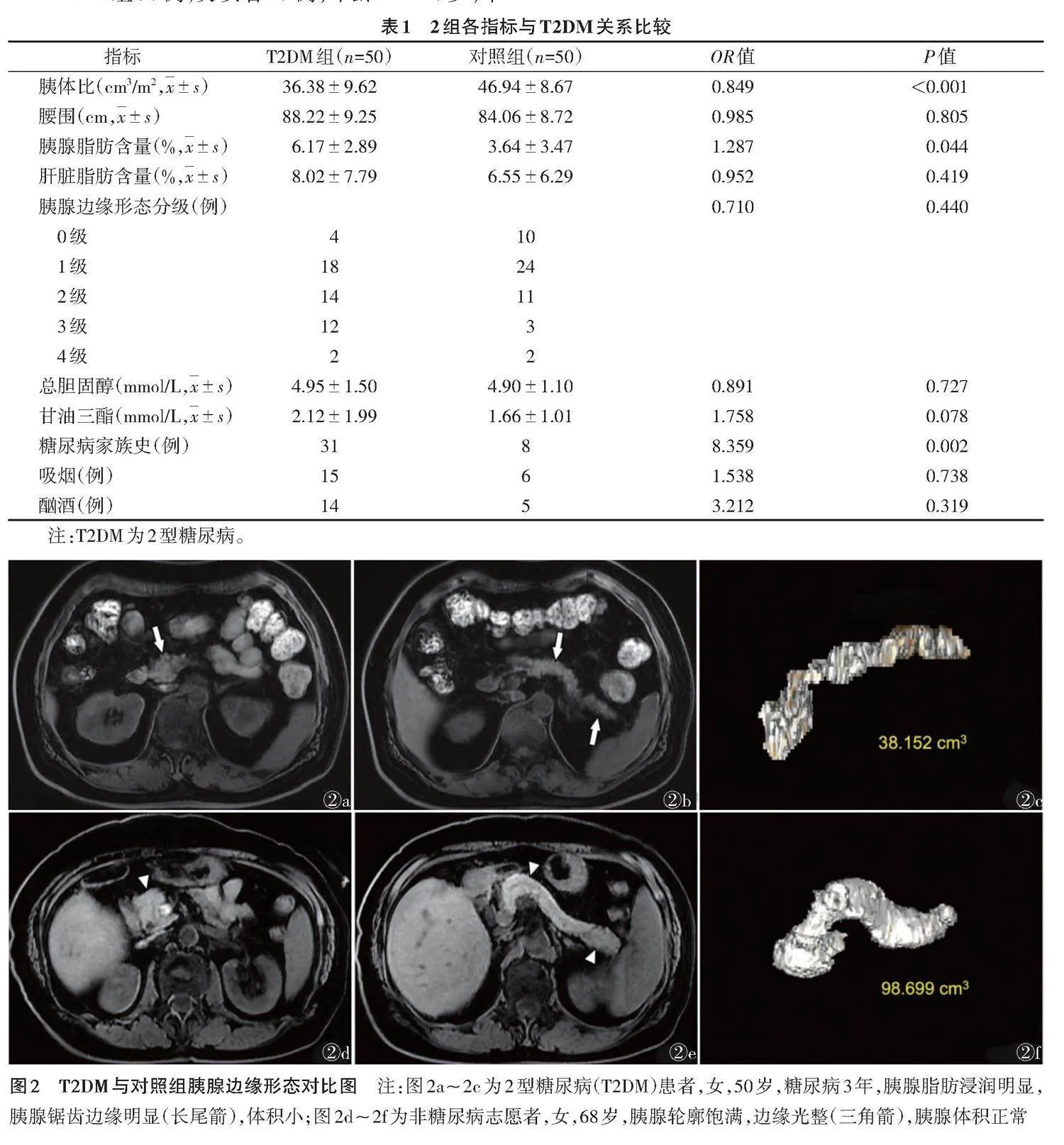
logistic回归分析显示,与对照组相比,T2DM组胰体更小,胰腺脂肪含量更高,且有明显的糖尿病家族史,差异均有统计学意义(均Plt;0.05)(表1,图2)。
2.3" ROC曲线分析
ROC曲线示,胰体比和胰腺脂肪含量鉴别T2DM的AUC接近(AUC=0.787,0.789),敏感度和特异度均较高(表2,图3)。
3" 讨论
胰腺与糖尿病的发病机制密切相关,且胰腺大小、形态、脂肪含量与年龄[5]、肥胖[6-7]及性别[8]等因素相关。因此,在胰腺影像研究中,充分考虑相关因素的影响,可准确描述胰腺的变化特点。
本研究对T2DM组与对照组的胰腺脂肪含量、胰腺体积、肝脏脂肪含量、胰腺边缘形态分级及生化指标比较,发现T2DM患者的胰腺脂肪含量明显升高,胰腺体积明显下降,且与糖尿病家族史密切相关。
3.1" 胰腺脂肪
胰腺脂肪沉积导致胰腺脂肪含量增高,而胰腺脂肪含量的变化是研究胰腺功能状态的切入点。目前对于胰腺脂肪增加与T2DM的相关机制尚不清楚。胰腺脂肪是否是导致β细胞功能障碍和T2DM的驱动因素,相关研究[9]结论并不一致。Patel等[10]研究发现,稳态模型胰岛素抵抗指数(HOMA-IR)与胰腺内脂肪总含量呈正相关,HOMA-IR高者较胰岛素敏感者的胰腺内脂肪更多。Nadarajah等[2]报道,T2DM组与对照组相比,胰头、胰体、胰尾脂肪含量差异均有统计学意义。然而,Skudder-Hill等[11]研究发现,区域性胰腺内脂肪差异无统计学意义,表明区域性胰腺内脂肪沉积与糖尿病之间相关性较小。导致上述研究结论不一致的因素主要有:胰腺的脂肪含量呈动态变化,会因年龄、性别、BMI及脂肪浸润不均匀而导致测量结果偏移;不同的检查方法对胰腺脂肪含量测量的准确度也不同。与超声波和CT相比,MRI测量胰腺脂肪含量的精确度较两者更具优势。本研究发现,通过测量胰头、胰体、胰尾脂肪含量均值能客观反映胰腺脂肪浸润的整体情况,另外,GE Architect MRI扫描仪多点法IDEAL IQ技术能更准确地测量胰腺脂肪含量,证实胰腺脂肪含量增加与T2DM密切相关。研究发现,空腹高血糖仅出现在大多数β细胞被破坏后,表明血液检测结果是β细胞丧失的滞后指标[12]。本研究与大多数相关研究结果一致,支持胰腺脂肪增加会引起β细胞功能丧失、增加T2DM患病风险的结论。
3.2" 胰腺体积
胰腺位于腹膜后深处,形态不规则,临床精准识别和测量胰腺体积较困难[13]。本研究采用3D LAVA水脂分离序列,在脂肪抑制水相图上测量体积。三维扫描序列空间分辨力高,同时采用短TR、短TE的脂肪抑制参数,能清晰显示胰腺边缘,提高胰腺体积测量的精确度。有研究证明,使用MRI测量胰腺体积准确度、可重复性和再现性均较高[14]。此外,在快速连续接受MRI扫描的受试者中,胰腺体积的测量同样具有高度可重复性[15]。
胰腺体积的个体差异很大,且随年龄变化而不同。一项对191例胰腺MRI图像分析显示,胰腺体积在30~39岁达高峰,此后逐渐萎缩,60岁后萎缩加剧[5]。胰腺体积也存在性别差异,男性多大于女性。胰腺体积与体质量相关,因此,以胰腺体积与体表面积的比值(胰体比)表述胰腺体积更客观。目前尚无可靠的方法来量化活体内人胰岛β细胞的质量,阻碍了临床医师对糖尿病或胰岛移植后胰岛β细胞的准确了解[3]。通常认为胰腺体积越大胰腺分泌潜能就越强,以此可间接反映胰岛β细胞质量。本研究发现胰腺体积与T2DM密切相关,T2DM组的胰腺体积明显小于非糖尿病组,与大多数研究结论一致。
3.3" 胰腺形态
正常胰腺信号均匀,边缘光整,但胰腺形态并非一成不变,会随年龄增长及导致脂肪浸润的病程发展而出现信号不均匀,边缘出现更多锯齿状结构。Al-Mrabeh等[16]研究发现,T2DM患者的胰腺形态更不规则,提示胰腺形态改变可能与糖尿病状态有关。胰腺边缘结构分级通常采用半定量评级[17-18]和分形维度定量评分[19]。本研究采用半定量不规则量表根据胰腺边缘锯齿状结构数对胰腺形态评级,发现胰腺形态与T2DM无相关性,但T2DM组胰腺浸润程度及胰腺边缘锯齿状结构多于对照组。究其原因主要是随年龄增长,胰腺锯齿状变化个体差异很大,但本研究样本量较小,不足以反映出其差异是否有统计学意义;另外,胰腺形态评级属主观评价,观察者之间存在偏差,需进一步规范形态标准并给予评估医师更多的培训。
本研究显示,T2DM与糖尿病家族史关系密切,与以往研究一致;T2DM组与对照组的肝脏脂肪含量接近,差异无统计学意义。Krishan[20]报道糖尿病患者的肝脏脂肪变性比普通人群更严重,糖尿病组和高危组的肝脏脂肪含量均高于对照组,但差异无统计学意义。Nasr等[21]研究证实,肝脏脂肪含量可预测患糖尿病的风险。Taylor[22]的“双循环”假说认为,肝脏中脂肪堆积加剧胰岛素抵抗,导致胰腺调节葡萄糖稳态的功能受损,最终导致T2DM。由于肝脏脂肪间接影响胰腺脂肪和胰腺分泌,其敏感性较胰腺脂肪含量差。
综上所述,T2DM的发生和进展是多重因素共同作用的结果,胰腺脂肪含量和胰腺体积对鉴别T2DM具有较高诊断效能。T2DM患者主要表现为脂肪含量增加和胰腺体积缩小。MRI多序列扫描能精准评估T2DM患者的胰腺脂肪含量和胰腺体积改变,从而更客观地反映胰腺的功能状态,为临床T2DM的诊治提供可靠的影像学依据。
本研究存在的不足:T2DM组与对照组年龄、性别、例数及BMI匹配,导致的入组人数较少,使总体样本量偏小;实验室检查中未收集胰岛素、C肽蛋白等指标,不利于对胰腺功能的深度分析,有待在以后研究中完善。
[参考文献]
[1] IDF DIABETES ATLAS. Availabe online[EB/OL] (2021-11-06). http://www.diabetesatlas.org/.
[2] NADARAJAH C,FANANAPAZIR G,CUI E,et al. Association of pancreatic fat content with type Ⅱ diabetes mellitus[J]. Clin Radiol,2020,75(1):51-56.
[3] DEMINE S,SCHULTE M L,TERRITO P R,et al. Beta cell imaging-from pre-clinical validation to first in man testing[J]. Int J Mol Sci,2020,21(19):7274.
[4] 孙文杰,赵能江,李博,等. 《中国2型糖尿病防治指南(2020年版)》推荐中成药品种述评[J]. 中国中医药信息杂志,2022,29(3):1-5.
[5] 王璐,郑松柏,贾惠惠,等. 胰腺大体形态的增龄变化:191例胰腺磁共振图像分析[J]. 中华老年医学杂志,2021,40(6):756-760.
[6] WEN Y,CHEN C,KONG X,et al. Pancreatic fat infiltration,β-cell function and insulin resistance:a study of the young patients with obesity[J]. Diabetes Res Clin Pract,2022,187:109860.
[7] PIEŃKOWSKA J,BRZESKA B,KASZUBOWSKI M,et al. The correlation between the MRI-evaluated ectopic fat accumulation and the incidence of diabetes mellitus and hypertension depends on body mass index and waist circumference ratio[J]. PloS One,2020,15(1):e0226889.
[8] JESUTHASAN A,ZHYZHNEUSKAYA S,PETERS C,et al. Sex differences in intraorgan fat levels and hepatic lipid metabolism:implications for cardiovascular health and remission of type 2 diabetes after dietary weight loss[J]. Diabetologia,2022,65(1):226-233.
[9] MARTIN S,SOROKIN E P,THOMAS E L,et al. Estimating the effect of liver and pancreas volume and fat content on risk of diabetes:a Mendelian Randomization study[J]. Diabetes Care,2022,45(2):460-468.
[10] PATEL N S,PETERSON M R,LIN G Y,et al. Insulin resistance increases MRI-estimated pancreatic fat in nonalcoholic fatty liver disease and normal controls[J]. Res Pract,2013,2013:498296.
[11] SKUDDER-HILL L,SEQUEIRA I R,CHO J,et al. Fat distribution within the pancreas according to diabetes status and insulin traits[J]. Diabetes,2022,71(6):1182-1192.
[12] ZENG N,WANG Y,CHENG Y,et al. Imaging evaluation of the pancreas in diabetic patients[J]. Abdom Radiol (NY),2022,47(2):715-726.
[13] SINGH R G,YOON H D,WU L M,et al. Ectopic fat accumulation in the pancreas and its clinical relevance:a systematic review,meta-analysis,and meta-regression[J]. Metabolism,2017,69:1-13.
[14] SZCZEPANIAK E W,MALLIARAS K,NELSON M,et al. Measurement of pancreatic volume by abdominal MRI:a validation study[J]. PLoS One,2013,8(2):e55991.
[15] WILLIAMS J M,HILMES M A,ARCHER B,et al. Repeatability and reproducibility of pancreas volume measurements using MRI[J]. Sci Rep,2020,10(1):4767.
[16] AL-MRABEH A,HOLLINGSWORTH K G,SHAW J A M,et al. 2-year remission of type 2 diabetes and pancreas morphology:a post-hoc analysis of the DiRECT open-label,cluster-randomised trial[J]. Lancet Diabetes Endocrinol,2020,8(12):939-948.
[17] MACAULEY M,PERCIVAL K,THELWALL P E,et al. Altered volume,morphology and composition of the pancreas in type 2 diabetes[J]. PLoS One,2015,10(5):e0126825.
[18] IWAMOTO Y,KIMURA T,TATSUMI F,et al. Association between changes in pancreatic morphology and vascular complications in subjects with type 2 diabetes mellitus:a retrospective study[J]. Sci Rep,2022,12(1):17166.
[19] AL-MRABEH A,HOLLINGSWORTH K G,SHAW J A M,et al. 2-year remission of type 2 diabetes and pancreas morphology:a post-hoc analysis of the DiRECT open-label,cluster-randomisedtrial.Lancet[J]. Lancet Diabetes Endocrinol,2020,8(12):939-948.
[20] KRISHAN S. Correlation between non-alcoholic fatty liver disease (NAFLD) and dyslipidemia in type 2 diabetes[J]. Diabetes Metab Syndr,2016,10(2 Suppl 1):S77-S81.
[21] NASR P,FREDRIKSON M,EKSTEDT M,et al. The amount of liver fat predicts mortality and development of type 2 diabetes in non-alcoholic fatty liver disease[J]. Liver Int,2020,40(5):1069-1078.
[22] TAYLOR R. Pathogenesis of type 2 diabetes:tracing the reverse route from cure to cause[J]. Diabetologia,2008,51(10):1781-1789.
(收稿日期" 2023-07-27)

