微生物-电极修饰及影响电合成转化CO2过程的研究进展
















摘要: 微生物电合成(microbial electrosynthesis,MES)是一种利用电活性微生物摄取胞外电子,将CO2或有机废料转化为可再生化学品的技术。首先,文中阐述了电极的改性方式,碳基材料以其多样的形态、优异的化学稳定性和高比表面积等优点,在电极改性中发挥着重要作用, 其主要是通过提供更多的微生物附着点和增强电子传递效率改善MES;而非碳基材料如金属材料等,因其优异的导电性和催化活性,则被广泛用于提升电极性能,其作用机制在于加速电极上的催化反应和促进特定产品的生成。其次,从电活性微生物角度入手,揭示了在电极材料修饰和微生物细胞修饰上的共同点都是能够提高微生物的电子传递能力,不同点在于微生物细胞修饰可以直接作用于微生物的生理和遗传特性,以增强其电子传递能力和底物转化效率。此外,分析了纳米材料与高附加值产品之间的关系,认为合理选择和制备电极材料及微生物细胞修饰策略,对于提高MES系统的效率和产物选择性至关重要。最后,对MES技术面临的挑战和未来的研究方向进行了展望。
关键词: 微生物电合成(MES); CO2转化; 电极修饰; 电活性微生物; 胞外电子传递; 纳米材料
中图分类号: Q 939.9; X 701文献标志码: A"" 文章编号: 1000-5013(2024)05-0559-16
Advances in Microbial-Electrode Modification and Influence on Process of Electrosynthesis to Convert CO2
Abstract: Microbial Electrosynthesis (MES) is a technology that uses electroactive microorganisms to take up extracellular electrons to convert CO2 or organic wastes into renewable chemicals. In this paper, the electrode modification approach is firstly described, and it is pointed out that carbon-based materials, with their diverse morphology, excellent chemical stability and high specific surface area, play an important role in electrode modification, and their mechanism of action is mainly through providing more microbial attachment points and enhancing the electron transfer efficiency. While non-carbon based materials, such as metallic materials, are widely used to enhance electrode performance due to their excellent electrical conductivity and catalytic activity, and their mechanism of action lies in accelerating the catalytic reaction on the electrode and promoting the generation of specific products. Secondly, from the perspective of electroactive microorganisms, the article reveals that the common point on the modification of electrode materials and microbial cell modification is to enhance the microbial electron transfer ability, and the difference is that the microbial cell modification can directly act on the physiological and genetic characteristics of microorganisms in order to enhance the electron transfer ability and the efficiency of substrate conversion. In addition, the article analyses the relationship between nanomaterials and high value-added products, and concludes that the rational selection and design of electrode materials and microbial cell modification strategies are crucial for improving the efficiency and product selectivity of MES systems. Finally, it provides an outlook on the challenges and future research directions of MES technology.
Keywords: microbial electrosynthesis (MES); CO2 conversion; electrode modification; electroactive microorganisms; extracellular electron transfer; nanomaterials
二氧化碳(CO2)是导致全球气候变化的主要温室气体之一。为应对大量CO2排放造成的气候问题,2015年12月,联合国在法国巴黎召开第21届联合国气候变化大会并凝聚共识达成《巴黎协定》,要求缔约方尽快达到温室气体排放的全球峰值,并在本世纪下半叶实现温室气体源净零排放[1]。然而,2023年,CO2的排放总量还是增长了1.1%,非但没有迅速下降,反而达到了创纪录的3.74×1010 t[2]。因此,如何有效解决CO2排放已成为研究热点。
在成熟的CO2利用技术中,存在着包括反应空间要求高、能耗巨大、催化剂昂贵、产物多为一碳化合物等缺点[3]。微生物电合成(microbial electrosynthesis,MES)可以利用具有细胞外电子传递(extracellular electron transfer,EET)能力的电活性微生物作为生物催化剂[4],通过在电极上的直接(direct electron transfer,DET)或间接电子传递(mediated electron transfer,MET)摄取胞外电子,同时将有机或无机物质转化为能量密度更高的产物[5]。MES是一个复杂的过程,从细胞内到细胞外有多次氧化还原反应,这一过程的效率受多种因素影响,包括微生物代谢、物质传递、胞外聚合物、界面上的电子传递阻力等[6]。近年来,为了消除微生物和电极之间的界面效应,提高MES的效率,国内外广泛关注了利用纳米材料对参与MES的电极、微生物进行修饰,使电子有效地从电极转移到微生物[7]。
基于此,本文对近几年微生物电合成(MES)的发展进行了总结。首先从电极材料和电活性微生物的修饰两个方面阐述了提高MES系统的效率和产物选择性的方法,分析过程作用机制;其次,详细阐述了通过各种纳米修饰策略在MES生产C1,C2,C3,C4等高附加值化学品的进展,解释不同纳米材料修饰对于产物选择性的作用机制;最后,根据目前存在的问题对未来MES的研究方向进行了展望。
1 微生物电合成还原CO2过程中微生物-电极的修饰策略
微生物电合成(MES)可以对CO2进行转化,生产高附加值化学品,如甲烷、乙酸、乙醇、丁酸、丁醇和己酸等[8]。然而,MES也有存在一些局限性,主要包括:1) 有机物合成需要大量的电子消耗;2) 需要外部的能量供应来激活生物膜的自养生长;3) 从阴极到微生物较低的电子转移速率,减缓了CO2的还原过程[9-10]。这些问题的根本在于微生物外膜与阴极之间存在界面,两者之间无法实现快速的电子交互。为了解决这些问题,探索MES的可行性,国内外研究人员从电极材料的改造和电活性微生物的修饰两个方面入手。
1.1 电极材料修饰
电极材料的主要修饰方法,如图1所示。
1.1.1 碳基材料 碳基材料由于其多样的形态、优异的化学稳定性和高比表面积等优点,在电极材料应用方面独具优势,受到极大的青睐[11]。此外,碳基材料出色的生物相容性和导电性也可有效促进电活性细菌的增殖,提高MES效率[12]。
Nevin等[13]利用带负电的固态石墨块阴极作为电子供体源,首次证明了阴极材料改性后通过微生物在MES中还原CO2的原理。
不同形状和类型的碳电极,如碳棒碳布、碳毡、活性炭、气体扩散活性炭、颗粒、纤维棒和网状玻璃等,已被普遍用作MES系统的阴极。如碳毡(carbon felt,CF)具有高孔隙率、高表面积,以及能进一步表面改性的柔韧性优点,可作为阴极优化乙酸的生产。Bajracharya等[14]使用石墨毡和不锈钢组件作为MES系统的阴极,在析氢电位下,分别通过混合培养物和Clostridium ljungdahlii研究MES的CO2还原[14],如图2所示。但碳基电极也存在一些缺点,如其孔隙率较差、生物电化学活性表面积有限、内阻高、还原当量供应不足和高活化电位而无法实现高生产率[15]。
近年来,一些研究人员提出对碳基材料进行改进,如通过高孔隙率、高表面积与体积比,以及在电极表面诱导电荷和/或官能团来改善生物相容、增加电导率、诱导催化活性,并降低阈值活化能,以促进电极和微生物之间的电子转移。其中用碳基纳米材料改性的阴极获得了较好的结果,其产量和电流密度高出未改性的数倍[16-17]。例如,Jiang等[18]构建了一个配备浆液电极的新型双室ME-MES集成系统,通过添加粉末活性炭(activated carbon,AC)对CF改性,并评估电解液中粉末活性炭(AC)浓度对化学品生产的影响。结果发现,5 g·L-1的AC可产生高达13.4 g·L-1的乙酸,与没有AC的对照组相比增加了179%。
在过去的十年中,氧化石墨烯(graphene oxide,GO)在MES中得到了深入研究[19]。GO不仅可以促进细菌增殖、细胞粘附及细胞代谢,
还具有出色的导电性、高载流子迁移率,以及出色的固有机械强度、化学稳定性和较大的比表面积。Li等[20]将GO/PEDOT改性电极应用于将CO2还原成CH4的MES中,在CH4的最大生产率为315.3 mmol·(m2·d)-1,法拉第效率大于92%,与裸碳布相比提高了3.9倍,如图3所示。其次,MXenes作为一类二维(2D)电极材料,由于其优越的性能,包括出色的导电性、离子嵌入行为和亲水性,受到广泛关注[21]。Khurram等[22]将MXene结构涂覆在生物炭基板上,结果表明,与未涂层的生物炭相比,该涂层具有改进的导电性,更高的电荷转移效率和选择性微生物富集特性,导致阴极电流产生增加2.3倍,如图4所示。Han等[23]将一维碳纳米管与二维石墨烯纳米片(GN-CNTs)相结合,描述了一种新的3D材料微生物电极。结果表明,3D GN-CNTs电极在其多孔结构内实现了较强的细菌附着和增殖,其宏观结构和纳米结构的结合可以有效地在阴极表面提供正电荷,提高电流消耗和微生物电化学合成速率,如图5所示。
在MES中,利用碳基材料对阴极电极改性能够提高系统的整体性能和效率。改性后的碳质碳基电极能够增强微生物与电极的相互作用,提升电子传递速率,从而促进更多的底物转化为目标产物。此外,碳材料的高比表面积和良好的化学稳定性有助于微生物的附着和生物膜的形成,且碳材料的导电性能有助于提高电极的生物相容性和电子传输效率,对于实现MES系统的高效运行和可再生能源的生产至关重要。
1.1.2 非碳基材料 金属材料以其优异的导电性、稳定性和优异的催化活性,被广泛认为是MES中有效的电极修饰材料[24]。单金属催化剂具有良好的可控性且相对容易制备,使其成为极具吸引力的催化剂和阴极改性材料。Zhu等[25]制备铟(In)、锌(Zn)、钛(Ti)和铜(Cu)四种不同金属基的电催化剂箔。通过恒流电化学实验表明,四种金属电极都表现出高并联性,最大乙酸产率出现在Zn电极,为1.23 g·(L·d)-1,如图6所示。虽然贵金属,如铱(Ir)、铂(Pt)和钯(Pd)等,已经显示出优异的电催化活性,但也存在高成本和低丰度等缺点[26]。因此,寻找实际可行的高效非贵金属催化剂至关重要。
与纯金属催化剂相比,合金和复合材料具有性能优越、成本低等优势,近年来日益受到重视[27]。复合材料的掺入,将非金属材料的大比表面积和亲水性性能与金属材料的高导电性和催化活性相结合,为MES阴极的性能提升和应用范围拓宽提供了有效途径[28-29]。Cui等[30]使用CF作为微波吸收剂对二茂铁进行微波热解,从而在CF电极上生长出氧化铁(Ⅲ)石墨化碳。这种复合材料呈现出多长尺度的多孔结构,具有高比表面积,优异的导电性和稳定性。乙酸产率超过14.9 kg·(m3·d)-1,电子回收率为(86±9)%,如图7所示。
对于某些金属,如Cu,Ag等,由于其抗菌性能而在生物电化学系统中受到限制的问题,可以通过复合材料的制备解决。例如,Nabin等[31]通过引入具有高生物相容性的还原氧化石墨烯(rGO),提高了生物相容性,促进了细菌在电极表面形成致密且具有电活性的生物膜,同时实现了1 697.6 mmol·(m2·d)-1的高乙酸产出率,如图8所示。
通过调整金属氧化物的元素组成和纳米形态,可以制备出更多的纳米杂化催化剂。Dayakar等[32]开发了一种由纳米线与装饰在GO上的MnO2结合,以花状形态相互连接而成的阴极,用于MES生产乙酸和异丁酸,这增加了CO2吸收能力,降低了电子转移阻力。一些金属氧化物的加入给MES阴极带来了更多的功能,如磁铁矿(Fe3O4)作为天然的末端电子受体,具有良好的生物相容性和低毒性,有助于改善EET[33]。He等[34]通过将Fe3O4 NPs掺入GO溶液中,并将磁体包裹在碳布中,使生物复合物与电极之间形成磁性吸引,形成更厚的杂交生物膜。结果表明,CH4生成率与碳布生物阴极相比增加了14.5倍,如图9所示。
总而言之,金属、合金和复合材料通常具有良好的导电性和催化活性。通过三者对阴极材料进行修饰,能够更有效地促进MES中的阴极反应,如CO2还原反应(CO2RR);同时也可以有效提高MES的电子传递效率,提升了整个系统在高电流密度下的稳定性和性能,从而推动这一技术在高效能源转换和环境治理中的应用。
1.2 微生物细胞修饰
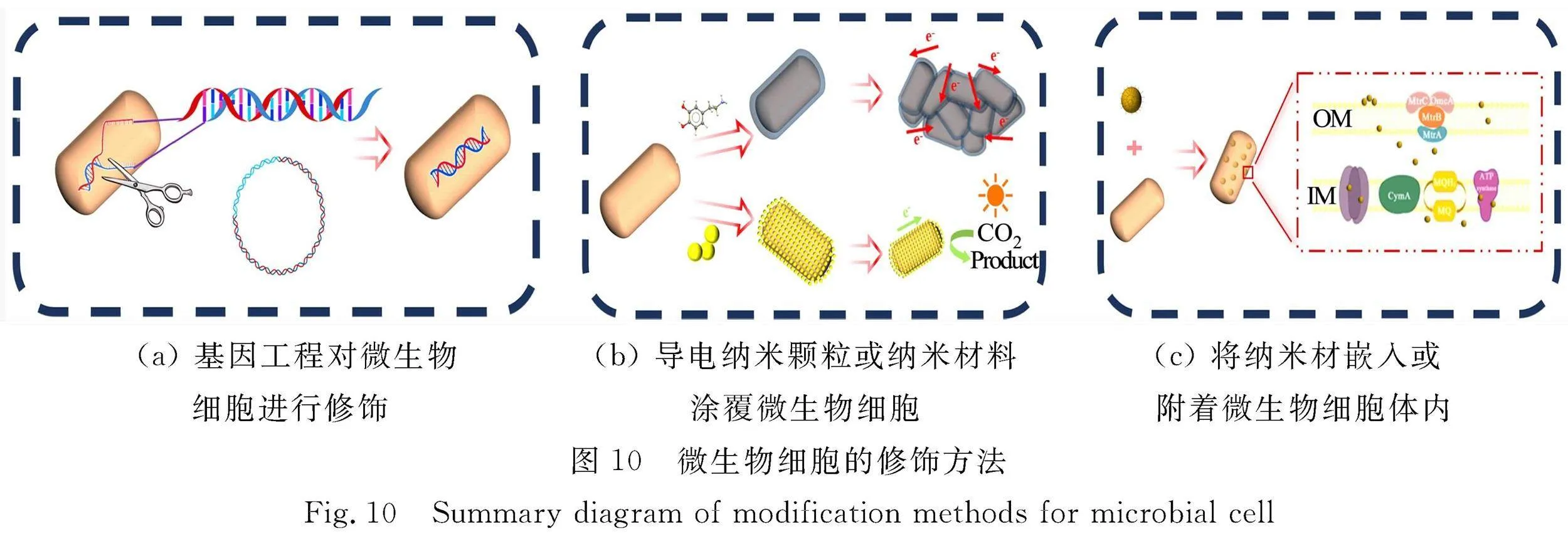
与对电极材料进行修饰相比,对微生物进行修饰可以直接作用于MES中的生物活性中心,提高微生物的内在活性和EET效率,减少对外部电子介体的依赖,从而降低系统成本;同时,也可能促进具有特定催化功能的微生物种群的富集,实现更高效和特异的电化学转化[35-36]。此外,通过合成生物学手段对微生物进行基因层面的改造,可以精确调控其代谢途径,实现对微生物功能的定制化设计,为微生物电合成技术的发展提供了更广阔的应用前景和更高的灵活性[37]。在MES中对微生物进行修饰主要分为三种方法,如图10所示。
第一种方法是通过基因工程对微生物细胞进行修饰和改造,以提高其胞外电子的传递效率。例如,通过筛选模式产电微生物希瓦氏菌(S. oneidensis MR-1)基因组上有利于囊泡分泌的相关基因,然后对基因工程进行改造,可以提高胞外电子传递效率[38]。Ding等[37]基于生物电子生成代谢途径的结构,通过一种模块化工程策略,拓宽胞内电子池的来源,促进胞内烟酰胺腺嘌呤二核苷酸(NADH)再生,促进电子池的电子释放,成功提高了S. oneidensis MR-1的EET效率,如图11所示。利用分子生物学及合成生物学手段,可以通过调控细胞电子传递路径、胞内还原力水平和胞内信号分子的表达,从而增强微生物的电子传递能力[39-40]。
第二种微生物细胞修饰的方法是用导电纳米颗粒、导电纳米材料修饰或涂覆微生物细胞。Jiang等[41]通过在Shewanella PV-4的细胞表面均匀聚集FeS纳米颗,进而改善了电极的EET,如图12所示。此外,导电聚合物具有可调节的导电性、电化学稳定性,以及优异的亲水性和高生物相容性等优势,更符合MES系统中构建阴极的要求[42]。通过在微生物细胞表面涂覆一层聚合物可以提高导电性和亲水性,从而使细菌粘附性强,提高EET效率和运行稳定性[36]。Song等[43]通过将聚吡咯(polypyrrole,PPy)涂覆在S. oneidensis MR-1,Ochrobacterium anthropic, Escherichia coli,Streptococcus thermophilus四种细菌上来改善微生物-电极相互作用,发现PPy不仅提高了直接接触EET效率,而且提高了细菌活力。在这项研究中,观察到S. oneidensis MR-1在功率输出方面的EET增强了约14倍,如图13所示。
第三种微生物修饰方法是通过嵌入或者附着的方式,将纳米材料与微生物的活性位点直接接触,进一步提高其胞外电子转移速率[44]。例如,He等[45]将CdS与S. ovata一起共培养形成复合体并用于光催化(原理与微生物燃料电池类似),成功将CO2转化为乙酸。结果发现,电子传递相关蛋白(黄素蛋白、铁氧还原蛋白)、甲酸转化途径相关蛋白(FTL)等被激活,说明纳米材料修饰后提高电子传递基因的表达,如图14所示。除此以外,碳点(carbon dots,CDs)作为一种高导电性和低生物毒性的碳基纳米材料,已有研究者将其应用于MES,增强细菌的跨膜和胞外电子转移速率,提高微生物自身产电能力[46-48]。Yang等[49]进一步分析CDs与S. oneidensis MR-1形成的复合体的代谢过程。结果发现,复合体的S. oneidensis MR-1的代谢速率会加快,细胞内电荷增加,三磷酸腺苷水平更高,底物消耗更快,细胞外分泌更丰富,因此CDs能够促进S. oneidensis MR-1的能量代谢,如图15所示。
在MES中,电极材料修饰主要是通过在电极表面修饰碳基材料或者金属提高其电极电导率,以及制造多孔结构提高微生物负载量来加强EET效率。细胞修饰主要在细胞外膜至细胞膜上修饰纳米材料,降低阴极和细胞表面电子传递之间的界面影响,甚至影响细胞内部代谢来强化MES效率。相较而言,微生物改性的优势在于能够精确调控生物催化剂的内在特性,提高微生物对底物的转化率和选择性,增强其在电极表面的附着能力和生物膜的形成,以及优化微生物的代谢途径以生产特定的高价值化合物,为MES的发展提供了更广阔的应用前景和更高的灵活性。
2 MES还原CO2生成的高附加值产品
到目前为止,通过各种纳米修饰策略在MES生产高附加值化学品中的潜力已经被广泛探索。这些化学品根据碳链的长度,可以分为C1,C2,C3,C4产物等,它们在能源、化工和材料科学领域具有广泛的应用前景,如表1所示。
2.1 C1产物
在MES实验中, 通过纳米材料修饰可以得到各种C1化学品, 包括甲烷(CH4)、甲酸(HCOOH)和
甲醇(CH3OH)。甲烷是生物电化学研究中报道最广泛的产物之一,同时甲烷也是最简单的有机化合物,是天然气和沼气的主要成分,不仅可以用作燃料,还可以用作生产氢气的原料。在MES中,产甲烷菌能够在外部电源的帮助下,通过直接种间电子传递(direct interspecies electron transfer,DIET)和间接种间电子传递(mediated interspecies electron transfer,MIET)两个重要的途径生成甲烷[50],DIET过程的强化,可以进一步提升CH4的产生效率。近年来研究表明,导电材料可以通过加强DIET促进功能微生物富集或者增强电子传递效率,提高CH4产生率[51]。例如,碳毡[52-54]、石墨毡[55]、碳布[20]、石墨棒[56]、碳刷[57]、金属铁[58]和磁铁矿[59]等。
甲酸作为一种重要的有机化工原料,可用于合成多种化学品和材料。在MES中,可以通过代谢工程改造电活性微生物,优化微生物的代谢途径提高甲酸产量。例如S. oneidensis MR-1,可以过表达关键基因,如cctA,fdhA1和nadV,将甲酸产率提高到了野生型的5.59倍[60]。此外,也可以通过纳米材料对电极的改性修饰提高电子传递效率,实现高效的甲酸生产[57,61-62]。如Qiu等[63]制备Sn改性碳毡,Sn的存在有利于阴极生物膜的生长,增加了微生物的积累。结果表明,Sn-CF组甲酸产量为(0.81±0.06)" g·L-1,而在CF中几乎没有检测到甲酸的生产。Sn的存在显著提高了甲酸的生成,并通过甲酸相关的代谢途径显著增强了电子转移,从而提高了CO2在MES中的转化。甲醇作为一种多功能的化学中间体,在制药、农药和燃料等领域有着广泛的应用。对于目前在MES中的甲醇生产,关键在于优化微生物的代谢途径[64-65]。
2.2 C2产物
用于MES的主要C2生物产品包括乙酸(CH3COOH)、乙醇(CH3CH2OH)、乙烯(C2H4)等。乙酸是MES过程中的一个关键C2化学品,本身作为有价值的化学品同时,也可以作为进一步产品生成的中间产物及许多工业生物过程(如废水处理厂的脱氮)的碳底物[66],具有许多潜在的可行用途。迄今为止,75%的MES研究报告了乙酸盐的生产[67]。乙酸是产乙酸菌通过还原乙酰辅酶A途径(又称Wood-Ljungdahl途径)还原CO2的产物[68]。在所有产乙酸微生物中,S. ovata是第一株用于MES生产乙酸的菌株,其乙酸产量较高[13]。此后,采用不同的纳米材料对阴极改性用于增强乙酸的生成,例如碳基、金属基纳米材料等。
Jiang等[18]将MES与膜电解相结合,在采用粉末活性炭作为阴极的情况下,乙酸的产量提高了179%。这一结果也表明了MES与其他系统相结合,得以提高产量的可能性和可行性。二维结构的碳基材料虽然可以显著提升单位面积电流密度,但对于单位体积产物的积累作用并不明显。因此开发了许多3D碳基电极,使用三维大孔阴极,乙酸最高产量为(685±30) g·(m2·d)-1,远超未改性碳基电极的产量[69]。此外可以通过化学官能团对碳基材料进行修饰,改性阴极通过在碳布电极表面接枝特定的官能团-COOH,可以显著改善乙酸累积浓度[70]。除碳基纳米材料外,金属纳米颗粒(NPs)也可以显著增强乙酸生成。例如,Ni,Au和Pd三种金属纳米颗粒涂覆在碳布上,与未处理的碳布相比,加强了乙酸的生产[71]。此外研究发现,含有磁铁矿纳米颗粒的生物阴极可以催化微生物产氢,同时具有更高的氢演化性能。Cruz等[72]在石墨棒电极中添加了磁铁矿纳米颗粒,将乙酸盐产量提高了8.5倍。乙烯是一种简单的烯烃,是石油化工行业中非常重要的基础化学品,工业上主要用于生产聚乙烯(PE)、聚氯乙烯(PVC)等塑料和合成材料。虽然目前尚未有相关文献报道MES中生产乙烯,但目前已有研究讨论了乙烯的生物合成途径,例如在植物、藻类或微生物中,通过使用廉价和可再生的基质直接合成乙烯[73]。
2.3 C3产物
目前,通过纳米材料改性促进C3化学品生产方面的研究并不多,是一种具有潜力的研究方向。已有研究表明,通过合成生物学手段优化或外源引入电子传递元件的生物合成路径,能够直接调控细胞电子传递路径,提高产电微生物的胞外电子传递效率,并得到较好的产量。在MES中可生成的C3化学品,包括但不限于丙酮酸(CH3COCOOH)、丙酸(CH3CH2COOH)、异丙醇((CH3)2CHOH)和乳酸(CH3CH(OH)COOH)。其中丙酮酸广泛应用于食品、化妆品、制药、农业和化工等行业,丙酮酸在糖酵解途径中起关键作用,其衍生化学物质主要含有乙酸、丙酸、丙烯酸、3-羟基丙酸、乳酸和聚乳酸[74]。
近年来,包括大肠杆菌[75]、酿酒酵母[76]、光滑念珠菌[77]等菌株已成功设计用于生产丙酮酸[74],基于原有CO2固定反应的新型代谢途径改造,也非常具有科学研究和实用价值。Bouzon等[78-79]向高丝氨酸代谢途径引入了外源的转氨酶和醛缩酶,使之可以裂解成丙酮酸和甲醛,实现CO2固定的一种新的一碳代谢循环。在MES中以CO2为底物可生产的C3化学品的相关报道并不多,目前已经有关于异丙醇、乳酸的相关报道。异丙醇是一种无色、易挥发的液体,具有类似乙醇的气味,常用作溶剂、消毒剂以及化学合成的原料。Arends等[73]首次报道异丙醇的生产,产量可以达到1.17 g·(m2·d)-1,同时异丙醇地稳定生产,为在MES中生产仲醇提供了可能性。乳酸作为一种重要的有机酸,在工业和日常生活中有着广泛的应用。它是另一种可以通过MES生成的C3有机化合物,由CO2通过三羧酸循环还原的中间产物生成[80]。研究人员通过改造大肠杆菌的黄素腺嘌呤二核苷酸(FAD)合成途径,提高了胞内FAD的水平,从而增加了大肠杆菌的电活性,把高电活性大肠杆菌运用到MES,发现有利于乳酸、乙醇等还原性产物的生成[81]。
2.4 C4及以上产物
迄今为止,乙酸一直是通过生物电化学系统转化CO2的大部分产物。然而,由于市场价格低廉,从经济角度来看,乙酸的生产并不是很有吸引力。鉴于此,研究人员逐渐尝试通过微生物催化短链脂肪酸伸长为中链脂肪酸[82]。目前,MES在生产C4化合物方面已经取得了一些进展。根据已有的研究报道,可以生产丁酸(CH3(CH2)2COOH)、异丁酸((CH3)2CHCOOH)、丁烷(CH3(CH2)2CH3)和丁醇(CH3(CH2)3OH)等。丁酸是一种工业原料,在制药和化学工业中具有许多应用,可以通过酯化进一步转化为燃料。Sharma等[83]通过-0.65 V的直接电子转移,将乙酸和丁酸生物催化还原为生物醇和中链脂肪酸,生产的产品包括0.8 mmol·L-1甲醇,0.2 mmol·L-1乙醇,0.4 mmol·L-1丙醇,0.6 mmol·L-1丁醇和0.2 mmol·L-1丙酮,以及较低量的丙酸和己酸。Ganigue等[82]首次实现以CO2为唯一的碳源,通过MES生产丁酸,证明CO2还原为丁酸是由氢驱动的。此后大量研究证明,通过MES生产丁酸是可行的[84-86]。
通过研究发现,脂肪链的延伸与相关微生物的生长呈正相关,微生物生长条件也会影响微生物富集和最终产品[87]。因此,需要对阴极进行改性,以改善电极-微生物的电子传递,从而提高MES的生产率和选择性。近年来,CoP,MoS2和镍钼合金改性阴极被用于选择性生产C2和C4化合物[88]。Khurram等[89]用廉价的镍铁氧体(NiFe2O4@CF)提高导电性、电荷转移效率,以及与选择性微生物富集的微生物-电极相互作用等优点,实现丁酸盐产量高于碳毡1.2倍。异丁酸是丁酸的异构体,Dayakar等[90]在石墨毡上引入创新的电极材料,铁氧体铜负载GO,实现了异丁酸的生产率。丁烷、丁醇广泛用于化学生产,时常作为次要产品伴随乙酸、乙醇、丁酸等的生成[91]。
C4以上的中链脂肪酸在各个行业都有广泛的应用,但传统的生产方法成本高昂且不可持续。MES为链伸长提供了一个更具可扩展性、经济性和环保性的平台。该过程利用了Wood-Ljungdahl途径,这是乙酰细菌采用的代谢途径。其中CO2转化为乙酰辅酶A,然后,乙酰辅酶A可以转化为乙酸。作为合成长链脂肪酸的中间体,它可以合成高达C4的产品[92]。如戊酸(CH3(CH2)3COOH)[93]、己酸(CH3(CH2)4COOH)[86,94]、辛酸(CH3(CH2)6COOH)[95],以及异戊醇((CH3)2CHCH2CH2OH)[96]。这些中链脂肪酸中的大多数不是直接由CO2还原得到,而是来自一些简单的CO2衍生产品[83,94-95],如Wang等[95]在MES中以乙酸为碳源,无需添加外部介质即可产生包括己酸、丁酸和较小部分的辛酸的中链脂肪酸。Mohita等[83]开发硫酸盐还原菌(SRB)的生物阴极可通过直接电子传递将乙酸和丁酸还原成醇类、丙酮和己酸。除了微生物链伸长外,通过工程技术编辑特定的代谢途径在生成长链产物形成中发挥着重要作用,这是MES中的一个新兴研究领域。
2.5 Cn化学品生成和微生物-电极修饰的未来发展趋势
通过深入总结现有文献和研究进展,可以发现尽管纳米材料在MES中的应用展现出巨大潜力,尤其是在提高电子传递效率和增强微生物代谢活性方面。但目前直接利用纳米材料改性修饰微生物电合成系统以生产特定化合物,尤其是高附加值的C3和C4产物,如丙酸、丁酸等的研究报道并不多。关于这类产物的合成,现阶段研究人员通常需要通过合成生物学手段对微生物进行基因改造,包括增强关键代谢酶的活性、引入新的代谢途径,或者通过基因编辑技术敲除或抑制某些基因的表达,从而改变微生物的代谢流向,增加目标产物选择性。
然而,已有研究发现纳米材料不仅可以充当电子穿梭体、改善电极或微生物的导电性提高EET的效率,纳米材料还能影响EET中功能基因的表达水平。Jia等[97]首次研究了纳米粒子(NPs)在有氧反硝化过程中介导的胞内/胞外电子传递(IET/EET)的机制。实验证明,纳米粒子可以通过提高Fe-S中心活性以及促进细胞色素的形成,加速电子传递。Jing等[98]在全细胞水平上阐明了OmcA和MtrC在S. oneidensis MR-1与石墨烯上,通过不同作用促进界面反应。此外,研究还表明,石墨烯复合材料可提高EET相关基因的表达水平。Yang等[49]研究发现碳点(CDs)可以被S. oneidensis MR-1有效吸收,增加细胞内电荷和三磷酸腺苷(adenosine triphosphate,ATP)水平、底物消耗,以及跨膜和细胞外电子转移能力,从而加速细菌代谢,促进生物产电。
此外在MES中,中链脂肪酸常作为短链脂肪酸的副产物出现。但纳米材料的选择与产物碳链的长短有着密切的关系。特定的纳米材料由于其独特的物理化学特性,能够针对性地影响微生物的代谢途径和电子传递效率,从而促进特定长度碳链化合物的合成。在金属和金属氧化物纳米材料中,如铁氧化物(Fe3O4)纳米粒子可能因其催化特性而更倾向于促进长链脂肪酸的生成[34]。纳米材料的特定形貌和尺寸可以影响微生物的代谢途径,从而影响碳链产物的合成。例如,纳米线和纳米花状结构的MnO2可以促进CO2还原为乙酸和异丁酸[32]。这些研究表明,纳米材料的引入为微生物电合成过程中的基因表达调控,以及实现对目标碳链长度产物的合成提供了新的策略。通过合成生物学手段对微生物进行基因改造,结合纳米材料的独特物理化学特性,可以更精确地调节微生物的代谢途径,实现对目标碳链长度产物的合成,优化目标化合物的生产效率。这种策略不仅有助于提高MES系统的生产力,还为开发新的生物制造过程和环境修复技术提供了新的思路。
未来的研究需要进一步探索纳米材料与微生物相互作用的分子机制,优化纳米材料的生物相容性和功能性,并通过合成生物学进一步改造微生物,以实现更高效、更经济、更绿色的MES过程。
3 总结与展望
文中首先对近几年MES发展进行了总结,从电极材料和电活性微生物的修饰两个方面阐述了提高MES系统的效率和产物选择性的方法,并分析过程作用机制。其次,详细阐述了通过各种纳米修饰策略在MES生产C1,C2,C3和C4等高附加值化学品的进展,解释了不同纳米材料修饰对于产物选择性的作用机制。
随着MES不断地发展和创新,其已成为应对气候变化、加强清洁能源生产,以及推进生物技术和环境科学应用不可或缺的解决方案。然而,目前在微生物培养物、电极材料和生物产品的多样化等方面仍有很大的上升空间,在提高产品产量和将CO2转化为高价值产品的商业可行性方面也存在难题;其次,在生产中链脂肪酸方面仍存在一定的局限,在提高产品选择性,以及寻找决定链伸长途径的关键因素上还需要进一步探索。随着新技术和新理念的发展,应用于CO2捕获和转化的MES应该变得更加完善和灵活。
因此,后续研究可以主要集中在以下几个方面。
1) 开发新型纳米材料,不仅可以提高电子传递效率、增强微生物与电极的附着力,还可以提高EET中功能基因的表达水平。
2) 深入研究微生物与电极材料之间的相互作用机制,以实现更高效的电子传递和更稳定的微生物电极界面。
3) 通过合成生物学手段,对微生物进行基因层面的改造,以增强其电子传递能力和代谢途径的调控,从而提高MES系统的整体性能。
4) 探索出决定增长碳链途径的关键因素,寻找更高效的增长碳链菌株的调控方法。
5) 随着MES技术的成熟,未来的工作也需考虑开发适合工业化应用的放大策略,包括生物反应器设计、过程控制等方面。
参考文献:
[1] 董聪,董秀成,蒋庆哲,等.《巴黎协定》背景下中国碳排放情景预测: 基于BP神经网络模型 [J].生态经济,2018,34(2):18-23.
[2] INTERNATIONAL ENERGY AGENCY.CO2 emissions in 2023[R/OL].(2024-03-01)[2024-07-15].https:∥www.iea.org/reports/co2-emissions-in-2023.
[3] 蔡韬,刘玉万,朱蕾蕾,等.二氧化碳人工生物转化[J].生物工程学报,2022,38(11):4101-4114.DOI: 10.13345/j.cjb.220889.
[4] CHOI O,SANG B I.Extracellular electron transfer from cathode to microbes:application for biofuel production[J].Biotechnology for Biofuels,2016,9(1):1-14.DOI:10.1186/s13068-016-0426-0.
[5] GAJDA I,YOU J,MENDIS B A,et al.Electrosynthesis, modulation, and self-driven electroseparation in microbial fuel cells[J].iScience,2021,24(8):102805.DOI:10.1016/j.isci.2021.102805.
[6] WANG Ruiwen,LI Huidong,SUN Jinzhi,et al.Nanomaterials facilitating microbial extracellular electron transfer at interfaces[J].Advanced Materials,2021,33(6):2004051(1-19).DOI:10.1002/adma.202004051.
[7] 苏紫荆,刘远峰,孙亚昕,等.促进微生物胞外电子转移的纳米材料研究进展[J].精细化工,2023,40(4):791-801.DOI:10.13550/j.jxhg.20220599.
[8] BIAN Bin,BAJRACHARYA S,XU Jiajie,et al.Microbial electrosynthesis from CO2: Challenges, opportunities and perspectives in the context of circular bioeconomy[J].Bioresource Technology,2020,302:122863(1-12).DOI:10.1016/j.biortech.2020.122863.
[9] CHRISTODOULOU X,OKOROAFOR T,PARRY S,et al.The use of carbon dioxide in microbial electrosynthesis:Advancements,sustainability and economic feasibility[J].Journal of CO2 Utilization,2017,18:390-399.DOI:10.1016/j.jcou.2017.01.027.
[10] MARSHALL C W,ROSS D E,FICHOT E B,et al.Electrosynthesis of commodity chemicals by an autotrophic microbial community[J].Applied and Environmental Microbiology,2012,78(23):8412-8420.DOI:10.1128/AEM.02401-12.
[11] LEKSHMI G S,BAZAKA K,RAMAKRISHNA S,et al.Microbial electrosynthesis: Carbonaceous electrode materials for CO2 conversion[J].Materials Horizons,2023,10(2):292-312.DOI:10.1039/D2MH01178F.
[12] HUI Su,JIANG Yujing,JIANG Yuanfan,et al.Cathode materials in microbial electrosynthesis systems for carbon dioxide reduction: Recent progress and perspectives[J].Energy Materials,2023,3(6):300055(1-31).DOI:10.20517/energymater.2023.60.
[13] NEVIN K P,WOODARD T L,FRANKS A E,et al.Microbial electrosynthesis: Feeding microbes electricity to convert carbon dioxide and water to multicarbon extracellular organic compounds[J].mBio,2010,1(2):e00103(1-10).DOI:10.1128/mBio.00103-10.
[14] BAJRACHARYA S,TER HEIJNE A,BENETTON X D,et al.Carbon dioxide reduction by mixed and pure cultures in microbial electrosynthesis using an assembly of graphite felt and stainless steel as a cathode[J].Bioresource Technology,2015,195:14-24.DOI:10.1016/j.biortech.2015.05.081.
[15] ARYAL N,AMMAM F,PATIL S A,et al.An overview of cathode materials for microbial electrosynthesis of chemicals from carbon dioxide[J].Green Chemistry,2017,19(24):5748-5760.DOI:10.1039/c7gc01801k.
[16] GUO Kun,CHEN Xin,FREGUIA S,et al.Spontaneous modification of carbon surface with neutral red from its diazonium salts for bioelectrochemical systems[J].Biosensors and Bioelectronics,2013,47:184-189.DOI:10.1016/j.bios.2013.02.051.
[17] POPOV A L,KIM J R,DINSDALE R M,et al.The effect of physico-chemically immobilized methylene blue and neutral red on the anode of microbial fuel cell[J].Biotechnology and Bioprocess Engineering,2012,17(2):361-70.DOI:10.1007/s12257-011-0493-9.
[18] JIANG Yong,LIANG Qinjun,CHU Na,et al.A slurry electrode integrated with membrane electrolysis for high-performance acetate production in microbial electrosynthesis[J].Science of The Total Environment,2020,741:140198(1-9).DOI:10.1016/j.scitotenv.2020.140198.
[19] AMEEN F,ALSHEHRI W A,NADHARI S A.Effect of electroactive biofilm formation on acetic acid production in anaerobic sludge driven microbial electrosynthesis[J].ACS Sustainable Chemistry amp; Engineering,2020,8(1):311-318.DOI:10.1021/acssuschemeng.9b05420.
[20] LI Qing,FU Qian,KOBAYASHI H,et al.GO/PEDOT modified biocathodes promoting CO2 reduction to CH4 in microbial electrosynthesis[J].Sustainable Energy amp; Fuels,2020,4(6):2987-2997.DOI:10.1039/d0se00321b.
[21] HART J L,HANTANASIRISAKUL K,LANG A C,et al.Control of MXenes′ electronic properties through termination and intercalation[J].Nature Communications,2019,10(1):522.DOI:10.1038/s41467-018-08169-8.
[22] TAHIR K,MIRAN W,JANG J,et al.MXene-coated biochar as potential biocathode for improved microbial electrosynthesis system[J].Science of The Total Environment,2021,773:145677.DOI:10.1016/j.scitotenv.2021.145677.
[23] HAN Shuo,LIU Hong,ZHOU C,et al.Growth of carbon nanotubes on graphene as 3D biocathode for NAD+/NADH balance model and high-rate production in microbial electrochemical synthesis from CO2[J].Journal of Materials Chemistry A,2019,7(3):1115-1123.DOI:10.1039/c8ta10465d.
[24] ZHAO Cuie,GAI Panpan,SONG Rongbin,et al.Nanostructured material-based biofuel cells:recent advances and future prospects[J].Chemical Society Reviews,2017,46(5):1545-1564.DOI:10.1039/c6cs00044d.
[25] JIANG Yong,CHU Na,ZHANG Wei,et al.Zinc: A promising material for electrocatalyst-assisted microbial electrosynthesis of carboxylic acids from carbon dioxide[J].Water Research,2019,159:87-94.DOI:10.1016/j.watres.2019.04.053.
[26] ZHU Yansong,ZHANG Bingsen.Nanocarbon-based metal-free and non-precious metal bifunctional electrocatalysts for oxygen reduction and oxygen evolution reactions[J].Journal of Energy Chemistry,2021,58(7):610-628.DOI:10.1016/j.jechem.2020.10.034.
[27] YANG Yi,NIU Shuwen,HAN Dongdong,et al.Progress in developing metal oxide nanomaterials for photoelectrochemical water splitting[J].Advanced Energy Materials,2017,7(19):1700555(1-26).DOI:10.1002/aenm.201700555.
[28] RAMKUMAR R,MINAKSHI M.Fabrication of ultrathin CoMoO4 nanosheets modified with chitosan and their improved performance in energy storage device[J].Dalton Transactions,2015,44(13):6158-6168.DOI:10.1039/c5dt00622h.
[29] HINDATU Y,ANNUAR M S M,GUMEL A M.Mini-review: Anode modification for improved performance of microbial fuel cell[J].Renewable and Sustainable Energy Reviews,2017,73(C):236-248.DOI:10.1016/j.rser.2017.01.138.
[30] CUI Mengmeng,NIE Huarong,ZHANG Tian,et al.Three-dimensional hierarchical metal oxide-carbon electrode materials for highly efficient microbial electrosynthesis[J].Sustainable Energy amp; Fuels,2017,1(5):1171-1176.DOI:10.1039/c7se00073a.
[31] ARYAL N,WAN L,OVERGAARD M H,et al.Increased carbon dioxide reduction to acetate in a microbial electrosynthesis reactor with a reduced graphene oxide-coated copper foam composite cathode[J].Bioelectrochemistry,2019,128:83-93.DOI:10.1016/j.bioelechem.2019.03.011.
[32] THATIKAYALA D,PANT D,MIN B.MnO2/reduced graphene oxide nanohybrids as a cathode catalyst for the microbial reduction of CO2 to acetate and isobutyric acid[J].Sustainable Energy Technologies and Assessments,2021,45:101114(1-9).DOI:10.1016/j.seta.2021.101114.
[33] ZHU Hao,DONG Zhiwei,HUANG Qiong,et al.Fe3O4/granular activated carbon as an efficient three-dimensional electrode to enhance the microbial electrosynthesis of acetate from CO2[J].RSC Advances,2019,9(59):34095-34101.DOI:10.1039/C9RA06255F.
[34] HE Yuting,LI Qing,LI Jun,et al.Magnetic assembling GO/Fe3O4/microbes as hybridized biofilms for enhanced methane production in microbial electrosynthesis[J].Renewable Energy,2022,185:862-870.DOI:10.1016/j.renene.2021.12.117.
[35] WU Xiaoshuai,QIAO Yan,SHI Zhuanzhuan,et al.Hierarchically porous N-doped carbon nanotubes/reduced graphene oxide composite for promoting flavin-based interfacial electron transfer in microbial fuel cells[J].ACS Applied Materials amp; Interfaces,2018,10(14):11671-11677.DOI:10.1021/acsami.7b19826.
[36] JIANG Yujing,HUI Su,JIANG Liping,et al.Functional nanomaterial-modified anodes in microbial fuel cells: Advances and perspectives[J].Chemistry,2023,29(1):e202202002.DOI:10.1002/chem.202202002.
[37] DING Qinran,LIU Qijing,ZHANG Yan,et al.Modular engineering strategy to redirect electron flux into the electron-transfer chain for enhancing extracellular electron transfer in Shewanella oneidensis[J].ACS Synthetic Biology,2023,12(2):471-481.DOI:10.1021/acssynbio.2c00408.
[38] 宋浩,卢昱君,蔚欢,等.一种工程改造希瓦氏菌囊泡提高胞外电子传递的方法: 116004690A[P].2023-04-25.
[39] 邵映芝,车鉴,程驰,等.分子生物学方法提高电活性微生物胞外电子传递效率的研究进展[J].中国生物工程杂志,2021,41(6):50-59.DOI:10.13523/j.cb.2102020.
[40] 刘向,张君奇,张保财,等.强化产电微生物与电极间电子传递速率的研究进展[J].生物工程学报,2021,37(2):361-377.DOI:10.13345/j.cjb.200281.
[41] JIANG Xiaocheng,HU Jinsong,LIEBER A M,et al.Nanoparticle facilitated extracellular electron transfer in microbial fuel cells[J].Nano Letters,2014,14(11):6737-6742.DOI:10.1021/nl503668q.
[42] ANTOLINI E.Composite materials for polymer electrolyte membrane microbial fuel cells[J].Biosensors amp; Bioelectronics,2015,69:54-70.DOI:10.1016/j.bios.2015.02.013.
[43] SONG Rongbin,WU Yichao,LIN Zongqiong,et al.Living and conducting: Coating individual bacterial cells with in situ formed polypyrrole[J].Angew Chem Int Ed Engl,2017,56(35):10516-10520.DOI:10.1002/anie.201704729.
[44] CHIRANJEEVI P,PATIL S A.Strategies for improving the electroactivity and specific metabolic functionality of microorganisms for various microbial electrochemical technologies[J].Biotechnology Advances,2020,39:107468(1-16).DOI:10.1016/j.biotechadv.2019.107468.
[45] HE Ying,WANG Shurong,HAN Xinyue,et al.Photosynthesis of acetate by sporomusa ovata-CdS biohybrid system[J].ACS Applied Materials amp; Interfaces,2022,14(20):23364-23374.DOI:10.1021/acsami.2c01918.
[46] YANG Wanning,ZHANG Hong,LAI Junxin,et al.Carbon dots with red-shifted photoluminescence by fluorine doping for optical bio-imaging[J].Carbon,2018,128:78-85.DOI:10.1016/j.carbon.2017.11.069.
[47] RAN Zhiyong,YANG Hongxing,LI Zhi,et al.Pillar[6]arene@AuNPs Functionalized N-CQDs@Co3O4 hybrid composite for ultrasensitive electrochemical detection of human epididymis protein[J].ACS Sustainable Chemistry amp; Engineering,2020,8(27):10161-10172.DOI:10.1021/acssuschemeng.0c02238.
[48] ZHANG Siyu,ZHAO Xinpeng,GUO Xinqi,et al.Boosting the electricity generation of nonclassical electroactive microorganisms enabled by carbon dots[J].Chemical Engineering Journal,2023,462:142147.DOI:10.1016/j.cej.2023.142147.
[49] YANG Chenhui,ASLAN H,ZHANG Peng,et al.Carbon dots-fed Shewanella oneidensis MR-1 for bioelectricity enhancement[J].Nature Communications,2020,11(1):1379-1379.DOI:10.1038/s41467-020-14866-0.
[50] 李静,张宝刚,刘青松,等.导电材料强化微生物直接种间电子传递产甲烷的研究进展[J].微生物学报,2021,61(6):1507-1524.DOI:10.13343/j.cnki.wsxb.20210176.
[51] GAHLOT P,AHMED B,TIWARI S B,et al.Conductive material engineered direct interspecies electron transfer (DIET) in anaerobic digestion: Mechanism and application[J].Environmental Technology amp; Innovation,2020,20:101056.DOI:10.1016/j.eti.2020.101056.
[52] CARRILLO-PEA D,MATEOS R,MORN A,et al.Reduced graphene oxide improves the performance of a methanogenic biocathode[J].Fuel,2022,321:123957(1-8).DOI:10.1016/j.fuel.2022.123957.
[53] WU Qi,XIAO Han,ZHU Hongguang,et al.Carbon felt composite electrode plates promote methanogenesis through microbial electrolytic cells[J].Energies,2023,16(11):4416。DOI:10.3390/en16114416
[54] YANG Houyun,WANG Yixuan,HE Chuanshu,et al.Redox mediator-modified biocathode enables highly efficient microbial electro-synthesis of methane from carbon dioxide[J].Applied Energy,2020,274(15):115292(1-11).DOI:10.1016/j.apenergy.2020.115292.
[55] QI Xuejiao,JIA Xuan,WANG Yong,et al.Development of a rapid startup method of direct electron transfer-dominant methanogenic microbial electrosynthesis[J].Bioresource Technology,2022,358:127385(1-10).DOI:10.1016/j.biortech.2022.127385.
[56] DEUTZMANN J S,KRACKE F,SPORMANN A M.Microbial electromethanogenesis powered by curtailed renewable electricity[J].Cell Reports Physical Science,2023,4(8):101515.DOI:10.1016/j.xcrp.2023.101515.
[57] DE LA PUENTE C,CARRILLO-PEA D,PELAZ G,et al.Microbial electrosynthesis for CO2 conversion and methane production: Influence of electrode geometry on biofilm development[J].Greenhouse Gases:Science and Technology,2023,13(2):173-185.DOI:10.1002/ghg.2185.
[58] ROHBOHM N,SUN Tianran,BLASCO-GMEZ R,et al.Carbon oxidation with sacrificial anodes to inhibit O2 evolution in membrane-less bioelectrochemical systems for microbial electrosynthesis[J].EES Catalysis,2023,1(6):972-986.DOI:10.1039/D3EY00141E.
[59] VU M T,NOORI M T,MIN B.Conductive magnetite nanoparticles trigger syntrophic methane production in single chamber microbial electrochemical systems[J].Bioresource Technology,2020,296:122265(1-9).DOI:10.1016/j.biortech.2019.122265.
[60] LI Yixin,LUO Qingliu,SU Jiaying,et al.Metabolic regulation of Shewanella oneidensis for microbial electrosynthesis: From extracellular to intracellular[J].Metabolic Engineering,2023,80:1-11.DOI:10.1016/j.ymben.2023.08.004.
[61] GUPTA P,VERMA N.Conversion of CO2 to formate using activated carbon fiber-supported g-C3N4-NiCoWO4 photoanode in a microbial electrosynthesis system[J].Chemical Engineering Journal,2022,446:137029(1-14).DOI:10.1016/j.cej.2022.137029.
[62] YU Linpeng,YUAN Yong,TANG Jiahuan,et al.Thermophilic Moorella thermoautotrophica-immobilized cathode enhanced microbial electrosynthesis of acetate and formate from CO2[J].Bioelectrochemistry,2017,117:23-28.DOI:10.1016/j.bioelechem.2017.05.001.
[63] QIU Z,ZHANG K,LI X L,et al.Sn promotes formate production to enhance microbial electrosynthesis of acetate via indirect electron transport[J].Biochemical Engineering Journal,2023,192:108842.DOI:10.1016/j.bej.2023.108842.
[64] LUO Jianquan,MEYER A S,MATEIU R V,et al.Cascade catalysis in membranes with enzyme immobilization for multi-enzymatic conversion of CO2 to methanol[J].New Biotechnology,2015,32(3):319-327.DOI:10.1016/j.nbt.2015.02.006.
[65] ZHANG Zhibo,WANG Hui,NIE Yi,et al.Natural deep eutectic solvents enhanced electro-enzymatic conversion of CO2 to methanol[J].Frontiers in Chemistry,2022,10:894106.DOI:10.3389/fchem.2022.894106.
[66] JOURDIN L,FREGUIA S,FLEXER V,et al.Bringing high-rate,CO2-based microbial electrosynthesis closer to practical implementation through improved electrode design and operating conditions[J].Environmental Science amp; Technology,2016,50(4):1982-1989.DOI:10.1021/acs.est.5b04431.
[67] JOURDIN L,BURDYNY T.Microbial electrosynthesis: Where do we go from here?[J].Trends in Biotechnology,2021,39(4):359-69.DOI:10.1016/j.tibtech.2020.10.014.
[68] ARYAL N,TREMBLAY P L,LIZAK D M,et al.Performance of different Sporomusa species for the microbial electrosynthesis of acetate from carbon dioxide[J].Bioresource Technology,2017,233:184-190.DOI:10.1016/j.biortech.2017.02.128.
[69] JOURDIN L,GRIEGER T,MONETTI J,et al.High acetic acid production rate obtained by microbial electrosynthesis from carbon dioxide[J].2015,49(22):13566-13574.DOI:10.1021/acs.est.5b03821.
[70] 祁家欣,曾翠平,骆海萍,等.羧基改性阴极对微生物电合成系统产乙酸性能的影响机制[J].环境科学,2019,40(05):2302-2309.DOI:10.13227/j.hjkx.201808250.
[71] ZHANG Tian,NIE Huarong,BAIN T S,et al.Improved cathode materials for microbial electrosynthesis[J].Energy amp; Environmental Science,2013,6(1):217-224.DOI:10.1039/C2EE23350A.
[72] VIGGI C C,COLANTONI S,FALZETTI F,et al.Conductive magnetite nanoparticles enhance the microbial electrosynthesis of acetate from CO2 while diverting electrons away from methanogenesis[J].Fuel Cells,2020,20(1):98-106.DOI:10.1002/fuce.201900152.
[73] 孙芝兰,陈以峰.乙烯的直接生物合成[J].生物工程学报,2013,29(10):1431-1440.DOI:10.13345/j.cjb.2013.10.008.
[74] LI Yang,YANG Shujie,MA Danlei,et al.Microbial engineering for the production of C2-C6 organic acids[J].Natural Product Reports,2021,38(8):1518-1546.DOI:10.1039/d0np00062k.
[75] ZHU Yihui,EITEMAN M A,ALTMAN R,et al.High glycolytic flux improves pyruvate production by a metabolically engineered Escherichia coli strain[J].Applied and Environmental Microbiology,2008,74(21):6649-6655.DOI:10.1128/AEM.01610-08.
[76] WANG Zhikun,GAO Cuijuan,WANG Qian,et al.Production of pyruvate in Saccharomyces cerevisiae through adaptive evolution and rational cofactor metabolic engineering[J].Biochemical Engineering Journal,2012,67:126-131.DOI:10.1016/j.bej.2012.06.006.
[77] LUO Zhengshan,LIU Song,DU Guocheng,et al.Enhanced pyruvate production in Candida glabrata by carrier engineering[J].Biotechnology and Bioengineering,2018,115(2):473-482.DOI:10.1002/bit.26477.
[78] BOUZON M,PERRET A,LOREAU O,et al.A synthetic alternative to canonical one-carbon metabolism[J].ACS Synthetic Biology,2017,6(8):1520-1533.DOI:10.1021/acssynbio.7b00029.
[79] 任杰,曾安平.基于二氧化碳的生物制造:从基础研究到工业应用的挑战[J].合成生物学,2021,2(06):854-862.DOI:10.12211/2096-8280.2021-086.
[80] MOHAN V S,MODESTRA J A,AMULYA K,et al.A circular bioeconomy with biobased products from CO2 sequestration[J].Trends in Biotechnology,2016,34(6):506-519.DOI:10.1016/j.tibtech.2016.02.012.
[81] WU Zaiqiang,WANG Junsong,ZHANG Xueli,et al.Engineering an electroactive Escherichia coli for the microbial electrosynthesis of succinate by increasing the intracellular FAD pool[J].Biochemical Engineering Journal,2019,146:132-142.DOI:10.1016/j.bej.2019.03.015.
[82] GANIGU R,PUIG S,BATLLE-VILANOVA P,et al.Microbial electrosynthesis of butyrate from carbon dioxide[J].Chemical Communications,2015,51(15):3235-3238.DOI:10.1039/c4cc10121a。
[83] SHARMA M,ARYAL N,SARMA P M,et al.Bioelectrocatalyzed reduction of acetic and butyric acids via direct electron transfer using a mixed culture of sulfate-reducers drives electrosynthesis of alcohols and acetone[J].Chemical Communications,2013,49(58):6495-6497.DOI:10.1039/c3cc42570c.
[84] VASSILEV I,HERNANDEZ P A,BATLLE-VILANOVA P,et al.Microbial electrosynthesis of isobutyric, butyric, caproic acids, and corresponding alcohols from carbon dioxide[J].ACS Sustainable Chemistry amp; Engineering,2018,6(7):8485-8493.DOI:10.1021/acssuschemeng.8b00739.
[85] BATLLE-VILANOVA P,GANIGU R,RAMI-PUJOL S,et al.Microbial electrosynthesis of butyrate from carbon dioxide: Production and extraction[J].Bioelectrochemistry,2017,117:57-64.DOI:10.1016/j.bioelechem.2017.06.004.
[86] JOURDIN L,WINKELHORST M,RAWLS B,et al.Enhanced selectivity to butyrate and caproate above acetate in continuous bioelectrochemical chain elongation from CO2: Steering with CO2 loading rate and hydraulic retention time[J].Bioresource Technology Reports,2019,7:100284.DOI:10.1016/j.biteb.2019.100284.
[87] ROGHAIR M,HOOGSTAD T,STEIK D P B T B,et al.Controlling ethanol use in chain elongation by CO2 loading rate[J].Environmental Science amp; Technology,2018,52(3):1496-1505.DOI:10.1021/acs.est.7b04904.
[88] KRACKE F,WONG A B,MAEGAARD K,et al.Robust and biocompatible catalysts for efficient hydrogen-driven microbial electrosynthesis[J].Communications Chemistry,2019,2(1):45(1-9).DOI:10.1038/s42004-019-0145-0.
[89] TAHIR K,MIRAN W,JANG J,et al.Enhanced product selectivity in the microbial electrosynthesis of butyrate using a nickel ferrite-coated biocathode[J].Environmental Research,2021,196:110907.DOI:10.1016/j.envres.2021.110907.
[90] THATIKAYALA D,MIN B.Copper ferrite supported reduced graphene oxide as cathode materials to enhance microbial electrosynthesis of volatile fatty acids from CO2[J].Science of The Total Environment,2021,768:144477(1-11).DOI:10.1016/j.scitotenv.2020.144477.
[91] SRIKANTH S,KUMAR M,SINGH D,et al.Long-term operation of electro-biocatalytic reactor for carbon dioxide transformation into organic molecules[J].Bioresource Technology,2018,265:66-74.DOI:10.1016/j.biortech.2017.12.075.
[92] MAY H D,EVANS P J,LABELLE E V.The bioelectrosynthesis of acetate[J].Current Opinion in Biotechnology,2016,42:225-233.DOI:10.1016/j.copbio.2016.09.004.
[93] LIU Wenzong,HUANG Shihching,ZHOU Aijuan,et al.Hydrogen generation in microbial electrolysis cell feeding with fermentation liquid of waste activated sludge[J].International Journal of Hydrogen Energy,2012,37(18):13859-13864.DOI:10.1016/j.ijhydene.2012.04.090.
[94] WANG Donglin,LIANG Qinjun,CHU Na,et al.Deciphering mixotrophic microbial electrosynthesis with shifting product spectrum by genome-centric metagenomics[J].Chemical Engineering Journal,2023,451:139010(1-9).DOI:10.1016/j.cej.2022.139010.
[95] VAN EERTEN-JANSEN M C A A,TER HEIJNE A,GROOTSCHOLTEN T I M,et al.Bioelectrochemical production of caproate and caprylate from acetate by mixed cultures[J].ACS Sustainable Chemistry amp; Engineering,2013,1(5):513-518.DOI:10.1021/sc300168z.
[96] TEO Weisuong,LING Hua,YU Aiqun,et al.Metabolic engineering of Saccharomyces cerevisiae for production of fatty acid short- and branched-chain alkyl esters biodiesel[J].Biotechnology for Biofuels,2015,8(1):1-9.DOI:10.1186/s13068-015-0361-5.
[97] JIA Yating,QIAN Danshi,CHEN Yuancai,et al.Intra/extracellular electron transfer for aerobic denitrification mediated by in-situ biosynthesis palladium nanoparticles[J].Water Research,2021,189:116612(1-12).DOI:10.1016/j.watres.2020.116612.
[98] JING Xinxin,WU Yichao,SHI Liang,et al.Outer membrane c-type cytochromes OmcA and MtrC play distinct roles in enhancing the attachment of Shewanella oneidensis MR-1 cells to goethite[J].Applied and Environmental Microbiology,2020,86(23):e01941-20.DOI:10.1128/AEM.01941-20.
[99] LABELLE E,MAY H.Energy efficiency and productivity enhancement of microbial electrosynthesis of acetate[J].Frontiers in Microbiology,2017,8:756(1-9).DOI:10.3389/fmicb.2017.00756.
[100] YANG Y,JI Z,ZHOU J,et al.Production of C2+ products in novel microbial electrosynthesis coupled with anaerobic membrane bioreactor[J].Chemical Engineering Journal,2023,476:146328.DOI: 10.1016/j.cej.2023.146328.
[101] SRIKANTH S,SINGH D,VANBROEKHOVEN K,et al.Electro-biocatalytic conversion of carbon dioxide to alcohols using gas diffusion electrode[J].Bioresource Technology,2018,265:45-51.DOI:10.1016/j.biortech.2018.02.058.
[102] LIU H X,SONG T S,FEI K Q,et al.Microbial electrosynthesis of organic chemicals from CO2 by Clostridium scatologenes ATCC 25775 T[J].Bioresources and Bioprocessing,2018,5:7.DOI:10.1186/S40643-018-0195-7.

