根蘖与嫁接繁殖灵武长枣不同时期果实差异表达基因分析
摘 要:【目的】研究灵武长枣根蘖繁殖与嫁接繁殖果实品质差异的内在机理,为提高其果实品质提供基础数据。【方法】以灵武长枣根蘖繁殖与嫁接繁殖白熟期(NB)、着色期(NZ)、成熟期(NC)和嫁接繁殖白熟期(JB)、着色期(JZ)、成熟期(JC)的果实为试验材料,采用高通量测序技术进行果实转录组测序,筛选与根蘖和嫁接繁殖的灵武长枣果实品质差异相关的基因,初步探究根蘖和嫁接繁殖灵武长枣果实不同时期基因表达差异情况。【结果】18个灵武长枣样品经过转录组测序,得到质控数据138.26 GB,将其比对到参考基因组冬枣上,18个样品的Cleans reads与参考基因组比对效率在93.77%以上。主成分分析结果显示,3次生物学重复样品聚集程度较高且组间存在分离现象,说明其基因表达量存在差异。差异分析结果表明,灵武长枣果实发育各时期组间分析对比中,果实白熟期(JB-vs-NB)、着色期(JZ-vs-NZ)和成熟期(JC-vs-NC)各组间分别筛选出65、4 509和1 534个差异基因。GO功能富集到生物过程、分子功能和细胞组分三大类中的50个亚类中,KEGG通路注释将差异基因显著富集在次生代谢物生物合成、代谢途径、氨基酸生物合成等通路中,成熟期差异基因富集在糖酸相关通路的显著性较高。【结论】在淀粉和蔗糖代谢、半乳糖代谢、氨基糖和核苷酸糖代谢,乙醛酸和二羧酸代谢、丁酸代谢5条与果实可溶性糖和总酸含量相关的代谢途径中筛选出了ncbi_107424266、ncbi_107414286、ncbi_107425230、ncbi_107429837等31个差异基因,分别在果实发育不同时期的糖酸代谢途径中差异表达,调控各时期果实中可溶性糖及总酸含量。
关键词:灵武长枣;根蘖繁殖;嫁接繁殖;差异基因
中图分类号:S727.3;S793.9 文献标志码:A 文章编号:1673-923X(2024)06-0030-13
基金项目:国家自然科学基金项目(32060338)。
Differential gene expression analysis of Lingwuchangzao jujube fruit at different stages of root tiller and grafting reproduction
YANG Rong1, LIU Jiajia1, LI Xueni1, YU Ruili2, MA Yuan1
(1. College of Forestry and Prataculture, Ningxia University, Yinchuan 750021, Ningxia, China; 2. Ningxia Wolfberry Industry Development Center, Yinchuan 750000, Ningxia, China)
Abstract:【Objective】The differences in the internal mechanism of fruit quality between root tiller reproduction and grafting reproduction of ‘Lingwuchangzao’ jujube were studied to provide basic research for improving its fruit quality.【Method】The fruits of‘Lingwuchangzao’ jujube root tiller reproduction and grafting reproduction at white maturity stage (NB), coloring stage (NZ), maturity stage (NC) and grafting reproduction at white maturity stage (JB), coloring stage (JZ) and maturity stage (JC) were used as experimental materials. High-throughput sequencing technology was used to sequence the fruit transcriptome. The differential genes related to the quality difference of ‘Lingwuchangzao’ jujube fruit of root tiller and grafting reproduction were screened, and the gene expression differences of the fruit of root tiller and grafting reproduction at different stages were preliminarily explored.【Result】The 18‘Lingwuchangzao’ jujube samples were subjected to transcriptome sequencing to obtain 138.26 GB of quality control data, which were aligned to the reference genome winter jujube. The cleans reads of the 18 samples were aligned with the reference genome. The efficiency was above 93.77%. The principal component analysis results showed that the three biological repeat samples had a higher degree of aggregation, and there was a separation phenomenon between the groups, indicating that there were differences in gene expression. After the difference analysis, the results showed that in the analysis and comparison of the fruit development of ‘Lingwuchangzao’ jujube in each period, 65, 4 509 and 1 534 differentially expressed genes were screened out in the white ripening period (JB-vs-NB), coloring period (JZ-vs-NZ) and ripening period (JC-vs-NC), respectively. The GO function was enriched into 50 subcategories of three categories: biological process, molecular function and cellular component. The KEGG pathway annotation significantly enriched the differentially expressed genes in secondary metabolite biosynthesis, metabolic pathway, amino acid biosynthesis and other pathways. The differentially expressed genes in mature stage were significantly enriched in sugar and acid related pathways.【Conclusion】Among five metabolic pathways related to fruit soluble sugar and total acid content, starch and sucrose metabolism, galactose metabolism, amino sugar and nucleotide sugar metabolism, glyoxylic acid and dicarboxylic acid metabolism, and butyric acid metabolism, 31 differential genes such as ncbi_107424266, ncbi_107414286, ncbi_107425230, ncbi_107429837 were screened out, which were differentially expressed in the sugar and acid metabolic pathways at different stages of fruit development, regulating the soluble sugar and total acid content in fruits at different stages.
Keywords: Lingwuchangzao jujube; root tiller reproduction; grafting propagation; differential genes
灵武长枣是宁夏重要的经济林树种,是优秀的鲜食枣品种,其果皮颜色鲜艳、口感脆甜多汁、营养丰富,受到广大消费者的青睐[1]。随着灵武长枣产业的蓬勃发展,消费者对于灵武长枣的果实品质也提出了更高要求[2]。在实际生产中,灵武长枣以传统的根蘖繁殖和嫁接繁殖2种方式为主进行繁殖[3]。根蘖繁殖可以保持母树抗旱、耐盐碱等优良遗传性状,但所生产的根蘖苗数量有限[4],生长速度缓慢;而嫁接繁殖的灵武长枣植株生长快、树势强、结果早[5],适宜于大规模发展。然而生产及研究中均发现嫁接苗的枣果风味及营养品质不如根蘖苗,2种繁殖方式各有优劣,在生产中都有广泛的应用[6-7]。
近年来,随着分子生物学研究技术在各个领域的广泛应用,对于枣树各器官的差异性研究不再局限于物候期[8-9]、土壤养分[10-11]及叶片光合[12-13]等生长表现上,在分子水平上的研究也越来越多。包括基于RNA-Seq分析鉴定枣果皮颜色相关差异基因[14]、对成熟期的灵武长枣果实进行转录组测序筛选到调控果实糖酸的关键差异基因[15]等研究,但未见对不同繁殖方式下,不同时期枣果实基因表达差异研究。
本研究采集3个发育时期的灵武长枣果实提取RNA,采用高通量转录组测序技术,比较2种繁殖方式下果实基因序列的差异,筛选与根蘖和嫁接繁殖的灵武长枣果实品质差异相关的差异基因,初步探究根蘖和嫁接繁殖灵武长枣果实营养品质和基因表达差异情况,以期为后续探明2种繁殖方式的灵武长枣果实品质差异调控机理提供基础研究参考。
1 试验材料与方法
1.1 试验地概况
试验地位于宁夏灵武市千亩设施果业基地(106°15′04″E,38°04′22″N),海拔1 115 m,该地气候类型为大陆性季风气候,年平均气温8.8 ℃,年降水量206.2~255.2 mm。
1.2 试验材料
本试验供试样树为8年生灵武长枣根蘖植株和以酸枣为砧木的灵武长枣嫁接植株(嫁接时间一致),根蘖植株平均地径83 mm、树高2.45 m、冠幅2.51 m×2.42 m,嫁接植株平均地径8.9 cm、树高2.63 m、冠幅2.53 m×2.49 m。分别选取5株生长基本一致、无病虫害的灵武长枣根蘖植株和嫁接植株进行果实采集,在灵武长枣果实白熟期、着色期和成熟期时,每株采集5颗果实,各时期每个处理得到25颗果实,混合后作为试验材料。
1.3 高通量测序及数据分析
对所得到的试验材料进行随机取样,并设置3个生物学重复,共18个样品。将样品送至广州基迪奥生物科技有限公司进行测序。样品编号分别为灵武长枣嫁接植株不同时期果实(JB、JZ、JC),灵武长枣根蘖植株不同时期果实(NB、NZ、NC)。基于Illumina Novaseq 6000测序平台,对样品的所有mRNA进行测序,采用 Illumina Truse qTM RNA sample prep Kit方法进行文库构建。对转录组测序产生的原始数据进行质量监控,经过滤后得到高质量的Clean reads,利用Trinity软件对得到的Clean Reads进行拼接组装,将测序数据以冬枣基因组为参考基因组进行比对、注释。利用R语言DESeq数据包筛选差异表达的基因,以FPKM=1为基因表达标准,以FDR<0.05、|log2 FC|>log2 (2)作为差异基因筛选条件。利用Kyoto Encyclopedia of Genes and Genomes(https:// www.genome.jp/kegg/)和The Gene Ontology Resource(http://gene ontology.org/)数据库对差异基因进行注释,利用R语言完成GO和KEGGpathway显著性富集分析。
2 结果与分析
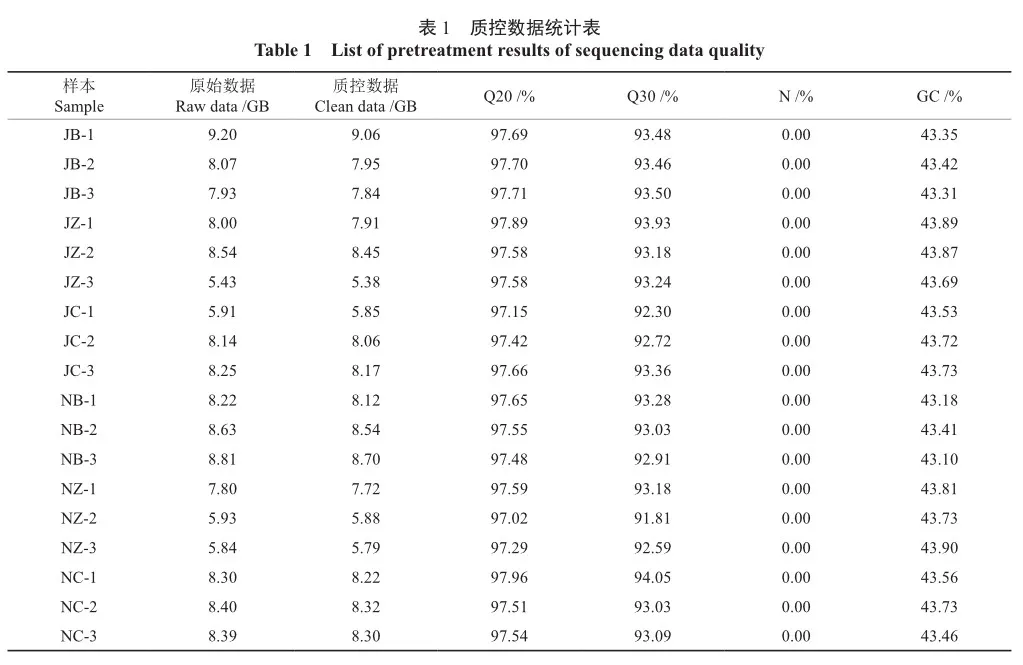
2.1 转录组数据质量检测
经过转录组测序、原始数据净化和质量过滤,从18个灵武长枣样品中共获得138.26 GB数据(表1)。测序质量在99%和99.9%以上的碱基占总碱基的百分比(Q20、Q30)分别在97.02%和91.81%以上,GC碱基含量(GC content)为43.10%~43.90%,且单个碱基位置的测序错误率小于1%,说明根蘖与嫁接繁殖的灵武长枣果实各时期转录组的测序质量较高,数据可靠,可用于下一步数据分析。
将根蘖与嫁接繁殖的灵武长枣测序数据比对到参考基因组冬枣(NCBI_GCF_020796205.1)上,18个样品的Clean reads与参考基因组的比对效率(Total mapped)为93.77%~95.10%(表2),比对到参考基因组唯一位置的reads为89.73%~91.10%,2种繁殖方式的灵武长枣果实与参考基因组的匹配率都较高,证明选择的参考基因组能够为本次分析试验提供正确可靠的背景信息。
基于表达量信息,利用R语言开展主成分分析(Principal component analysis,PCA),研究样本间的距离关系。如图1所示,主成分PC1的贡献率为93.4%,主成分PC2的贡献率为3.3%。3次生物学重复的样本聚集程度较高,表明不同重复间转录组数据的高度重现性和试验数据的可靠性,且不同组间存在良好的分离现象,说明3个生长发育时期基因表达量存在差异,为下一步试验奠定基础。
2.2 根蘖与嫁接繁殖灵武长枣不同时期差异基因表达量分析
不同发育时期灵武长枣果实差异基因表达量结果显示(图2),2种繁殖方式的果实在白熟期(JB-vs-NB)的对比中共筛选到65个差异基因,其中上调表达的基因30个,下调表达的基因35个;着色期(JZ-vs-NZ)相比,得到4 509个差异表达的基因,其中上调基因2 892个,下调基因1 617个;成熟期(JC-vs-NC)处理相比,筛选到1 534个差异基因,包括677个上调基因,857个下调基因。
通过绘制不同发育时期灵武长枣果实差异基因表达量韦恩图(图3)发现,根蘖与嫁接繁殖的灵武长枣果实在白熟期(JB-vs-NB)有39个差异基因特异表达,着色期(JZ-vs-NZ)有3 938个差异基因特异表达,成熟期(JC-vs-NC)有976个差异基因特异表达。根蘖与嫁接繁殖灵武长枣果实发育3个时期筛选出的共有差异基因有7个(表3),分别是MSTRG.1546、MSTRG.21442、MSTRG.9423、ncbi_107404917、ncbi_107423910、ncbi_107426831和ncbi_125420622,7个差异基因目前未明确注释在KEGG途径中,其中 ncbi_107426831和ncbi_125420622由RAV转录因子调控表达量,相关研究表明RAV转录因子在植物生长发育和抗逆反应调控中起着重要作用[16]。


2.3 根蘖与嫁接繁殖灵武长枣不同时期差异基因GO功能富集分析
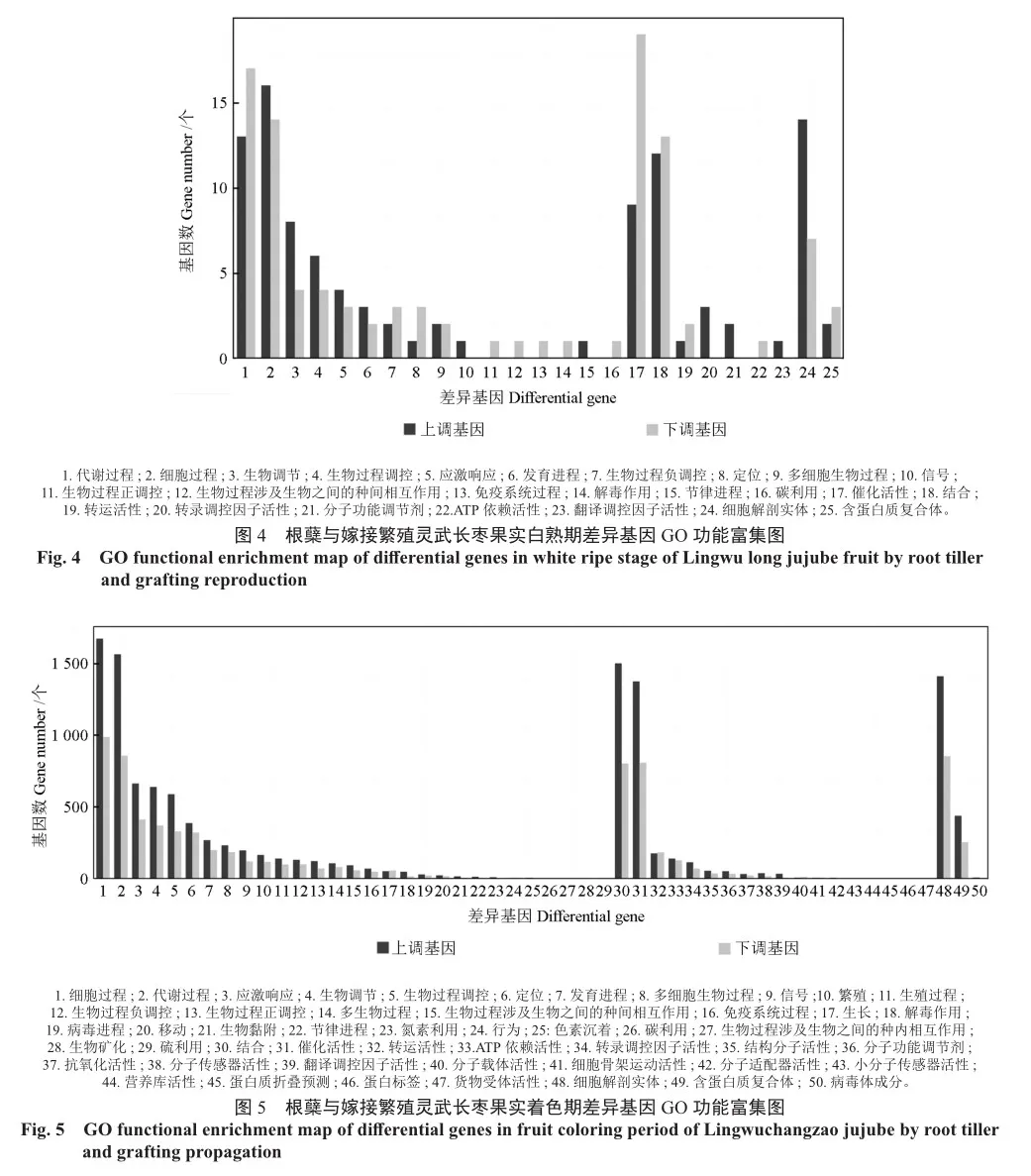
根据根蘖与嫁接繁殖灵武长枣果实发育不同时期差异基因GO功能富集的结果显示(图4~6),3个时期差异基因均注释到生物过程、分子功能、细胞组分3个类别中,白熟期(JB-vs-NB)、着色期(JZ-vs-NZ)、成熟期(JC-vs-NC)在GO数据库中分别鉴定出203、20 312、7 176个差异基因。在生物过程大类中,白熟期(JB-vs-NB)差异基因主要注释在细胞过程、代谢过程、刺激反应、生物调节、生物过程调节、定位、发育过程等16个亚类中;着色期(JZ-vs-NZ)差异基因注释在29个条目中;成熟期(JC-vs-NC)差异基因主要注释有27个条目。在分子功能大类中,JB和NB组差异基因主要注释在结合、催化活性、转运活性、ATP依赖性活性、转录调节因子活性、结构分子活性等7个亚类中,JZ和NZ组差异基因注释在18个条目中,JC和NC组中差异基因注释在15个条目中;在细胞组分大类中,JB和NB组注释到细胞结构实体和含蛋白质复合体2个亚类中,分别有21和5个差异基因,JZ和NZ、JC和NC注释在3个亚类中,包括细胞结构实体、含蛋白质复合体和病毒体成分。


2.4 根蘖与嫁接繁殖灵武长枣不同时期差异基因KEGG富集分析
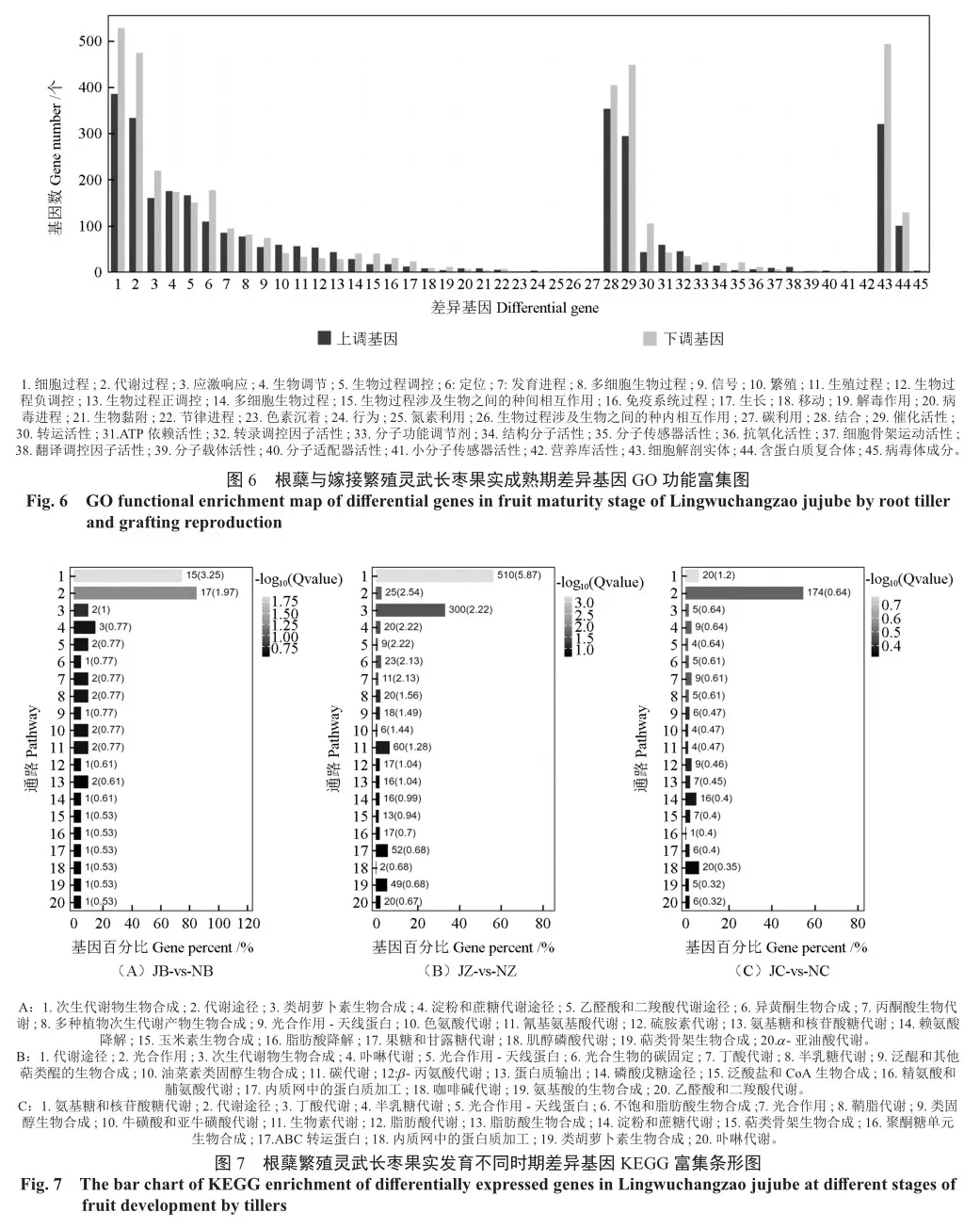
对根蘖与嫁接繁殖灵武长枣不同时期的差异基因进行KEGG富集分析,结果表明,白熟期(JB-vs-NB)(图7A)差异基因主要富集在次生代谢物生物合成、代谢途径、类胡萝卜素生物合成、淀粉和蔗糖代谢、乙醛酸和二羧酸代谢等通路中,着色期(JZ-vs-NZ)(图7B)差异基因主要富集在代谢途径、光合作用、次生代谢物生物合成、卟啉代谢等通路中,其中参与代谢途径的基因数量最多(510个),占比56.6%;成熟期(JC-vs-NC)(图7C)差异基因主要富集在氨基糖和核苷酸糖代谢(20,6.29%)、代谢途径(174,54.72%)、丁酸代谢(5,1.57%)、半乳糖代谢(9,2.83%)等通路中。
2.5 果实品质形成相关的主要差异基因筛选
根据根蘖与嫁接繁殖灵武长枣果实发育白熟期、着色期和成熟期的差异基因KEGG通路富集结果,差异显著性较强的与果实可溶性糖和总酸含量密切相关的途径有淀粉和蔗糖代谢(Starch and sucrose metabolism,ko 00500)、半乳糖代谢(Galactose metabolism,ko 01187)、氨基糖和核苷酸糖代谢(Amino sugar and nucleotide sugar metabolism,ko 13648)、乙醛酸和二羧酸代谢(Glyoxylate and dicarboxylate metabolism,ko 00630)、丁酸代谢(Butanoate metabolism,ko 00650)。本研究以这5条作为主要关注通路,根蘖与嫁接繁殖灵武长枣果实发育白熟期、着色期和成熟期3个时期分别有不同数量差异基因注释在5条相关通路上,各通路之间互相作用、相互影响,共同构成了根蘖与嫁接繁殖灵武长枣果实品质差异的复杂网络调控机制。本研究选取各通路中差异倍数排序前五的差异基因进行展示。
2.5.1 果实发育白熟期
根蘖与嫁接繁殖灵武长枣果实发育白熟期对比,差异基因相对着色期和成熟期较少,富集在淀粉和蔗糖代谢、氨基糖和核苷酸糖代谢、乙醛酸和二羧酸代谢这3条通路中的差异基因数共7个。其中在淀粉和蔗糖代谢通路中有ncbi_107410850和ncbi_107424266两个上调基因差异表达,差异倍数分别是2.18和2.66。ncbi_107412669基因下调表达,差异倍数为4.82。氨基糖和核苷酸糖代谢通路中有ncbi_107424266一个差异基因上调表达,差异倍数为2.66倍,ncbi_107404967基因下调表达,差异倍数为34.80;乙醛酸和二羧酸代谢通路中有1个差异基因ncbi_107417353上调表达, 1个差异基因ncbi_107415024下调表达,差异倍数分别是2.33和6.67倍。总体上,根蘖与嫁接繁殖果实发育白熟期可溶性糖含量相关的2条主要途径中有3个差异基因上调表达,2个基因下调表达,与总酸含量相关的1条通路中上调基因数和下调基因数均为1个。

2.5.2 果实发育着色期
根蘖与嫁接繁殖灵武长枣果实发育着色期注释在可溶性糖和总酸相关的5条通路中的有25个差异基因,与可溶性糖相关的上调表达基因有4个,下调表达基因有11个,与总酸相关的上调表达基因有5个,下调表达基因有5个。在淀粉和蔗糖代谢途径中,ncbi_107430563和ncbi_107432082两个基因上调表达,差异倍数分别为31.19、20.03。基因ncbi_107409332、ncbi_107430302、ncbi_112491050下调表达,差异倍数分别是19.83、22.79、28.57;在半乳糖代谢途径中,仅ncbi_107432082基因上调表达,其余4个基因均下调表达;在氨基糖和核苷酸糖代谢途径中,1个基因上调表达,4个基因下调表达,差异倍数为4.51~19.83,在乙醛酸和二羧酸代谢途径中,基因ncbi_107405417、ncbi_107433052和ncbi_107423244上调表达,差异倍数分别是3.38、3.54、5.78,基因ncbi_107415024和ncbi_ 107429892下调表达,差异倍数分别是3.99、3.37;丁酸代谢途径中,2个基因上调表达,差异倍数分别是3.18、3.30,3个基因下调表达,差异倍数最高为4.24。
2.5.3 果实发育成熟期
根蘖与嫁接繁殖灵武长枣果实发育成熟期在可溶性糖和总酸相关的5条通路中注释的差异基因共有18个。与可溶性糖相关的上调表达基因有4个,下调表达基因有8个,与总酸相关的上调表达基因有1个,下调表达基因5个。淀粉和蔗糖代谢途径中基因ncbi_125422819上调表达,差异倍数为5.51,4个差异基因下调表达,差异倍数最高为6.62;在半乳糖代谢途径中,2个基因ncbi_107418468、ncbi_125422819均为上调表达,差异倍数分别是2.85、5.51;氨基糖和核苷酸糖代谢途径中仅1个基因ncbi_112492524上调表达,其余4个基因均下调表达,差异倍数最高为7.49;乙醛酸和二羧酸代谢途径中仅有1个基因ncbi_107415818下调表达,差异倍数为2.16;丁酸代谢途径中1个差异基因ncbi_107423578上调表达,4个差异基因下调表达,差异倍数为2.00~6.07。
2.5.4 3个时期差异表达基因对比
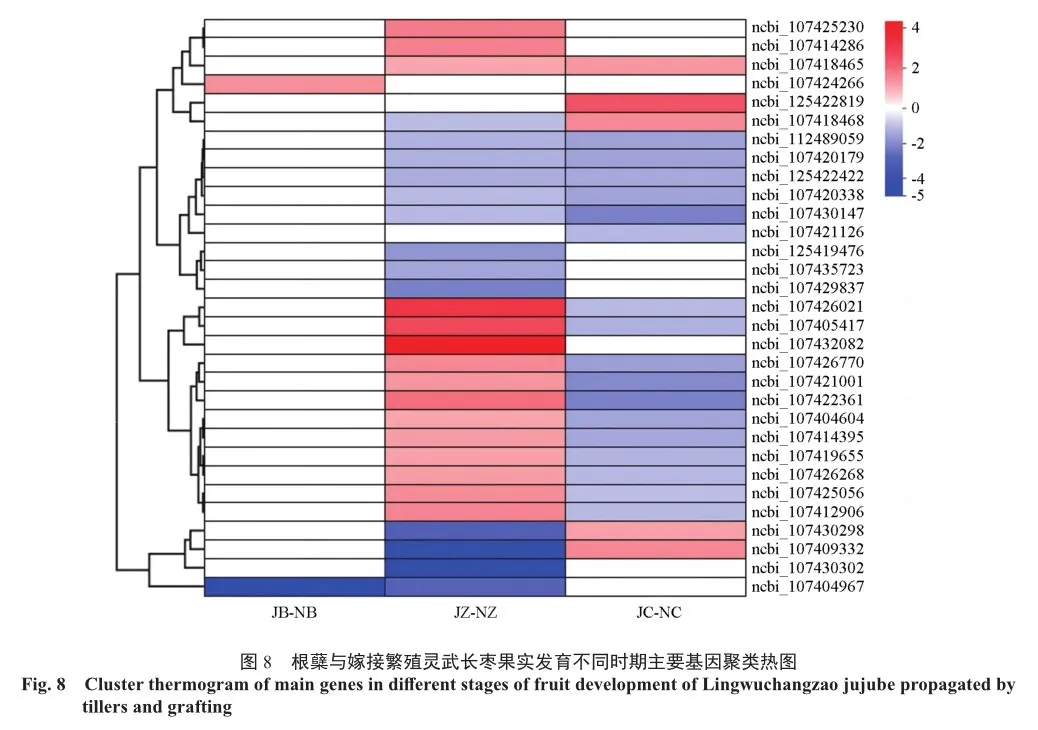
在根蘖与嫁接繁殖灵武长枣果实发育白熟期、着色期和成熟期差异基因对比(图7)中发现,与可溶性糖有关的淀粉和蔗糖代谢、半乳糖代谢、氨基糖和核苷酸糖代谢,与总酸含量相关的乙醛酸和二羧酸代谢、丁酸代谢5条途径中,共有31个差异基因在果实发育不同时期或同一时期不同途径中均有富集,其中与可溶性糖相关的有28个差异基因,与总酸相关的有3个差异基因,并对这31个差异基因进行blast分析。
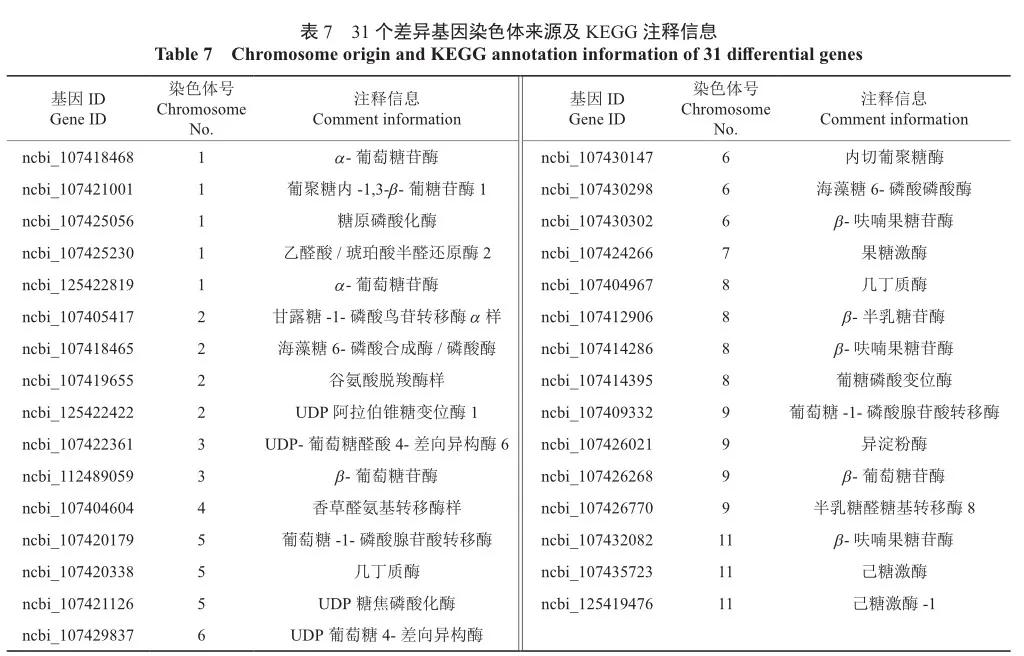
31个差异基因blast分析结果(表7)表明,ncbi_ 107425230、ncbi_125422819、ncbi_107418468等5个差异基因分布在参考基因组冬枣的1号染色体上,ncbi_107405417、ncbi_107418465等4个基因分布在2号染色体上,ncbi_107422361、ncbi_112489059分布在3号染色体,ncbi_107404604分布在4号染色体上,ncbi_107420179等3个基因分布在5号染色体上,ncbi_107429837、ncbi_107430147等4个基因分布在6号染色体上,ncbi_107424266分布在7号染色体上,ncbi_107412906、ncbi_107404967等4个基因位于8号染色体上,ncbi_107409332、ncbi_107426021等4个基因位于9号染色体上,ncbi_107432082、ncbi_107435723等3个基因位于参考基因组冬枣11号染色体上。
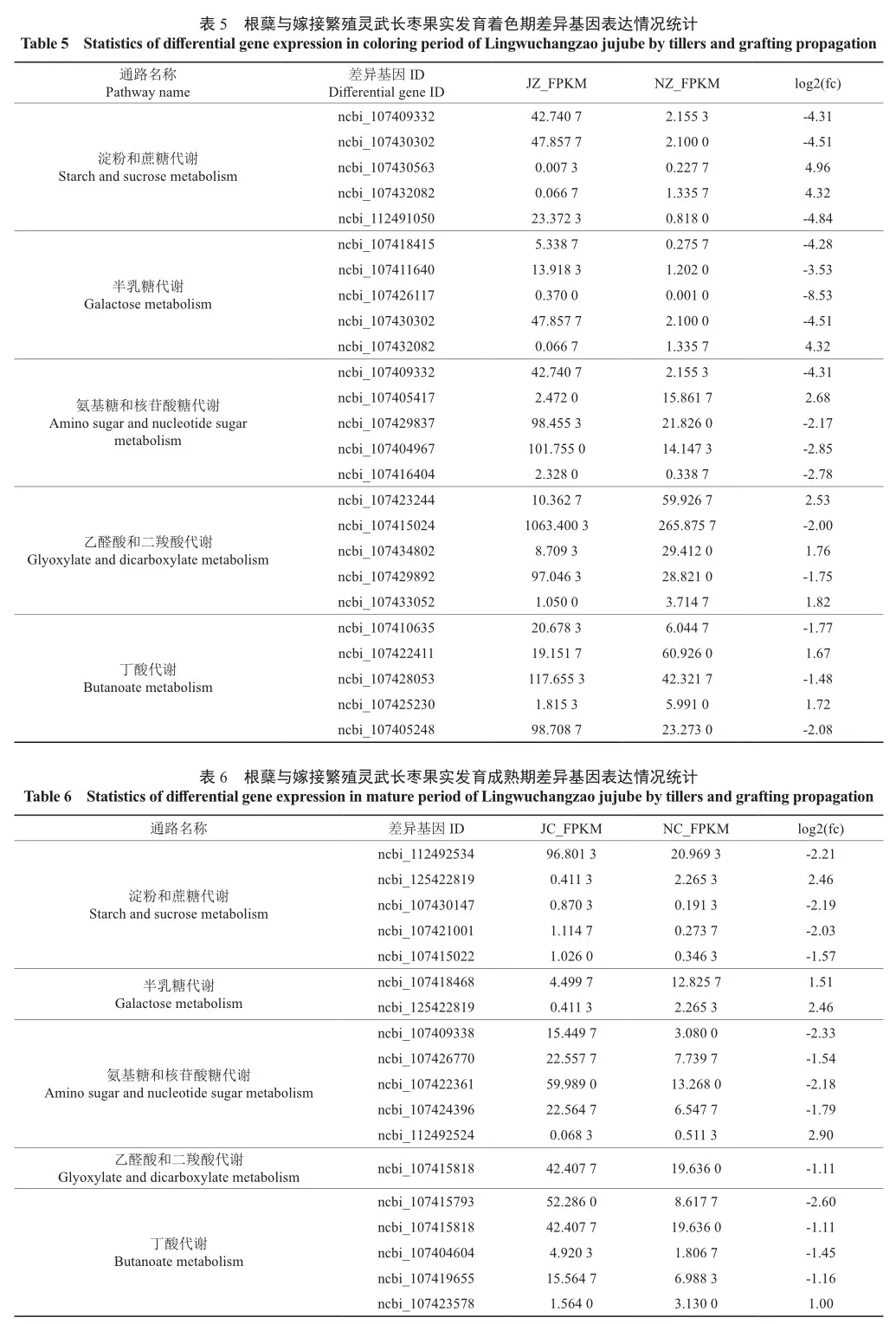
在根蘖与嫁接繁殖灵武长枣果实发育白熟期,基因ncbi_107424266同时富集在淀粉和蔗糖代谢、氨基糖和核苷酸糖代谢2条途径中;着色期有ncbi_107414286、ncbi_107425230、ncbi_ 107429837等7个基因同时富集在淀粉和蔗糖代谢、半乳糖代谢、氨基糖和核苷酸糖代谢等途径中的至少2条途径中。其中与可溶性糖有关的有6个差异基因,仅1个差异基因ncbi_107425230与总酸含量相关。着色期和成熟期富集在2条以上糖酸相关途径中的差异基因共有ncbi_107409332、ncbi_107414395、ncbi_107418468和ncbi_ 107420179,2个时期共同存在差异仅富集在单条途径上的差异基因有ncbi_107405417、ncbi_ 107412906、ncbi_107418465等16个,其中14个富集在可溶性糖含量相关途径上,2个基因ncbi_ 107404604和ncbi_107419655富集在丁酸代谢途径中;果实成熟期ncbi_125422819富集在淀粉和蔗糖代谢、半乳糖代谢2条途径中,ncbi_107421126同时富集在半乳糖代谢和氨基糖和核苷酸糖代谢途径中。果实发育白熟期和成熟期无共同富集的差异基因。
3 讨 论
目前开展了一些灵武长枣转录组方面的研究,但转录组信息仍比较少,并缺少不同时期灵武长枣果实转录组信息。本研究发现根蘖和嫁接2种繁殖方式下的灵武长枣果实各发育时期间存在大量的差异表达基因,并且上、下调基因数量不等,表明果实在成熟过程中上、下调基因在基因差异表达中的促进或抑制作用复杂。果实白熟期差异表达基因较少,着色期和成熟期差异表达基因增加。本研究中主要关注与果实中可溶性糖和总酸含量相关的代谢途径,在淀粉和蔗糖代谢、半乳糖代谢、氨基糖和核苷酸糖代谢、乙醛酸和二羧酸代谢、丁酸代谢5条途径中筛选出了31个差异基因,为下一步探究根蘖和嫁接繁殖灵武长枣果实不同发育期糖酸等营养物质含量的分子调控机制提供基础数据。
马亚平等[15]研究了根蘖和嫁接灵武长枣成熟果实转录组之间的差异,共分析筛选出27个显著差异表达基因,其中9个显著上调,18个显著下调;GO富集分析结果表明15个差异基因显著富集到GO的三大功能类别分子功能、细胞组分、生物过程中;KEGG富集分析结果表明10个差异表达基因显著富集到12条代谢通路中,其中包括3个上调基因和7个下调基因。进一步筛选出调控糖及有机酸代谢关键差异基因BAM1、PCO和HAOX1在淀粉和蔗糖代谢、牛胆素和亚牛磺酸代谢、乙醛酸和二羧酸代谢中显著表达,并在糖和有机酸的相互转化中起着关键调控作用,其中,BAM1注释信息为β-淀粉酶,PCO注释信息为半胱氨酸氧化酶,HAOX1注释信息为羟基酸氧化酶,均未在本研究中出现。
苏媚等[17]以同一果园不同砧木的8年生嫁接香橙、红桔和枳砧鲍威尔脐橙成熟果实作为试验材料,分析其生理和生化指标及糖酸代谢相关基因的表达情况。结果表明,砧木对可食率、可滴定酸含量及果皮色泽均无明显影响,但对脐橙果实的单果质量、果皮厚度、可溶性固形物含量、维生素C含量、可溶性糖含量和有机酸含量存在较大影响。香橙砧脐橙的单果质量和果皮厚度显著大于枳砧脐橙。红桔砧脐橙果肉中糖、酸的含量均显著低于香橙砧和枳砧脐橙。其分子机理是红桔砧脐橙果肉中蔗糖转运蛋白基因CsSUC1和CsSC4表达量低,糖酵解途径关键酶之一的丙酮酸激酶基因CsPKP3表达量高;柠檬酸合成酶CsCS2表达量较低,柠檬酸降解酶谷氨酸脱羧酶基因CsGDH1和谷氨酰胺合成酶基因Cs-GH1表达量高。类似的研究也表明,葡萄和苹果都有几个MYB转录因子参与果皮花色素苷的生物合成,有时也与 b HLH和WD40相互影响[18]。在对“泰山红”和“牡丹”2个石榴品种成熟期果实转录组的研究中发现,鉴定出参与石榴果实糖酸代谢的关键基因有17个,‘泰山红’中FRK、SS、BGLU、UXS、FBA和ADH基因的表达量高于‘牡丹’[19]。石榴果实中,葡萄糖和果糖是主要的糖组分,酸以柠檬酸和苹果酸为主,差异基因在糖酸代谢中如何调控还需进一步研究。
植物细胞转录表达后,涉及转录后修饰[20]、蛋白质翻译[21]、翻译后修[22-23]的过程,转录结果才能在代谢水平上呈现。转录组是基因表达的媒介,而代谢组反映细胞表型和功能的变化[24]。本研究中主要对根蘖与嫁接繁殖的灵武长枣在果实发育时期存在的差异基因进行了初步探究,其在代谢物水平也可能存在一定差异,后续研究中可以进一步探讨代谢物水平的异同之处,并可分析其代谢调控的分子机制。
4 结 论
基于转录组测序技术,根蘖与嫁接繁殖灵武长枣果实发育各时期组间分析对比中,果实白熟期(JB-vs-NB)、着色期(JZ-vs-NZ)、成熟期(JC-vs-NC)各组间分别鉴定出65、4 509和1 534个差异基因。GO功能富集到生物过程、分子功能和细胞组分三大类中的50个亚类中,KEGG通路注释将差异基因显著富集在次生代谢物生物合成、代谢途径和氨基酸生物合成等通路中,成熟期差异基因富集在糖酸相关通路的显著性较高。
根蘖与嫁接繁殖灵武长枣果实发育白熟期、着色期和成熟期果实在淀粉和蔗糖代谢、半乳糖代谢、氨基糖和核苷酸糖代谢、乙醛酸和二羧酸代谢、丁酸代谢5条与果实可溶性糖和总酸含量相关的代谢途径中筛选出了ncbi_107424266、ncbi_107414286、ncbi_107425230、ncbi_107429837等31个差异基因,分别在果实发育不同时期的糖酸代谢途径中差异表达,调控各时期果实中可溶性糖及总酸含量。
参考文献:
[1] 李百云,李慧.灵武长枣早熟优系选育[J].果树资源学报, 2021,2(6):81-86. LI B Y, LI H. Breeding of early maturing superior lines of Lingwu long jujube[J]. Journal of Fruit Tree Resources,2021,2(6):81-86.
[2] 院钦,张欣,任玉锋,等.冷棚栽培对灵武长枣果实品质的影响[J].中国南方果树,2023,52(5):170-174. YUAN Q, ZHANG X, REN Y F, et al. Effect of cold shed cultivation on fruit quality of Lingwu long jujube[J]. South China Fruits Trees,2023,52(5):170-174.
[3] 李振强,马旭,田应明,等.不同施氮量对灵武长枣各发育阶段果实品质的影响[J].经济林研究,2022,40(4):124-132. LI Z Q, MA X, TIAN Y M, et al. Effects of different nitrogen rates on fruit quality of Lingwuchangzao at different developmental stages[J]. Non-wood Forest Research,2022,40(4):124-132.
[4] ZHANG Z, WEI T J, ZHONG Y, et al. Construction of a highdensity genetic map of Ziziphus jujuba Mill. using genotyping by sequencing technology[J]. Tree Genetics Genomes,2016, 12(4):76.
[5] GAIKWAD S P, CHALAK S U, KAMBLE A B. Effect of spacing on growth, yield and quality of mango[J]. Journal of Krishi Vigyan,2017,5(2):50-53.
[6] 万仲武,芮长春,张治业.灵武长枣物候期与气温和地温的关系研究[J].北方园艺,2013(15):47-50. WAN Z W, RUI C C, ZHANG Z Y. Study on relationship between phonological period and air temperature, soil temperature of Zizyphus jujube Mill cv. Lingwuchangzao[J]. Northern Horticulture,2013(15):47-50.
[7] 纪晴,石倩倩,徐世宏,等.枣产品开发现状及未来趋势研究[J].农村经济与科技,2015,26(7):11-12,20. JI Q, SHI Q Q, XU S H, et al. Research on the current situation and future trend of jujube product development[J]. Rural Economy of Science and Technology,2015,26(7):11-12,20.
[8] 陈丽华,杨喜盟,贾昊,等.气温升高与干旱对灵武长枣果实糖积累、蔗糖代谢关键酶及相关基因表达的影响[J].核农学报,2020,34(9):2112-2123. CHEN L H, YANG X M, JIA H, et al. Effects of elevated temperature and drought on sugar accumulation, key sucrose enzymes metabolism and related gene expression in fruit of jujube cultivar Lingwuchangzao[J]. Journal of Nuclear Agricultural Sciences,2020,34(9):2112-2123.
[9] BI X Y, LIAO L, DENG L J, et al. Combined transcriptome and metabolome analyses reveal candidate genes involved in Tangor(Citrus reticulate×Citrus sinensis) fruit development and quality formation[J]. Molecular Sciences,2022,23(10):5457.
[10] 李振强.根蘖与嫁接繁殖对灵武长枣生长、叶片性状及根系生长的影响[D].银川:宁夏大学,2022. LI Z Q. Effects of tiller propagation and graft propagation on growth, leaf traits and root growth of ‘Lingwuchangzao’[D]. Yinchuan: Ningxia University,2022.
[11] 刘丰鸣,黄瑶,刘伟锋,等.施肥对阿克苏地区骏枣园土壤、叶片养分及枣果品质的影响[J].经济林研究,2023,41(1): 106-116. LIU F M, HUANG Y, LIU W F, et al. Effect of fertilization on soil nutrients, leaf nutrients and fruit quality of Jun jujube inAksu[J]. Non-wood Forest Research,2023,41(1):106-116.
[12] KRONER G M, THOMAS R L, JOHNSON-DAVIS K L. Retrospective analysis of pediatric and adult populations using an LC-MS/MS method for Oxcarbazepine /Eslicarbazepine metabolite[J]. The Journal of Applied Laboratory Medicine,2020,6(3): 637-644.
[13] 禹瑞丽,刘佳嘉,吴国伟,等.灵武长枣根蘖苗与嫁接苗叶片光合特性的比较[J].中南林业科技大学学报,2023,43(9):70-79. YU R L, LIU J J, WU G W, et al. Comparison of photosynthetic characteristics between the root tiller seedlings and grafted seedlings of Ziziphus jujube ‘Lingwuchangzao’[J]. Journal of Central South University of Forestry Technology,2023,43(9): 70-79.
[14] 韩雅茹.气温升高与干旱互作下灵武长枣果皮花青苷合成的代谢调控机制[D].银川:宁夏大学,2023. HAN Y R. Metabolic regulation mechanism of anthocyanin synthesis in the pericarp of Zipiphus jujuba Mill cv.‘Lingwuchangzao’ under interaction of elevated temperature and drought stress[D]. Yinchuan: Ningxia University,2023.
[15] 马亚平,白琳云,徐伟荣,等.灵武长枣嫁接和根蘖繁殖植株果实转录组差异分析[J].分子植物育种,2021,19(16):5297-5306. MA Y P, BAI L Y, XU W R, et al. Transcriptome differences analysis of fruit of grafting and root tiller propagation of‘Lingwuchangzao’ jujube[J]. Molecular Plant Breeding,2021,19(16): 5297-5306.
[16] ZHANG C W, WANG X Y, LI H W, et al. GLRaV-2 protein p24 suppresses host defenses by interaction with a RAV transcription factor from grapevine[J]. Plant Physiology,2022,189(3): 1848-1865.
[17] 苏媚,伊华林.砧木对脐橙果实品质及糖酸代谢相关基因表达的影响[J].中国南方果树,2016,45(5):34-37. SU M, YI H L. Effects of rootstocks on fruit quality and expression of genes related to sugar and acid metabolism in navel orange[J]. South China Fruits,2016,45(5):34-37.
[18] 程娇.MeSA处理调控桃形李采后果实花色苷合成代谢的研究[D].浙江:浙江工商大学,2022. CHENG J. MeSA regulates anthocyanin anabolism in postharvest taoxingli plum[D]. Hangzhou: Zhejiang Gongshang University,2022.
[19] 冯立娟,付莹,王传增,等.基于RNA-Seq鉴定不同石榴品种间果实糖酸代谢基因[J].植物生理学报,2022,58(6):1161-1172. FENG L J, FU Y, WANG C Z, et al. Identification of sugar and acid metabolism genes in different pomegranate (Punica granatum) cultivars based on RNA-Seq[J]. Plant Physiology Journal,2022,58(6): 1161-1172.
[20] CHAUDHARY S, JABRE I, REDDY A S N, et al. Perspective on alternative splicing and proteome complexity in plants[J]. Trends in Plant Science,2019,24(6):496-506.
[21] KWANUK L, HUNSEUNG K. Emerging roles of RNA-binding proteins in plant growth, development, and stress responses[J]. Molecules and Cells,2016,39(3):179-185.
[22] WASZCZAK C, AKTER S, JACQUES S, et al. Oxidative posttranslational modifications of cysteine residues in plant signal transduction[J]. Journal of Experimental Botany,2015,66(10): 2923-2934.
[23] XU S L, CHALKLEY R J, MAYNARD J C, et al. Proteomic analysis reveals O-GlcNAc modification on proteins with key regulatory functions in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America,2017,114(8): 1536-1543.
[24] 蔡净蓉,王杰,赵俊跃,等.成熟期不同橄榄品种(系)果实代谢组及其差异[J].热带作物学报,2022,43(11):2304-2315. CAI J R, WANG J, ZHAO J Y, et al. Metabolomics and its difference of Chinese olive fruit of different varieties (lines) during the ripening period[J]. Journal of Tropical Crops,2022,43(11): 2304-2315.
[本文编辑:吴 彬]

