汝州市犬细小病毒的PCR检测及VP2基因序列分析


摘" 要:为了解汝州市犬细小病毒的流行和变异情况,本研究调查了汝州市3家动物诊所接诊的20例疑似感染犬细小病毒病例。PCR结果显示,15份样本为犬细小病毒阳性。VP2蛋白氨基酸序列分析结果显示:12株犬细小病毒的基因亚型为CPV-2c,3株犬细小病毒的基因亚型为CPV-2a;分离得到的15株犬细小病毒其氨基酸序列同源性为99.1%~100.0%,与疫苗株的同源性为97.5%~98.6%,与其他国内外参考毒株的同源性为98.0%~100.0%;分离的12株CPV-2c型毒株与我国广西等地分离的CPV-2c型毒株具有较近的亲缘关系;分离的3株CPV-2a型毒株与我国广州等地分离的CPV-2a型毒株属于同一支。对汝州市犬细小病毒的流行调查,为该地区犬细小病毒病的防控提供了理论基础。
关键词:犬细小病毒;VP2基因;检出率;进化分析
基金项目:河南省本科高校青年骨干教师培养计划项目(项目编号:2023GGJS178)
作者简介:雷晨昱(1982- ),女,助教,硕士,主要研究方向为动物疫病病原分子免疫;E-mail:toffee.lei@163.com
犬细小病毒是一种经粪-口途径传播的、致犬发生胃肠道和心肌疾病的病原体[1]。犬细小病毒自20世纪70年代后期出现以来,在全球范围内持续传播[2]。目前,我国大部分城市的犬细小病毒病得到了有效的控制,但在县城或乡镇,该病在幼犬和青年犬上仍频繁发生,甚至在接种过疫苗的犬上也有发生,严重影响当地宠物经济的发展[3]。
犬细小病毒(canine parvovirus,CPV)属于细小病毒科原细小病毒属,基因全长5 323 bp,有2个开放阅读框,共编码4种蛋白。第一个开放阅读框编码NS1和NS2两种非结构蛋白,NS1蛋白是病毒DNA复制的前提,NS2蛋白促进病毒颗粒从细胞中释放;第二个开放阅读框编码VP1和VP2两种结构蛋白,VP2蛋白包含在VP1蛋白中,VP3蛋白是由VP2蛋白在酶作用下裂解形成[2]。犬细小病毒的核衣壳由VP1蛋白和VP2蛋白共同组成,VP2蛋白是犬细小病毒的关键区域,与犬细小病毒颗粒的感染性、血凝性等密切相关,其关键碱基和氨基酸序列的变化可能导致病毒发生变异[4]。犬细小病毒为单股线状DNA病毒,易发生突变,经过这些年的进化,形成了CPV-2a、CPV-2b、CPV-2c、New CPV-2a、New CPV-2b等新的基因型[5]。1983年,徐汉坤等[6]首次报道了犬细小病毒性肠炎,之后犬细小病毒病开始在我国流行。目前CPV-2a和CPV-2b是我国比较流行的毒株[7]。另外,关于New CPV-2a毒株的报道增多,该毒株毒力强并且传播速度快[7]。目前,犬细小病毒在中国宠物临床上呈现多重感染的情况。
近年来,关于犬细小病毒流行病学调查的研究不多,为了解汝州市犬细小病毒的流行毒株和变异情况,本研究从该地区3家动物诊所收集有腹泻、呕吐症状病犬的既往病历信息,分析检出率;扩增VP2基因,进行测序和同源性分析。从宏观水平和分子水平,对汝州市犬细小病毒的流行特点和分子特征进行监测和评估,以期为该地区犬细小病毒病的防控提供理论基础。
1" 材料与方法
1.1 调查对象和方法
汝州市3家动物诊所作为调查地点,诊所接收的20只有腹泻、呕吐症状的疑似患犬细小病毒病的犬作为调查对象,采集犬粪便或肛门拭子。
1.2 主要仪器和试剂
PCR扩增仪购自赛默飞世尔科技公司。TGel蓝光凝胶成像系统购自天根生化科技有限公司。病毒DNA/RNA基因组快速提取试剂盒购自天根生化科技有限公司。2×Taq PCR Master Mix购自生工生物工程(上海)股份有限公司。
1.3 病毒基因组DNA提取
按照病毒DNA/RNA基因组快速提取试剂盒操作说明,对粪便样本进行DNA提取,-20 ℃保存。
1.4 引物合成
根据GenBank公布的VP2基因序列,设计2对引物(表1),引物CPV-1F和CPV-1R用于犬细小病毒的常规检测;引物C-VP2-2F和C-VP2-2R用于CPV VP2基因全序列扩增。引物由苏州金唯智生物科技有限公司合成。
1.5 样本PCR检测
PCR反应体系为:样本DNA 1.0 μL、引物各0.4 μL、2×Taq PCR Master Mix 10.0 μL、ddH2O 7.2 μL,总反应体系20.0 μL。反应条件:预变性94 ℃ 5 min,变性94 ℃ 30 s,退火55 ℃ 30 s,延伸72 ℃ 40 s,40个循环,72 ℃ 7 min;4 ℃保存。取6 μL PCR产物进行1.2%琼脂糖凝胶电泳。
1.6 VP2基因扩增和测序
PCR反应体系同1.5步骤。反应条件:预变性95 ℃ 2 min,变性94 ℃ 30 s,退火56 ℃ 30 s,延伸72 ℃ 90 s,35个循环,72 ℃ 12 min;4 ℃保存。将PCR产物进行1.2%琼脂糖凝胶电泳。将扩增产物送至苏州金唯智生物科技有限公司(天津分公司)测序。
1.7 CPV VP2氨基酸序列分析
使用DNAStar(EditSeq)将基因序列翻译为氨基酸序列,与GenBank上已发布的30株国内外犬细小病毒(16株国内分离的CPV-2c型、CPV-2a型、New CPV-2a型和CPV-2b型毒株,11株国外分离的CPV-2c型和CPV-2b型毒株,3株商品化疫苗株)的氨基酸序列进行对比分析。使用DNAStar对氨基酸序列进行同源性比较,分析氨基酸变异情况,确定分离的CPV毒株基因型[8]。使用MEGA-X-10.0.5绘制系统进化树。
2" 结果
2.1 犬细小病毒检出率
PCR结果显示,20个样本中有15个扩增出特异性条带,片段大小与预期结果一致。测序为VP2基因,检出率为75%。
2.2 VP2基因扩增结果
以部分阳性样本为模板进行VP2基因全序列扩增,大小为1 755 bp。结果显示,目的条带大小与预期结果一致。
2.3 毒株亚型分析
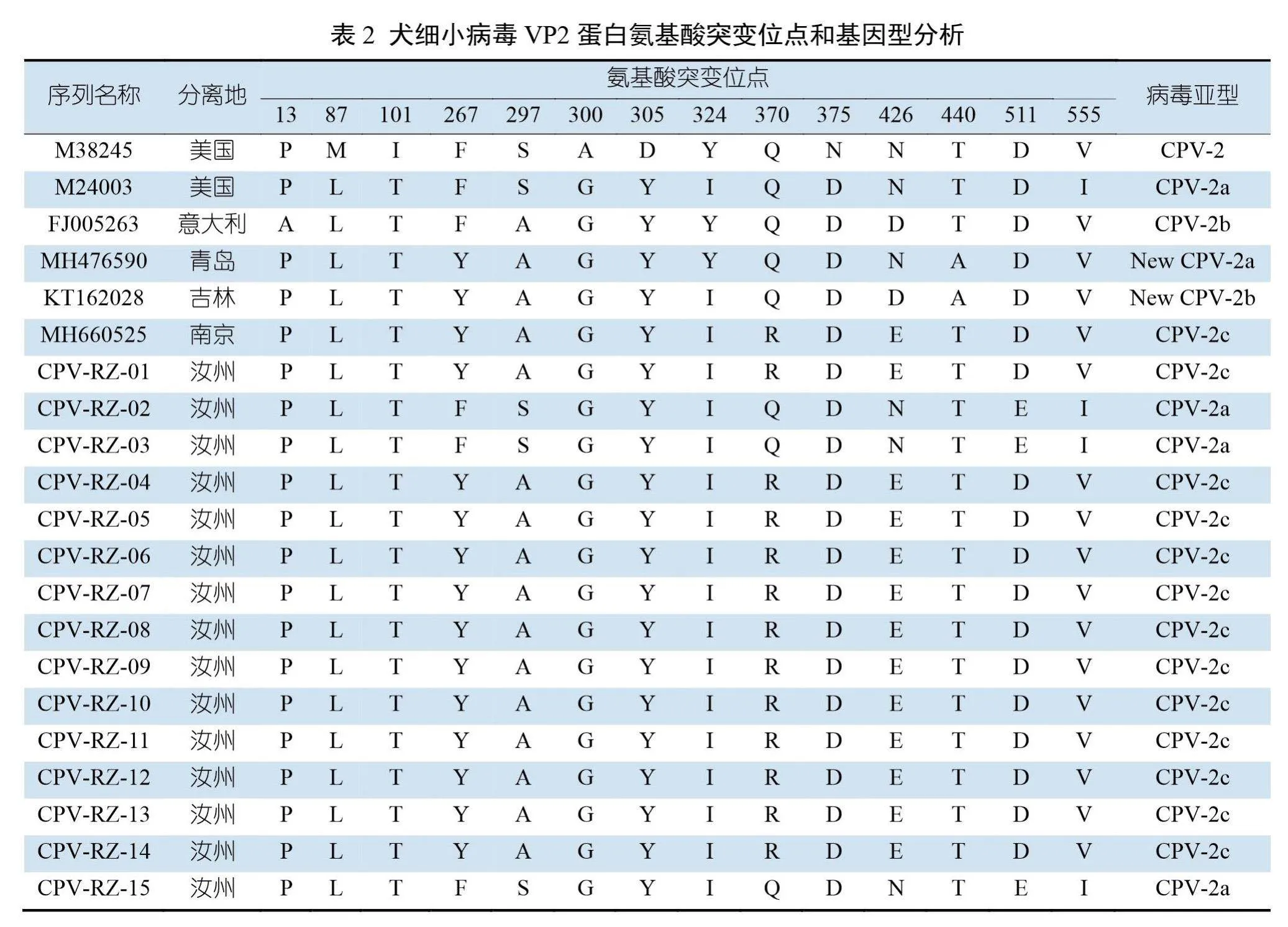
将15株犬细小病毒分离株的VP2基因序列翻译成氨基酸序列,详细命名见表2。参考犬细小病毒分型标准,确定CPV-RZ-02、CPV-RZ-03、CPV-RZ-15毒株297位氨基酸为S,426位氨基酸为N,属于CPV-2a亚型;CPV-RZ-01、CPV-RZ-04、CPV-RZ-05、CPV-RZ-06、CPV-RZ-07、CPV-RZ-08、CPV-RZ-09、CPV-RZ-10、CPV-RZ-11、CPV-RZ-12、CPV-RZ-13、CPV-RZ-14毒株出现了370 (Q→R)、426(N→E)、440(A→T)氨基酸突变,属于CPV-2c亚型。
2.4 VP2主要氨基酸位点突变分析
从表2可以看出,与CPV-2c参考株(MH660525)相比,12株CPV-2c亚型分离株相对较为保守,VP2蛋白的氨基酸序列没有发生突变。CPV-RZ-02、CPV-RZ-03、CPV-RZ-15除关键位点发生了突变外,与参考株(M24003)相比,还存在氨基酸突变,有D511E处突变。
2.5 同源性分析
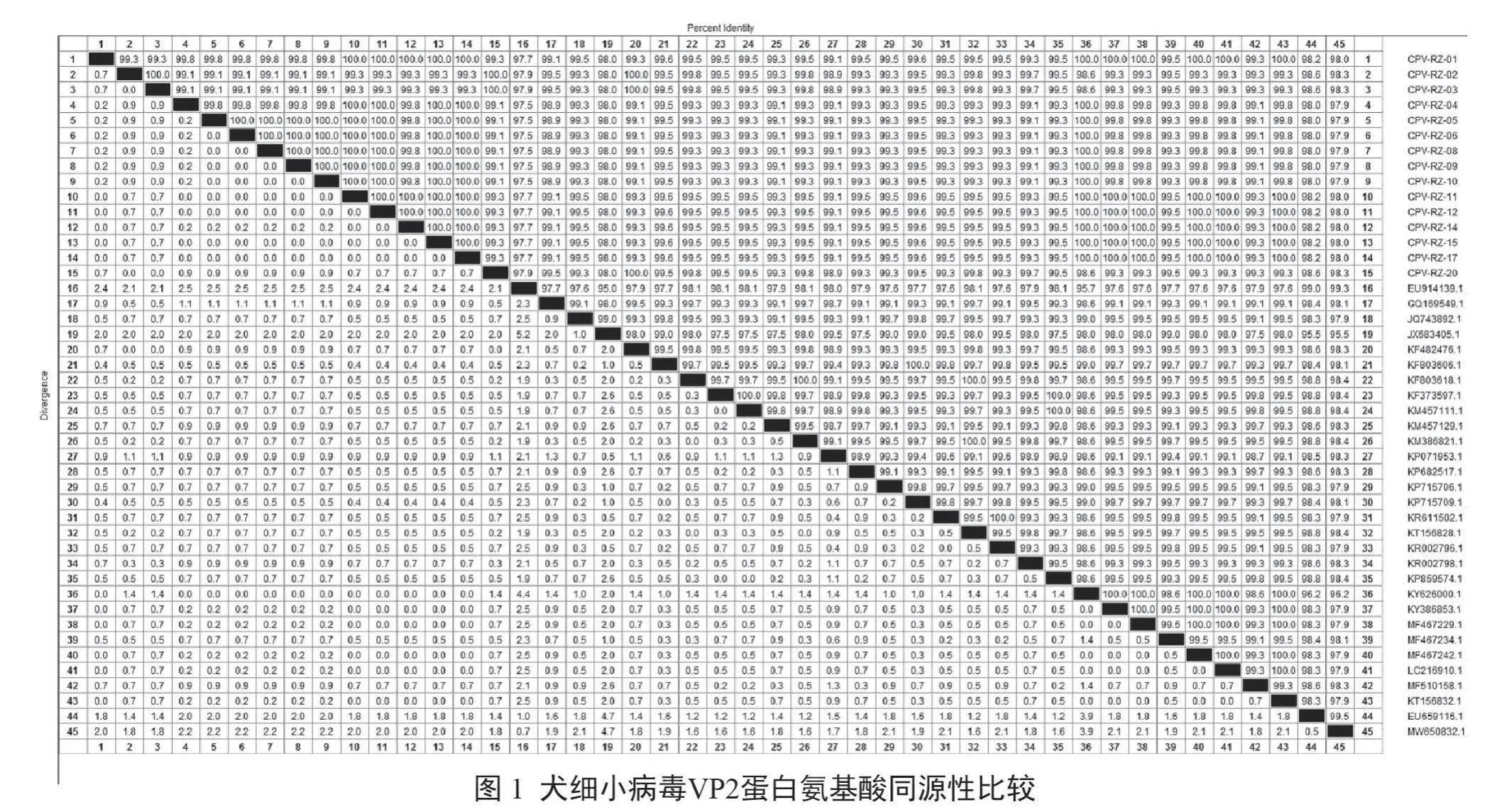
结果表明,15株犬细小病毒分离株间的氨基酸同源性在99.1%~100.0%,分离株与疫苗株的氨基酸同源性在97.5%~98.6%,与国内16株犬细小病毒的氨基酸同源性在98.6%~100.0%,与境外11株犬细小病毒的氨基酸同源性在98.0%~100.0%(图1)。
2.6 系统进化树分析
采用MEGA-X-10.0.5软件构建VP2蛋白氨基酸的遗传进化树,由图2可知,CPV-RZ-01、CPV-RZ-04、CPV-RZ-05、CPV-RZ-06、CPV-RZ-08、CPV-RZ-09、CPV-RZ-10、CPV-RZ-11、CPV-RZ-12、CPV-RZ-14、CPV-RZ-15、CPV-RZ-17与我国广西、黑龙江、沈阳等地分离的CPV-2c型毒株的亲缘关系比较近,与乌拉圭、西班牙、克罗地亚、意大利分离的CPV-2c型毒株不属于同一支;CPV-RZ-02、CPV-RZ-03、CPV-RZ-20与我国广州、哈尔滨等地分离的CPV-2a型毒株属于同一支;15株分离株与3株疫苗株属于不同的分支,亲缘关系较远。
3" 讨论
虽然临床上CPV-2型疫苗被广泛使用,但是变异株仍在犬科动物间变异、传播[9]。本试验从河南省汝州市3家动物门诊的15份样本中扩增得到12株CPV-2c亚型毒株,3株CPV-2a亚型毒株。2020年,韩国首次报道了CPV-2c亚型,现阶段全球多数地区均有CPV-2c亚型的报道[10]。2010年以前,我国主要流行CPV-2a亚型[11],之后,我国广西、吉林、北京[12]等地发现CPV-2c亚型。本试验从河南省汝州市检测到的毒株主要是CPV-2c亚型,说明该地区主要流行CPV-2c亚型,这为该地区犬细小病毒病的防控提供了理论基础。
VP2基因是犬细小病毒的重要毒力基因,决定着病毒的抗原性、血凝性和宿主范围[13]。本试验以15份样本为模板分别扩增VP2基因,序列比对结果显示与GenBank已发布VP2基因序列的同源性都在99%以上。氨基酸序列比对显示,CPV-RZ-02、CPV-RZ-03、CPV-RZ-15毒株有D511E处突变,可能是由境外传入或是现有基因型进化而来。在意大利和尼日利亚的报道中,描述到亚洲存在一种以VP2蛋白中存在特定氨基酸残基(5Gly、267Tyr、324Ile、370Arg)为特点的CPV-2c基因组变体[14-15],并在上海的报道中描述过该特征的变异毒株[16],这与我们得出的结果一致,证明在河南省汝州市流行的CPV-2c毒株是亚洲新的CPV-2c变异毒株。通过系统发育进化树分析可知,犬细小病毒在进化中形成了不同的分支,检测的CPV-2c亚型毒株与乌拉圭、西班牙、克罗地亚、意大利的6株CPV-2c亚型毒株不在同一分支上,与国内的CPV-2c亚型毒株亲缘关系近,与李少晗等[17]在北京的调查结果一致。林瑜婷等[4]在对河南方城县的调查中发现,该地区已出现CPV-2c亚型的突变毒株,结合本试验结果表明,CPV-2c亚型的突变毒株是该地区主要流行的毒株。这对河南省使用CPV-2型疫苗对新的CPV-2c亚型突变毒株保护效果的评估很重要。此外,应加强河南省犬细小病毒变异情况的流行病学调查,特别是对CPV-2c亚型的监测,对实时调整河南省犬细小病毒病的防控措施有重要意义。
4" 结论
对犬细小病毒VP2基因序列分析发现,汝州市主要流行CPV-2c亚型毒株,该毒株属于亚洲CPV-2c亚型的变异毒株,具体情况还需要进一步研究。本调查了解了河南省汝州市犬细小病毒的流行情况,充实了河南省犬细小病毒的流行信息,为该地区犬细小病毒病的防控工作提供了理论依据。
参考文献
[1] 赵国星.犬细小病毒性肠炎两种快速检测方法的建立与应用[D].长春:吉林大学,2015.
[2] 黄华旭.广西地区犬细小病毒的分子流行病学调查研究[D].南宁:广西大学,2018.
[3] 陈小蓉,杨宁,张燕红,等.成都地区犬细小病毒分子流行病学调查[J].中国畜禽种业,2019,15(9):3-5.
[4] 林瑜婷,翟颀,翟少伦,等.犬细小病毒河南方城株分离及VP2基因序列分析[J].中国动物传染病学报,2021,30(2):1-10.
[5] 方光远,樊金云,谈福利,等.南京地区犬细小病毒基因型鉴定[J].畜牧与兽医,2021,53(3):95-101.
[6] 徐汉坤,金淮,郭宝发,等.某犬群爆发犬病毒性肠炎的流行病学和临床病理学观察[J].畜牧与兽医,1983(5):5-7.
[7] 孙明洁,董国英,张雪竹,等.犬细小病毒国内外流行病学研究进展[J].中国兽医学报,2019,39(5):1035-1039.
[8] PARRISH C R,AQUADRO C F,STRASSHEIM M L,et al.Rapid antigenic-type replacement and DNA sequence evolution of canine parvovirus [J].Journal of Virology,1991,65(12):6544-6552.
[9] VOORHEES I,LEE H,ALLISON A B,et al.Limited intrahost diversity and background evolution accompany 40 years of canine parvovirus host adaptation and spread [J].Journal of Virology,2019,94(1):e1119-1162.
[10] MOON B Y,JANG J,KIM S H,et al.Genetic characterization of canine parvovirus type 2c from domestic dogs in Korea [J].Transboundary and Emerging Diseases,2020,67(4):1645-1653.
[11] 张仁舟,杨松涛,冯昊,等.中国国内首次检测到犬细小病毒CPV-2c[J].中国病原生物学杂志,2010,5(4):246-249.
[12] 由海波,韩志强,史赫,等.犬细小病毒的遗传变异及流行情况分析[J].中国动物传染病学报,2020,28(6):113-118.
[13] TRUYEN U,GRUENBERG A,CHANG S F,et al.Evolution of the feline-subgroup parvoviruses and the control of canine host range in vivo [J].Journal of Virology,1995,69(8):4702-4710.
[14] MIRA F,PURPARI G,LORUSSO E,et al.Introduction of Asian canine parvovirus in Europe through dog importation [J].Transboundary and Emerging Diseases,2018,65(1):16-21.
[15] MIRA F,PURPARI G,DI BELLA S,et al.Spreading of canine parvovirus type 2c mutants of Asian origin in southern Italy [J].Transboundary and Emerging Diseases,2019,66(6):2297-2304.
[16] LIU C,GAO J,LI H,et al.Phylogenetic characteristics of canine parvovirus type 2c variant endemic in Shanghai,China [J].Viruses,2021,13(11):2257.
[17] 李少晗,由欣月,范君文,等.14株北京地区犬细小病毒分离毒株的VP2、NS1基因序列分析[J].畜牧兽医学报,2021,52(1):262-267.

