胆汁酸对水产养殖的影响及其检测技术研究进展
席静 韩雨轩 谢婧荷 王敏 曹晨 郭德华*
(1.广州海关技术中心 广东广州 510623;2.上海海关动植物与食品检验检疫技术中心)
0 引言
胆汁酸(bile acid)是人和动物肝脏中的胆固醇代谢中产生的多种醇类物质的统称,具有弱酸性[1],属于两性分子,既有亲水性,也有疏水性,在生理条件下以盐形式存在,具有较强的表面活性,能降低甘油三酯水平[2-3]。 目前,胆汁酸作为生长添加剂已广泛应用于水产动物中,以提高脂肪吸收率,促进生长,提高养殖类水产品品质。 色谱质谱技术可以同时进行定性和定量分析,因其具有较好的灵敏度和特异性,已成为检测胆汁酸的主流方法。 本文综述了胆汁酸对水产养殖的影响及其检测技术研究进展,旨在为胆汁酸在水产养殖中的深入研究和开发应用提供科学依据,并为监管部门及检测机构制订水产品中胆汁酸残留检测技术标准提供参考。
1 胆汁酸的化学结构及生理功能
1.1 胆汁酸的化学结构
胆汁酸主要存在于哺乳动物和其他脊椎动物的胆汁中,是一类具有药理活性的天然产物。 胆汁酸按照代谢途径分为初级胆汁酸和次级胆汁酸。 初级胆汁酸在肝脏部位合成,涉及一系列胆固醇的甾醇环和侧链中的酶性修饰,产物为胆酸(cholic acid,CA)和鹅脱氧胆酸(chenodeoxycholic acid,CDCA)。初级胆汁酸合成后进入肠肝循环, 在肠道细菌的作用下去羟基化,产生次级胆汁酸,包括石胆酸(litho cholic Acid,LCA)、脱氧胆酸(deoxycholic Acid,DCA)及熊脱氧胆酸(ursodeoxycholic Acid,UDCA),其结构如图1 所示。此外,胆汁酸按照结构还分为游离型胆汁酸和结合型胆汁酸, 初级和次级胆汁酸属于游离型胆汁酸,游离型胆汁酸可与牛磺酸或甘氨酸等结合,形成结合型胆汁酸,包括甘氨胆酸、牛磺胆酸等[4-5]。
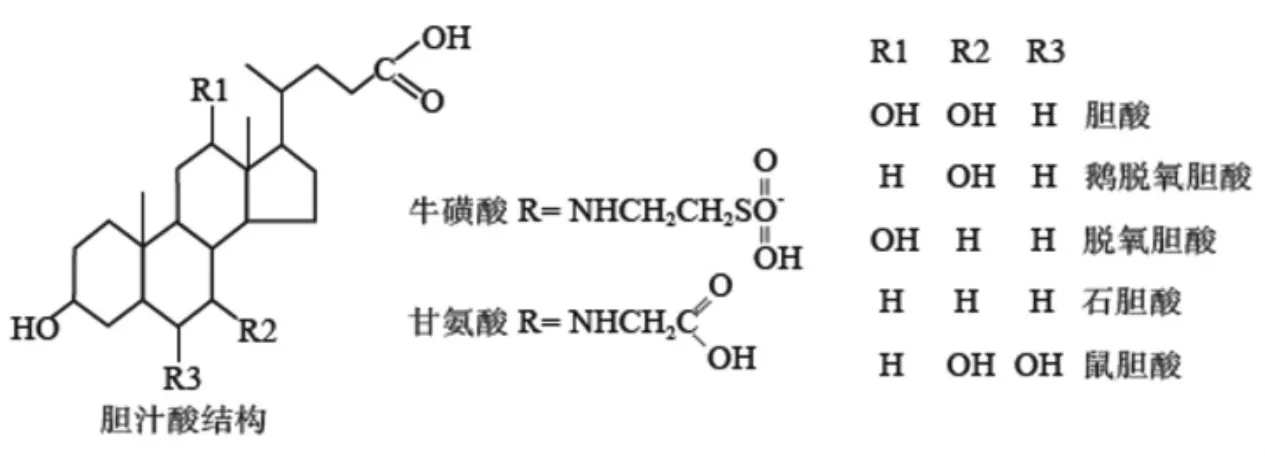
图1 胆汁酸化学结构Fig.1 Chemical structure of bile acids
在成人体内,每天大约有500mg 的胆固醇转化为胆汁酸。 目前,生物学界从动物体内提取到的胆汁酸多达14 种, 不同物种间胆汁中含有不同种类的胆汁酸, 初级胆汁酸中的CA、CDCA, 次级胆汁酸中的LCA、DCA 及UDCA 在人、鼠、猪、鱼等多种物种中共同存在[6-8]。
1.2 胆汁酸的生理功能
胆汁酸的肝肠循环促进了脂类及维生素等营养物质的乳化和吸收, 肝脏内胆汁酸的合成和小肠内胆汁酸的重吸收协同作用, 共同维持机体胆汁酸及胆固醇的代谢平衡。研究发现,胆汁酸具有促进脂肪消化吸收[9-10]、保肝利胆[11-12]、提高生长性能[13-14]、抗炎抗癌抗病毒[15-18]和免疫调节[19]等多种生物功能。 SERFATY L 等[20-21]研究发现熊去氧胆酸能够抑制胆汁淤积性肝疾病和大肠癌的发展。 ELKIHEL L 等[22-23]研究熊去氧胆酸、 鹅去氧胆酸和石胆酸的衍生物的抗癌效果, 发现这3 种胆汁酸能够选择性抑制多种肿瘤细胞的增殖和诱导细胞凋亡。 脱氧胆酸可抑制大鼠胰腺腺泡细胞AR42J 增殖并诱导AR42J 细胞凋亡[24]。
同时,有学者认为,胆汁酸本身也是一种“有效毒素”,一旦它在机体内含量过高,会直接影响胆汁酸池的大小, 对细菌细胞膜脂质双层结构造成一定程度的破坏,引发各类肝肠胆相关疾病[25]。许多研究发现,胆汁酸对癌细胞具有双重性,既有促癌作用,也有抗癌作用。 BAYERDORFFER E 等[26]研究发现患有结直肠腺瘤的男性患者血清脱氧胆酸水平显著提高。 BERNSTEIN C[27]在18 只野生小鼠的饮食中添加0.2%的脱氢胆酸,10 个月后17 只小鼠出现了结肠肿瘤,其中10 只为结肠癌。
2 胆汁酸对水产养殖的影响
2.1 胆汁酸在淡水鱼养殖中的应用
近年来,水产养殖密度增加,养殖病害时有爆发。国内重要淡水经济鱼类如草鱼、鲤鱼、鲫鱼、团头鲂、罗非鱼等,在养殖过程中受到各种病害的威胁,其中肝胆综合症是目前危害较为严重的一种疾病, 表现为患病鱼肝脏颜色发白或发黄,胆囊肿大。该病发病机理尚不清楚, 有学者认为发病原因是高能高蛋白饲料的使用导致鱼类肝脏负担加重[28]。 相关研究发现, 鱼类肝胆疾病的发生常伴随着胆汁酸的代谢异常, 在饲料中添加适量的胆汁酸可解决鱼类肝胆疾病的困扰[29],并提升饲料的利用率[30]。
大量科学研究显示, 在饲料中添加适量的胆汁酸在提高水产动物对饲料脂质的利用率、抗脂肪肝、促进水产动物的生长、增强免疫力、改善养殖鱼类品质等方面有显著效果。 张国安等[30]研究发现,红鱼粉型饲料中添加150 mg/kg 胆汁酸能够显著提高大菱鲆的特定生长率和肥满度, 添加300 mg/kg 胆汁酸能显著降低血清谷草转氨酶活性, 起到保护大菱鲆肝脏功能的作用。 PENG 等[31]研究显示,胆汁酸添加剂能够显著改善草鱼的增重率、 特定生长率、 摄食率,并能提高饲料效率。 张晶等[32]研究发现,草鱼的肥满度与胆囊中的胆汁酸含量呈负相关关系, 说明胆汁酸可以减少脂肪在草鱼肝脏的积累。 向枭等[33]在高脂饲料中添加胆汁酸投食喂养齐口裂腹鱼幼鱼70 天后, 发现齐口裂腹鱼幼鱼的增重率、 特定生长率、蛋白质效率、肝胰脏中蛋白酶的活性,均随着胆汁酸添加水平的升高而呈现先升高后降低的变化趋势,且均在胆汁酸添加量为150 mg/kg 时最大;齐口裂腹鱼幼鱼肌肉中粗蛋白质的含量呈先上升后趋于稳定的变化趋势, 在胆汁酸添加量为300 mg/kg时最大。JIANG 等[34]研究表明,饲料中添加0.15 g/kg 胆汁酸可以提升罗非鱼的增重率和特定生长率等。胡田恩等[35]研究发现,饲料中适量添加胆汁酸(100 mg/kg或200 mg/kg)能够显著提升牛蛙肝脏活力,保护肝脏功能;降低牛蛙的体脂含量。 日本学者研究发现[36],在鳗鱼饲料中添加胆汁酸6.5 mg/kg,喂养32 天后,喂养胆汁酸饲料的鳗鱼体重较不用胆汁酸的鳗鱼增加了16.7%,饲料系数下降了19.7%,将含有6 mg/kg的胆汁酸饲料喂养鲤鱼苗,喂养62 天后,实验组鲤鱼体重较对照组鲤鱼体重增加了10.9%, 饲料系数下降了17.7%。此外,有日本学者在真鲷的饲料中加入胆汁酸,经过一个生长周期后,真鲷的外观颜色更加鲜亮[36]。
由此可见, 胆汁酸可显著提高对水产动物消化道中脂肪酶活性影响, 适宜的胆汁酸产品能有效地增强水产品抗氧化能力, 在改善水产品品质方面有显著的效果,从而说明胆汁酸是一种良好的水产饲料添加剂。2016 年2 月,我国农业部发布第2358 号公告,决定将胆汁酸的适用范围扩大至肉食性淡水鱼类,以提高脂肪吸收效率,解决水生动物的代谢问题[37]。
2.2 胆汁酸在河蟹养殖中的应用
虾、蟹等甲壳动物是无胆囊的无脊椎动物,自身无法合成胆固醇和胆汁酸, 但是在其生长的各阶段需要摄取一定量的胆固醇和胆汁酸, 用来在体内转化为蜕皮激素,以保证生长过程中的正常蜕皮。从扣蟹到成蟹, 河蟹需要经过5 次蜕壳才能达到上市标准,每蜕一次壳,河蟹会翻倍增长,因此河蟹正常蜕壳是成长的关键阶段。 但近年来河蟹水瘪子病时有爆发,该病主要症状为肝胰腺萎缩,呈灰黄色、灰白色或白色,腹腔积水,肠道受损,附肢空瘪,一旦发病难以治愈,甚至导致河蟹大面积死亡。胆汁酸作为一种固醇类物质, 是虾蟹正常生长中不可缺少的营养物质,必须从饵料中获得这些物质。
陈晴等[38]研究显示,添加0.5%、1.0%胆汁酸和牛磺酸均可显著提升中华绒鳌蟹幼蟹肝脏和肠道中的蛋白酶和脂肪酶活性, 同时提高幼蟹体内的抗氧化酶活性。刘太亮等[39]在河蟹的养殖期间,实验组投放添加1 000 mg/kg 胆汁酸的饲料, 投放时间5 个月, 对照组未投放添加胆汁酸的饲料, 试验结果显示,养殖期间对照组出现了水瘪子病,而试验组的河蟹全程未出现肝胰腺方面的疾病, 养殖过程中摄食旺盛,生长速度快,蜕壳及时顺利,上市重量较对照组明显增大,成蟹蟹黄蟹膏饱满,说明在蟹养殖中添加含有胆汁酸的饲料对于提高蟹存活率及成品品质具有一定的优势。
2.3 水产养殖中胆汁酸添加量及存在问题
由于不同动物自身所产生的胆汁酸种类及组成比例存在着一定的差异,其生理作用亦存在差别,因此导致不同来源及含量的胆汁酸在用作水产动物饲料添加剂时,其功效也有所差别。目前的胆汁酸添加剂一般是用猪胆提纯, 其胆汁酸的种类及组成可能有别于不同的鱼类,猪胆提纯的胆汁酸,在提纯过程需除去胆囊中变性的脂肪和蛋白等有害成分,如果生产提纯工艺不达标, 会对水产动物带来潜在危害[30]。此外, 外源胆汁酸的添加是否会抑制机体内源胆汁酸的分泌, 外源胆汁酸的最佳添加水平和最佳配方均有待进一步研究确定[3]。
研究发现, 水产高脂饲料中复合胆汁酸的适宜添加水平为150 mg/kg~200 mg/kg[33-35]。 过量的胆汁酸会损伤水产动物的肝脏功能,使干细胞空泡化,抑制水产动物的生长,影响机体代谢。胡田恩等[35]研究发现,过量添加胆汁酸(300 mg/kg)会导致牛蛙肝损伤。JIANG 等[34]研究表明,饲料中添加1.35 g/kg 的胆汁酸对罗非鱼的生长有抑制作用。 过量的胆汁酸会在水产品体内蓄积、残留,而人类食用含有胆汁酸,如脱氢胆酸的水产品,可有嗳气、打嗝、腹泻、恶心、肌痉挛、直肠区周围皮肤刺激等不良反应,如果是长期食用或一时摄入量过多,可导致电解质失衡,甚至可出现呼吸困难、心跳骤停、心律紊乱、肌痉挛、极度疲乏无力等严重反应[20,26]。韩国食品药品安全部(MFDS)对水产品中的脱氢胆酸制定了残留限量标准, 规定水产品中的脱氢胆酸不得超过0.01 mg/kg, 并对来自中国的水产品进行了脱氢胆酸残留的检测,2018年1 月—2019 年8 月,我国共有2 个批次的水产品被检出脱氢胆酸残留不合格[40],给相关企业带来了较大的经济损失。 2021 年,韩国食品药品安全部发布2021 上半年进口水产品重点管理对象,其中涉及到中国水产品鳞鲀, 按相关规定鳞鲀中不得检出脱氢胆酸[41]。
3 胆汁酸检测技术研究进展
胆汁酸的代谢与肝胆疾病密切相关, 检测生物体内胆汁酸含量对于肝胆疾病的诊断、 鉴别诊断及发病机理研究具有重要意义。 但由于胆汁酸的化学多样性和较大的生物浓度范围变化, 以及生物样本如血浆、胆汁的复杂性,研制开发灵敏准确的分析方法仍在进行之中。
目前, 生物体内胆汁酸检测技术包括薄层色谱法、分光光度法、高效液相色谱法、气相色谱质谱法、液相色谱串联质谱法[40-50]等。叶蓓蓓等[42]采用薄层色谱单波长扫描法测定人工牛黄中的主要胆汁酸类成分中胆酸及猪去氧胆酸的含量, 该方法以环己烷-乙醚-冰醋酸(2∶1∶1)为展开剂,平均回收率分别为101.3%(RSD=2.6%)和101.6%(RSD=2.5%)。但其样品前处理步骤较为复杂, 且薄层色谱实验条件要求较高,受薄层板、展开剂、展开条件、显色等因素影响较大,较难分离胆汁酸的同分异构体[43]。
气相色谱质谱法(GC-MS)是一种较为灵敏的检测方法,可根据其特有的MS 碎片模式定性胆汁酸,分析胆汁酸结构中不确定的羟基等基团的分布,但所需胆汁酸样品的量较大且需要通过多个前处理(固相,凝胶和离子交换)方法及衍生化步骤以去除生物基质的干扰[45]。 高效液相或超高相液相色谱(HPLC)与MS(或MS /MS)结合的检测技术,能够改善异构体与相同离子片段的分离, 可用于人和啮齿动物胆汁[16-18]、脂肪组织[18]、肝脏[16-17]中准确的胆汁酸定量检测,
需要注意的是, 当采用液相色谱技术检测胆汁酸时, 由于胆汁酸是一类紫外吸收较弱的固醇类化合物,使用紫外检测器(UV)检测灵敏度较低,目前大多采用蒸发光散射检测器(ELSD)和电雾式检测器(CAD),而CAD 灵敏度高于ELSD[45]。 与GC-MS相比,LC-MS 具有快速样品制备方法, 无需衍生化的优点[3]在样品处理方面因水产动物胆汁样品成分较为复杂,甲醇溶解后不但含有胆汁酸,并含有大量水溶性物质及非极性成分, 采用固相萃取可去除水溶性物质及非极性成分, 保留并富集中等极性的胆汁酸化合物。
据此,斯日古楞等[44]建立了固相萃取C18小柱净化, 液相色谱—二极管阵列检测器检测不同哺乳动物胆汁中13 种胆汁酸的技术,将C18小柱预先用1 mL甲醇和1 mL 0.05%甲酸溶液活化,再用2 mL 0.05%甲酸,1 mL 甲醇+水溶液(45+55)依次淋洗小柱,最后用3 mL 甲醇洗脱胆汁酸,13 种胆汁酸检出限在0.2~0.6 ng/μL 之间, 该方法可使游离胆汁酸和结合胆汁酸达到良好的基线分离。 王一博等[45]建立了高效液相色谱—电雾式检测器同时测定猪、熊、牛、羊胆粉中5 种胆汁酸的检测方法, 选择对极性化合物具有较强保留的T3 色谱柱, 使用冰醋酸-乙腈-水梯度洗脱方式实现了5 种胆汁酸的完全分离, 定量限为30 ng/μL。 张晶等[32]采用乙醇萃取草鱼肠道和肝脏样品, 萃取液吹干后复溶于甲醇并用固相萃取C18小柱净化;血清中的胆汁酸用冰乙腈沉淀法萃取固相萃取C18小柱净化, 通过液相色谱串联质谱技术检测草鱼不同组织中胆汁酸含量。 这些方法均说明固相萃取作为样品预处理技术, 与传统的液液萃取法相比较可以提高分析物的回收率, 更有效地将分析物与干扰组分分离,减少样品预处理过程,操作简单、省时、省力。
此外, 针对采用胆汁酸饲料喂养的水产动物肌肉组织中胆汁酸残留量检测研究较少的情况, 曹晨等[51]使用液液萃取联合固相萃取净化技术,以WATERS C18色谱柱为固定相,不同体积比的水和甲醇的混合液为流动相进行梯度洗脱, 采用串联质谱仪在电喷雾离子(ESI)源,负离子扫描方式;多反应监测(MRM)模式下,内标法定量,建立超高效液相色谱-串联质谱法测定鱼肉中胆汁酸残留量的检测方法,该方法对于3 种胆汁酸(胆酸、脱氧胆酸、脱氢胆酸) 的定量限均达到0.01 mg/kg, 回收率为84.4%~115.3%,相对标准偏差为2.6%~13.3%,符合韩国食药监局对进口水产品中脱氢胆酸残留的限量要求,可为水产动物肌肉中胆汁酸的快速筛选和确证提供技术手段。
4 结语
胆汁酸作为一种新型的饲料添加剂, 能有效改善水产动物对脂肪的利用,提高饲料转化率,维护水产动物肝脏健康,具有良好的市场应用前景。随着检测技术的发展和进步, 具有较好的灵敏度和特异性的液相色谱质谱技术已成为检测胆汁酸的主流方法。 然而,针对复杂的胆汁酸类型及生物基质仍存在一些问题,如外源性胆汁酸的添加是否会抑制内源性胆汁酸的分泌,外源性胆汁酸的最适合添加量以及所带来的安全问题,以及如何针对胆汁酸的多种类型在水产动物组织中进行胆汁酸残留检测技术的优化等。
目前, 我国尚未出台食用水生动物或者食品中胆汁酸类物质残留的检测标准, 建议监管部门和检测机构加快食用水生动物或食品中胆汁酸类物质残留的检测技术标准制定工作, 指导企业科学合理地使用胆汁酸添加剂,严控过度使用,以促进水产养殖业的健康发展,保障食用安全。

