细胞焦亡对肝癌发生发展的影响及中医药的干预作用
杨润瑞 王 勇,2 段柳剑 柯尊丽
(1 贵州中医药大学,贵阳,550000; 2 中国科学院分子植物科学卓越创新中心中国科学院合成生物学重点实验室,上海,200000)
肝癌是由多种因素引起的消化系统内的恶性肿瘤之一。流行病学表明,中国的肝癌发病率位居世界之首[1]。而临床的治疗手段并不能很好地改善肝癌患者的预后,且多伴有严重的不良反应[2-4]。故临床亟须寻找肝癌发展过程中的深层次作用机制和更为有效的治疗手段。
细胞焦亡是一种新发现的程序性细胞死亡方式,在肿瘤类疾病中发挥着关键作用[5]。中医药作为我国的传统医疗手段,对肝癌的发生发展有着独特的认知。且中药有多成分、多靶点的特性,对肝癌发展的各个阶段均有较好的治疗作用。有研究表明,中医药通过调节细胞焦亡过程影响肝病患者的痰瘀程度和预后[6]。故本文拟基于对细胞焦亡的分子机制及其在肝癌发病机制中的作用进行分析,探讨中医药调节细胞焦亡在肝癌发展过程中的作用,以期为临床提供新的治疗思路。
1 细胞焦亡的发生机制
细胞焦亡过程多由经典的胱天蛋白酶(Caspase-1)依赖型与非经典的Caspase-1依赖型2种分子途径调控。见图1。其中以经典的Caspase-1依赖型较为多见,这一途径以核苷酸结合寡聚化结构域样受体蛋白3(Nucleotide-binding Oligomerization Domain-like Receptor Protein 3,NLRP3)炎症小体的激活为主。当外界刺激因子被细胞膜、细胞质上的识别受体识别后会刺激NLRP3、黑色素瘤缺乏因子-2(Absent in Melanoma 2,AIM2)等焦亡相关蛋白的激活。随后继续募集凋亡相关斑点样蛋白(Apoptosis-associated Speck-like Protein Containing Caspase Recruitment Domains,ASC)和Caspase-1进行拼接,形成具有生物学活性的NLRP3炎症小体并促进白细胞介素-1β(Interleukin-1β,IL-1β)、IL-18的成熟和分泌[7-8]。Caspase-1也会将GSDM切割释放GSDM-N结构域,该结构域可在细胞膜上打孔,导致细胞质肿胀、膜破裂等特征性形态变化[9]。而非经典的Caspase-1依赖型相对简单,一部分是由脂多糖(Lipopolysaccharide,LPS)刺激ASC后致使Caspase-4/5/11激活并切割GSDM完成[10]。此外,Caspase-4/5/11会刺激泛连接通道蛋白1(Pannexin-1)进而诱导细胞膜上P2X7R的激活使细胞膜上形成微孔[11]。值得注意的是,Pannexin-1被激活后也会促进NLRP3炎症小体的形成引起细胞焦亡。因此,在疾病的发展过程中,经典与非经典的分子途径会协同调控焦亡的进程。值得注意的是,焦亡会使细胞发生较为严重的形态学改变,使细胞膜表面出现大量气泡状突起,进而形成孔膜[12]。细胞内部的脱氧核糖核酸(Deoxyribonucleic Acid,DNA)、染色质、线粒体、溶酶体等物质也会出现不同程度的损伤并通过孔膜释放至细胞外,细胞自身形态也会随着细胞内部物质的流出逐渐趋于扁平化。
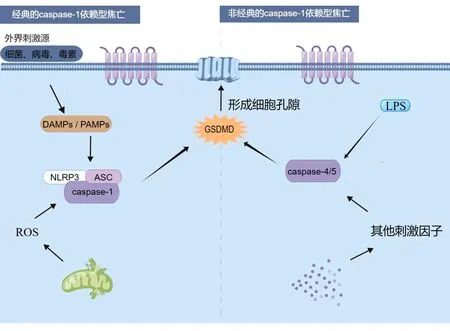
图1 细胞焦亡的发生机制
2 细胞焦亡对肝癌发生发展的作用机制
目前,学术界普遍认为细胞焦亡在肝癌的发生发展过程中有“双刃剑”的作用。研究表明,细胞焦亡可以诱导肝癌细胞的迅速死亡进而降低肿瘤恶化和转移的风险。但在细胞焦亡的过程中,细胞内容物也从肝细胞内部释放到细胞外,作为内源性刺激介导肝脏内不同细胞的不同生物学改变[13]。不仅如此,肝脏内的细胞可能自身也有发生或诱导其他细胞发生焦亡的潜力。因此,这些基于细胞焦亡产生的后续生物学改变也在潜移默化地影响着肝癌的预后。
2.1 肝脏内免疫细胞与细胞焦亡 肝脏是人体内重要的免疫器官,含肝巨噬细胞、自然杀伤细胞(Natural Killer Cell,NK Cell)和细胞毒性T细胞等免疫细胞[14]。其中,肝巨噬细胞为肝组织的巨噬细胞,是抵御癌细胞的第一道防线[15]。生理状态下,肝巨噬细胞极易被内毒素、补体和其他病原体相关分子模式通过各类信号途径激活发挥自身的吞噬作用[16]。但肝巨噬细胞内部的NLRP3/Caspase-1通路被激活后,不仅会自身产生焦亡现象还会增加细胞对内毒素的敏感性,也会使机体产生过度的免疫反应加重癌症患者的炎症反应损伤[17]。NK细胞与细胞毒性T细胞也是肝内淋巴细胞的重要组成成分,二者共同维持着机体的免疫稳态。研究表明,细胞毒性T细胞多通过T细胞抗原受体来识别和消除靶细胞,而NK细胞多被各类细胞因子激活,可以消除不被细胞毒性T细胞识别的靶细胞[18]。因此,二者以互补的方式发挥灭杀病原体、癌变细胞,抑制肿瘤免疫逃逸等免疫功能[19]。值得注意的是,这些免疫功能的正常发挥极可能与二者介导的细胞焦亡有关。研究表明,NK和细胞毒性T细胞可通过释放颗粒酶A(Granzyme A,GZMA)裂解并激活GSDMB,以非经典的Caspase-1依赖型的途径触发细胞焦亡[20]。不仅如此,NK细胞释放的颗粒酶B(GZMB)除了通过激活Caspase-3来诱导GSDM的激活外,还能够以不依赖于Caspase的方式直接切割GSDM诱发细胞焦亡[21]。因此,NK细胞与细胞毒性T细胞参与肝癌患者的免疫反应可能是通过调节细胞焦亡实现的。
2.2 肝星状细胞、肝细胞与细胞焦亡 肝星状细胞(Hepatic Stellate Cells,HSC)是肝内的脂质储存细胞,通过调节纤维化的程度参与肝癌的发病进展[22]。生理情况下,HSC的状态受转化生长因子等信号分子的调节。活化的HSC可上调转化生长因子-β(Transforming Growth Factor-β,TGF-β)表达,并在HSC自分泌机制的作用下,产生胶原纤维和细胞外基质成分共同参与肝纤维化的进展,增加癌变的风险[23-24]。
在癌症的发展过程中,由于体内免疫微环境的剧烈变化极易导致肝细胞的损伤。受损的肝细胞可释放活性氧(Reactive Oxygen Species,ROS)和其他损伤分子模式[25]。在ROS、损伤相关分子模式(Damage Associated Molecular Pattern,DAMP)等因素的作用下,NLRP3、ASC与Caspase-1组装并介导IL-1β的成熟和分泌,加剧肝脏的炎症反应损伤[26]。成熟的IL-1β也可直接触发HSC活化,从而增加细胞外基质的沉积加重肝纤维化的程度。值得注意的是,NLRP3炎症小体和ASC等成分也存在于HSC中,并在HSC活化和肝纤维化发展中发挥重要作用。NLRP3引起HSC的功能变化,上调TGF-β的产生和细胞外基质的分泌[27]。因此,细胞焦亡会造成肝细胞的损伤及肝脏纤维化的增强进而影响肝癌的进展。
2.3 肝癌细胞与细胞焦亡 肝癌细胞的增值、迁移和侵袭等现象也受细胞焦亡的调控。肝癌细胞内NLRP3炎症小体的激活会诱导癌细胞死亡及炎症介质的释放,进而抑制癌细胞的增殖和转移[28]。但在二乙基亚硝胺诱导的小鼠肝癌模型初期,NLRP3的表达上调会加速肝癌的形成[29]。低氧应激下,高表达的Caspase-1也可促进肝癌细胞侵袭和转移[30]。这些证据表明,在肝癌的不同阶段细胞焦亡发挥着不同的调节作用。
3 中医理论对肝癌及细胞焦亡的认识
在中医理论中,并无确切病名与肝癌对应,但依据其临床表现多将肝癌归属于“肝积”“肝壅”等范畴。肝是人体五脏中的重要脏器,有“将军”之称,“罢极”之能。《素问》中有较多的篇幅论述肝的作用,如肝可疏泄全身的气机、可作为血液的储藏器官等。从气血角度而言,气为阳,血为阴。故肝作为调节气血的重要脏器,亦有调和阴阳、冲气以为和之用。而若肝受邪,气血随之而乱,气郁易生热,血停易成瘀,久蕴则成毒。肝乘脾土,运化失调则成痰湿。痰湿瘀热毒邪日久化癥瘕积聚停于左胁,过一岁则杯盘牢结一分,日久则人身瘦而腹大,至死不消而成肝积。
细胞焦亡是内源性致热的主要生物学过程之一,是机体内炎症反应、细胞死亡的重要机制[31]。其本质为各种原因导致的人体内肝细胞膜完整性丧失、内容物流出的程序性细胞死亡。这一过程会伴随着能量的释放和细胞内部物质的流出,而中医理论中多将无形物质归属为阳,有形物质归属为阴。故若将细胞视为独立个体,则细胞在焦亡时状态应为阴随阳脱、阴阳离绝。细胞内部物质流出后作为痰瘀进一步加剧机体阴阳失衡的表现。如体温是反映整体阴阳波动的重要指标,而大鼠肝组织中Caspase-1、GSDMD的表达水平与核心体温呈正比[32]。大鼠体内痰湿程度也与NLRP3/Caspase-1信号通路的表达正相关[33-34]。Caspase-1激活后也会诱导内皮细胞活化及焦亡,并使细胞间黏附分子的表达水平升高,加重单核细胞与内皮细胞的黏附,进而加速瘀血的形成[35]。此外,细胞内容物在细胞膜破裂后流入脉络,日久则形成“痰瘀毒结”。故细胞焦亡会影响人体的阴阳平衡,并加重体内痰瘀的严重程度[6]。因此,若要调节肝癌中细胞焦亡的生物学过程,应从阴阳平衡处着眼,依体内痰湿瘀热毒邪之深浅立法,如此多可获效。
4 中医药调控肝癌发展过程中的细胞焦亡现象
通过现代手段发现,多种活性成分及复方可调节肝癌进展过程中细胞焦亡的变化。有趣的是,中药具有明显的双向调节作用。在肝癌细胞中,中药能增加细胞焦亡相关基因和蛋白的表达进而诱导癌症细胞的凋亡,避免癌症的恶化和转移。而在肝组织中,中药可抑制细胞焦亡相关基因和蛋白的表达,避免肝损伤及肝脏免疫微环境紊乱的发生。
4.1 复方 黄连解毒汤出自《肘后备急方》,内有黄芩、黄连、黄柏、栀子,为清热解毒之良剂,三焦内各脏腑的火热实证均可用之。黄连解毒汤可抑制NLRP3介导的炎症反应、细胞焦亡等生物学过程,改善肝脏的脂滴聚集和脂质代谢进而避免原发性肝癌的发生[36-37]。西黄丸原名犀黄丸,为乾隆五年王维德所著的《外科证治全生集》中的丸剂,由牛黄、麝香、乳香及没药组成。现代研究表明,西黄丸能够通过抑制核因子κB(Nuclear Factor-κB,NF-κB)、NLRP3、肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)蛋白的表达进而干预肝癌SMMC-7721细胞焦亡过程,发挥抗肝癌作用[38]。
健脾益气方为卓少元教授根据多年治疗肝癌的临床实践所得验方,由黄芪、白术、云苓、白芍、半夏、薏苡仁及神曲等7味中药组成,有扶正补虚、运脾化湿之功。动物实验表明,健脾益气方对DEN诱导的肝癌模型大鼠具有较好的治疗作用,可改善大鼠的肝细胞脂肪变性、坏死和肝组织损伤指数,降低血清中TNF-α、IL-1β等炎症介质含量以及肝组织中NLRP3、ASC、pro-Caspase-1、受体相互作用蛋白1(Receptor Interacting Protein-1,RIP1)、RIP3、混合系列激酶域样蛋白(Mixed Lineage Kinase Domain-Like,MLKL)的表达水平[39]。鳖甲煎丸出自汉代名医张机《金匮要略》,多用于治疗肝纤维化、肝硬化、肝炎、肝癌等肝病[40]。鳖甲煎丸可显著降低二乙基亚硝胺诱导大鼠肝癌模型肝脏中NLRP3、ASC、Caspase-1、pro-IL-1β、pro-IL-18、IL-1β和IL-18的表达水平,抑制大鼠肝组织纤维化程度、癌变细胞和炎性细胞浸润且呈现剂量依赖关系[41]。
有研究在治疗原发性肝癌时多采用固脾消积饮的临床效验方,方以人参、黄芪、白术、莪术、半枝莲组成。体外实验表明,固脾消积饮通过上调细胞焦亡经典通路中相关分子Caspase-1的表达,进而诱导人肝癌HepG2.2.15细胞发生焦亡[42]。
4.2 单体 研究表明,紫檀芪、槲皮素、姜黄素等酚类物质可改善焦亡相关信号通路的激活。其中,紫檀芪是藜芦醇内的多酚化合物,具有抗氧化、抗炎、抗癌等生物活性[43]。紫檀芪可改善抗肿瘤药物阿霉素诱导的肝脏病理变化以及谷草转氨酶(Glutamic-oxaloacetic Transaminase,GOT)、谷丙转氨酶(Glutamic-pyruvic Transaminase,GPT)水平,并通过抑制NLRP3炎症小体的表达减少焦亡现象的发生进而对阿霉素诱导的肝损伤产生保护作用[44]。槲皮素也是一种多酚类化合物,近些年它已被证实在重塑肿瘤微环境、抑制恶性肿瘤转移和诱导肿瘤细胞保护性自噬等方面存在积极作用。动物实验表明,槲皮素可通过调节核转录因子红系2相关因子2(Nuclear Factor-erythroid 2-related Factor 2,Nrf2)/血红素加氧酶(Heme Oxygenase,HO-1)通路的表达,从而抑制NLRP3炎症小体的激活和炎症介质的分泌,从而维持肝脏的正常功能[45]。姜黄素是姜黄科根茎内的多酚类物质,它对HepG2细胞裸鼠移植瘤有较好的抑制作用,可明显减少肿瘤质量和体积、凋亡指数及裸鼠肿瘤组织中的NLRP3、IL-1β mRNA和蛋白相对表达量[46]。迷迭香酸是一类天然酚酸类化合物,它能下调Vimentin/NLRP3蛋白的表达抑制HepG2细胞增殖并诱导细胞焦亡[47]。
高山异黄酮、木犀草苷等黄酮类成分可以影响HCC肝癌细胞焦亡过程。高山异黄酮是石斛中具有广泛的药理特性的黄酮类化合物,可直接通过激活NLRP3炎症小体介导的细胞焦亡抑制HCC细胞生长和转移[48]。木犀草苷是一种常见的黄酮类化合物,它能通过下调NLRP3、ROS、Caspase-1等基因的表达抑制HCC细胞的增殖、侵袭和转移[49]。
双氢青蒿素、山莨菪碱等其他成分也对焦亡过程有一定的调节作用。其中,双氢青蒿素是青蒿素的一种衍生物,具有抗炎、抗肿瘤、抗疟疾等多种药理作用[50]。体外实验表明,双氢青蒿素通过上调AIM2/Caspase-1通路的表达促进肝癌HepG221细胞自噬的产生进而抑制肝癌细胞的异常增殖[51]。山莨菪碱是从山莨菪中提取的一种生物碱,对感染性疾病有良好的治疗作用[52]。山莨菪碱可通过抑制NLRP3炎症小体的激活及γ干扰素(Interferon-Gamma,IFN-γ)、TNF-α、IL-4和IL-27等炎症介质的水平进而抑制HCC细胞的生长[53]。黄色当归醇是从明日叶中分离出来的查耳酮类物质,能够诱导肝癌细胞发生Caspase-1依赖性的细胞焦亡,从而抑制细胞增殖[54]。
5 讨论
细胞焦亡与机体自身的阴阳平衡有关,且焦亡产生的细胞内容物流出会介导痰湿瘀热毒邪的产生。中医药可影响细胞焦亡的变化,对肝癌发展过程中所介导的组织损伤、癌细胞的增殖与转移、局部的炎症级联反应均有较好地改善作用,充分体现了中医药具有多方位、综合性的优势。今后课题组将充分发挥现代技术的优势,进一步将中医理论与现代生物学现象进行深一步融合,并设计相关临床、基础实验对细胞焦亡在肝癌的变化进行多维度的深入研究,以期阐明不同药物、剂型对肝癌不同阶段焦亡相关基因和蛋白表达的影响,为临床治疗提供相应的理论支持。
利益冲突声明:无。

