两株麦冬内生细菌的鉴定及生物学特性研究
沈瑜琦,陈 帅,李维波,牛 然,邵登科,张春源,赖泽成,叶文雨
(1.国家菌草工程技术研究中心,福建 福州 350002;2.植物与微生物相互作用福建省高校重点实验室,福建农林大学生命科学学院,福建 福州 350002;3.福建农林大学植物保护学院,福建 福州 350002)
麦冬(Ophiopogonjaponicus)是一种常绿草本,是中医处方中的常见药材。麦冬的野生资源较为丰富,且由于市场需求量较大,人工种植面积在不断地扩大中。药用麦冬种植范围相当广泛,主产于浙江、四川等地[1-2]。麦冬大都生长于海拔2 000 m以下的山坡较为阴暗潮湿处、靠近水源处或林下[3]。因药用麦冬具有一定的医疗价值,所以其内生菌产生的抗药活性可能高于普通植物[4],具有较高的研究价值。麦冬味甘、微苦性微寒,其入药部位主要为果实和小块根,具有调节心律、调节体内微循环、滋阴润肺等功效[5]。
内生菌指能于植物各组织内正常生长,但不引起该植物产生病征的一类微生物[6]。一些内生细菌为提高宿主对环境的适应能力,利用自身拥有某些机制来实现此目的[7]。研究显示,许多药用植物的有效成分受到内生菌的影响[8-12]。从植物组织器官中分离出来的内生菌,经过筛选后,部分能产生与植物相似或相同的有效成分,通过培养这些药用植物内生菌可以突破药用植物本身生长的限制[13],对药材的品质和质量都能有进一步的改善。
本研究以麦冬为材料,分离和纯化得到其内生细菌,通过形态学观察和分子生物学方法鉴定所得菌株,进一步研究菌株的生理生化特性,以期为药用植物内生细菌的功能菌株的筛选和开发提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 菌株来源
本试验所用麦冬植株采自福建省三明市福建盘古中药材有限公司,采集样品为健康生长的植株,采样方法为五点采样法,采集后放置于4 ℃冰箱备用。

图1 麦冬采样图Fig.1 Ophiopogon japonicus sampling illustration
1.1.2 培养基配方
LB固体培养基,LB液体培养基,淀粉牛肉膏蛋白胨培养基,葡萄糖蛋白胨培养基,均采用《微生物学实验技术》中的配制方法[14]。
1.1.3 PCR引物
本试验所用PCR引物购自北京擎科生物科技股份有限公司,细菌通用引物27F为扩增麦冬内生细菌16S rDNA片段序列的上游引物,1492R为下游引物(表1)。
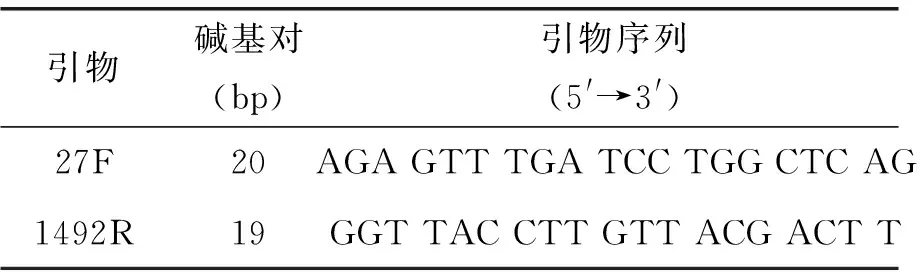
表1 PCR引物Table.1 PCR primer

表2 PCR反应体系Table.2 PCR reaction system
1.2 试验方法
1.2.1 菌株的分离与纯化
将新鲜的麦冬叶片用清水冲洗直至表面无泥沙尘土附着,用滤纸吸干麦冬叶片表面水分。将麦冬叶片浸泡于75%乙醇中5 min后用无菌水冲洗3遍及以上,用2%次氯酸钠溶液浸泡2 min,后用蒸馏水冲洗5~7遍。将表面消毒好的麦冬叶片在研钵内充分研磨,取叶片组织研磨液适量涂布至LB培养基上,28 ℃恒温培养12 h,待培养基平板内细菌长出后,依据培养基平板内各菌落的形态、颜色、大小等外观差异,挑取外观不同的单菌落进行3 次平板划线,经过纯化后对菌株进行编号保存。
1.2.2 菌株的形态特征
将LB固体培养基倒平板后,划线,放置于37 ℃培养24 h,观察菌落形态特征。
1.2.3 分子鉴定
挑单菌落进行菌株的活化,利用上述表1引物,以菌液为模板利用16S rRNA基因序列进行PCR扩增。
25 μL反应体系如下:
PCR反应条件:
94 ℃预变性5 min;94 ℃ 变性 30 s,55 ℃退火30 s,72 ℃延伸1 min 30 s,共设35 个循环;72 ℃延伸 7 min 。PCR产物通过北京擎科生物科技股份有限公司进行测序。将所得序列在NCBI网站上进行BLAST序列对比,使用Mega 11软件采用邻近法构建系统发育树,确定细菌种属。
1.2.4 过氧化氢酶试验
挑取预先培养在LB固体培养基上细菌的单菌落,将其轻轻涂抹在干净的载玻片上,一个载玻片上涂上下两处,相互之间留出一定间距,将其中一组设置为对照组。滴加3%过氧化氢溶液3 mL,观察反应现象。
1.2.5 淀粉水解试验
将含淀粉的牛肉膏蛋白胨固体培养基灭菌后融化并冷却至50~60 ℃,而后在超净台中倒板,静置,按无菌操作法将接种针烧红3遍,冷却。将预先培养好的生长在固体培养基上的菌落中挑取单菌落至平板,每个菌株接种两板,一板为对照,每板接种三个单菌落,等距排布,做好标记,在28 ℃培养箱中培养1 d。待形成菌落后,在平板上滴加碘液4~5滴,可轻微旋转使碘液铺满全皿,观察结果,并拍照。
1.2.6 甲基红试验
取灭菌后的葡萄糖蛋白胨培养液分装至已提前灭过菌的干燥试管中,每管5 mL,将已培养好的菌株挑取单菌落至试管中,做好标记,于37 ℃摇床内培养1 d。在培养好的装有菌液的试管内滴加各甲基红试剂3~4滴,充分摇匀,观察结果。
2 结果与分析
2.1 菌株的形态学鉴定
MD1 菌落边缘较为整齐,淡黄色,表面光滑,不透明,单菌落小而凸起,圆形,较为粘稠湿润,易被挑起(图2A)。
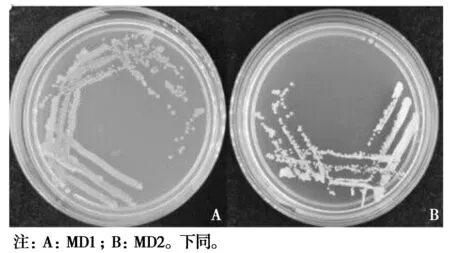
图2 细菌菌落的形态特征Fig.2 Morphological characteristics of bacterial colonies
MD2菌落边缘也较为整齐,白色,表面光滑,不透明,单菌落小而凸起,圆形,较为粘稠湿润,易被挑起(图2B)。
2.2 菌株的分子鉴定
将两株菌株DNA扩增后得到PCR产物,结果得到大小在1 500 bp 左右的片段。
将测序结果在NCBI网站上进行BLAST序列比对,利用Mega 11软件构建系统发育树的结果显示,菌株MD1与路德维希肠杆菌(Enterobacterludwigii)聚在同一分支,相似性达到100%,可初步判断该MD1菌株为路德维希肠杆菌(Enterobacterludwigii)(图3A);菌株MD2与节杆菌(Arthrobacterwoluwensis)聚在同一分支,相似性达到98%,可初步判断该MD2菌株为节杆菌(Arthrobacterwoluwensis)(图3B)。
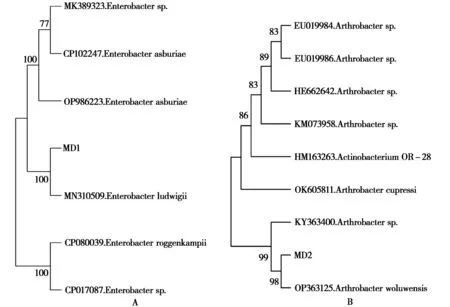
图3 基于16S rRNA序列构建MD1、MD2的系统发育树Fig.3 Phylogenetic tree construction of MD1 and MD2 based on 16SrRNA sequences
2.3 菌株的生理生化特性鉴定
2.3.1 淀粉酶水解试验
将 MD1、MD2 菌株分别点种于淀粉水解培养基上培养,一个皿等距点种三个。结果表明,两株菌株都产生了水解圈,在淀粉水解酶试验中均为阳性,两菌株都能产生胞外淀粉酶。淀粉遇碘变蓝色,若菌株周围出现透明的水解圈,则说明该菌株无法直接利用大分子的淀粉,需要分泌胞外淀粉酶来分解淀粉为葡萄糖或麦芽糖,再被细菌吸收利用,这就使得碘液无法与淀粉反应变蓝,从而产生透明的水解圈(图4A)。

图4 菌株MD1和MD2的部分生理生化特性Fig.4 Selected physiological and biochemical properties of strains MD1 and MD2
2.3.2 甲基红试验
菌株MD1、MD2在甲基红试验中,MD1颜色为红色,结果为阳性,MD2颜色呈黄色,结果为阴性。MD1菌株使甲基红试液变红,说明该菌株分解葡萄糖产生丙酮酸后,可以使丙酮酸分解产生大量酸性物质,溶液pH降低,甲基红指示剂遇酸变红;而MD2 菌株所在的试验组,试液为黄色,说明该菌株产生丙酮酸后很快将丙酮酸脱羧成醇等物质,溶液pH仍在6.2以上,甲基红指示剂呈黄色(图4B)。
2.3.3 过氧化氢酶试验
菌株 MD1、MD2在过氧化氢酶试验中,MD1、MD2菌株肉眼都能观察到产生大量气泡,为阳性。在该试验中,两组试验组肉眼能够观察到大量气泡,说明该菌株含有过氧化氢酶,过氧化氢酶是一类含有铁的蛋白,能够催化过氧化氢产生大量氧气,在此过程中起到传递电子的作用。(图4C)。
3 结论与讨论
本试验从麦冬叶片中分离了两株内生细菌,编号为MD1和MD2,经过形态观察、分子生物学鉴定以及生理生化试验,最终确定MD1菌株是路德维希肠杆菌(Enterobacterludwigii),淀粉水解试验、甲基红试验和过氧化氢酶试验均为阳性;MD2菌株是节杆菌(Arthrobacterwoluwensis),淀粉水解试验和过氧化氢酶试验均为阳性,而甲基红试验为阴性。本结果为麦冬内生细菌的功能菌株的筛选和多样性研究提供理论基础。
植物内生菌的发现历史可以回溯到100 多年前,因其自身特性而不被人们重视,一直到二十世纪三十年代,牲畜中毒后,研究发现因为食用感染内生菌的牧草,才真正引起人们重视。近20 年来,内生细菌受到了广大学者的高度关注[15-17]。研究发现,它们与植物的关系有三种:一是中性,对植物生长无影响;二是有益,能促进植物生长或者抑制病原物侵染;三是有害,在一定条件下能引起植物病害[18,19]。
植物内生细菌通过与寄主植物的相互影响,相互促进,协同生长,是一种宝贵的资源[20],因而在植物体内分离出的内生菌可能在其他领域发挥作用,如植物病虫害的防治,促进植物生长[21]。从药用植物分离发现的内生菌的次生代谢产物很可能是抗癌、抗炎等新型活化物质的来源[22],但内生菌的分离受到时间空间等条件上的限制[23],在操作时需选择最佳条件进行研究。
Hoffmann等[24]于2002年首次发现路德维希肠杆菌(Enterobacterludwigii)并报道。近年对该细菌在其他领域的报道渐渐增加,路德维希肠杆菌(Enterobacterludwigii)除一开始在人类病原菌中发现外,在发酵蔬菜、植物根际土、根结节和石油管道的微生物群落等地都有分离得到[25]。其作用亦具有多样性,如产胞外多糖[26]、生物控制能力以及烃降解能力[27]等。但目前国内对路德维希肠杆菌的研究较少,主要集中于该菌在特定环境污染的修复[28]。在植物促生方面,路德维希肠杆菌(Enterobacterludwigii)被发现在海雀稗、番茄和达乌里胡枝子中均能促进植物根系生长,其中在达乌里胡枝子体内分离出的菌株能够促进植物有更好的耐盐碱特性[29],因而在后续研究中,可以增加对该菌株其他方向的研究。
节杆菌是水体和土壤中的优势细菌,近年来对其在环境污染物降解的研究较多[30,31],例如节杆菌属细菌能够降解多环芳烃、N-杂环化合物等环境有机污染物。关于其固氮能力和对植物的促生能力也在进一步研究中[32]。节杆菌大都为非致病性菌株,因而对其致病机理的研究较少,但由于分布的广泛性,可能存在的致病性、治病机理和耐药性都应引起重视[33]。此外,节杆菌因分布广泛,能在多种环境下生存,对其进行多基因组水平的解析,能够从另一个角度了解其在环境污染改善方面的潜力[34]。因此,可以利用节杆菌对土壤的修复作用制作生物肥料。

