D-甘露糖异构酶的酶学性质探究和热稳定性改造
沈玲,赵丽婷,沈昱,陈磊,李军训,顾正华1,,李由然1,, 石贵阳,丁重阳*
1(江南大学,粮食发酵与食品生物制造国家工程研究中心,江苏 无锡,214122) 2(江南大学,糖化学与生物技术教育部重点实验室,江苏 无锡,214122) 3(江南大学 生物工程学院,江苏 无锡,214122)4(山东泰山生力源集团股份有限公司,山东 泰安,271000)
近年来,糖尿病、高血脂和高血压的患病率迅速上升,而这些疾病与高糖和高脂肪的食品密不可分。因此在食品加工生产过程中,可以使用功能性糖代替蔗糖作为新型甜味剂[1]。D-甘露糖作为功能性糖中的一种,目前已经作为食品辅助剂被直接使用。此外,由于D-甘露糖具有溶解性和抗融化性,可被广泛的应用于商业冰激凌上[2]。D-甘露糖还可以改善食品质地,GHAOUTH等[3]研究证明将D-甘露糖接种在即将腐烂的苹果中,腐烂病斑直径变小。D-甘露糖在食品领域表现出巨大商业价值,其地位日益突出。
目前D-甘露糖的制备主要有植物提取、化学合成以及生物酶法3种途径[4],其中生物酶法因其反应条件温和、环境友好和成本低等优势,已成为制备D-甘露糖的研究趋势。目前,能够以D-果糖为底物制备D-甘露糖的酶有4种[5],分别是D-甘露糖异构酶(EC 5.3.1.7)、D-来苏糖异构酶(EC 5.3.1.15)、纤维二糖2-差向异构酶(EC 5.1.3.11)和D-甘露糖2-差向异构酶(EC 5.1.3.-),它们均属于N-乙酰-D-葡糖胺-2-差向异构酶(N-acetyl-D-glucosamine-2-epimerase,AGE 超家族异构酶)。与其他3种酶相比,D-甘露糖异构酶(D-mannose isomerase,D-MIase)的催化效率较高,基本在25%~35%,被认为是甘露糖生产中最具潜力的酶。
至今已报道的D-MIase大多数来源于大肠杆菌、假单胞菌和极端嗜热菌,其最适反应温度在30~60 ℃,跨度较大。在以D-果糖为底物制备D-甘露糖时,EscherichiacoliJM109[6]来源的D-MIase在37 ℃反应8 h获得48.6 g/LD-甘露糖,Pseudomonassyringae[7]来源的D-MIase在45 ℃反应6 h获得162 g/LD-甘露糖,而Thermobifidahalotolerans[8]来源的D-MIase在65 ℃反应1 h即可生成179 g/LD-甘露糖。较高的反应温度可以大大提升D-甘露糖的制备效率,缩短反应时间,同时也可更大程度的避免染菌。因此增强D-MIase的热稳定性将有利于生物酶法制备D-甘露糖的工业化应用。本研究选择普遍存在的大肠杆菌来源的D-MIase进行酶学性质探究并进行热稳定性改造,探究热稳定性与结构的内在关系,为提高D-MIase 热稳定性奠定理论基础,同时为生物酶法高效制备D-甘露糖提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
大肠杆菌Dh5α、大肠杆菌BL21(DE3)、表达载体pET-28a(+)均由实验室保藏。
1.1.2 试验试剂
硫酸卡那霉素,上海麦克林生化科技有限公司;D-果糖、D-甘露糖,上海源叶生物科技有限公司;限制性内切酶NheⅠ和EcoRⅠ,大连TaKaRa公司;一步克隆试剂盒,南京诺维赞公司;质粒提取试剂盒、Mag-BeadsHis-Tag蛋白纯化磁珠,上海生工公司;蛋白质marker,翌圣生物科技(上海)股份有限公司;其他主要试剂均购自上海国药集团化学试剂有限公司。
1.1.3 仪器与设备
pH计,梅特勒-托利多仪器公司;Sonic VCX-750型超声波细胞破碎仪,南京新辰生物科技有限公司;SCG-030蛋白纯化系统,苏州赛谱仪器有限公司;Spark多功能酶标仪,南京科麟得科学仪器有限公司。
1.2 实验方法
1.2.1 基因组提取、基因克隆与重组菌的构建
NCBI数据库中查询得到大肠杆菌Dh5α的全基因组序列中含有D-MIase的编码基因序列,采用十六烷基三乙基溴化铵(cetyltriethylammonium bromide,CTAB)法提取的大肠杆菌Dh5α基因组DNA为模板,用引物man-iso-F/R进行PCR扩增。表达载体pET-28a(+)质粒用NheⅠ和EcoRⅠ进行双酶切并纯化,利用单片段一步克隆法获得表达质粒pET-28a-MI,转化到大肠杆菌DE3中,通过菌落PCR、测序验证得到重组菌E.coliBL21/pET-28a-MI。
1.2.2 重组大肠杆菌的诱导表达、电泳鉴定及纯化
挑取重组菌E.coliBL21/pET-28a-MI的单菌落接种于含50 μg/mL卡那青霉素的液体LB培养基中,37 ℃培养至OD600值为0.6左右,加入终浓度为0.1 mmol/L的异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG),在16 ℃诱导表达24 h,冷冻离心收集沉淀,用20 mmol/L、pH 7.4的磷酸缓冲液(phosphate buffer,PB)(磷酸氢二钠-磷酸二氢钠)重悬菌体。采用超声波破碎法破碎细胞,冷冻离心后所得上清液即为粗酶液,吸取适量粗酶液进行SDS-PAGE分析重组酶的表达情况。用1 mL镍离子柱对粗酶液进行纯化,洗脱方法如下:体积分数40%的A液(20 mmol/L PB、500 mmol/L NaCl、20 mmol/L咪唑,pH 7.4)和体积分数60%的B液(20 mmol/L PB、500 mmol/L NaCl、500 mmol/L咪唑,pH 7.4)洗脱目的蛋白,收集蛋白峰洗脱液,并将洗脱液用超滤管交换浓缩到20 mmol/L PB中保存,用于后期研究。
1.2.3 重组酶的酶活力测定方法
酶活力单位(U)的定义:1 min催化D-果糖生成1 μmoLD-甘露糖所需的D-MIase的酶量。
酶活力测定方法:以20 mmol/L、pH 7.4的PB作为缓冲液,取50 μL纯酶液,加入50 μL的D-果糖(终浓度10 mmol/L)于30 ℃水浴反应10 min后,煮沸2 min终止反应,分析生成D-甘露糖的浓度。
HPLC检测方法:色谱柱为Dionex CarboPac PA10(4 mm×250 mm)与CarboPac保护柱(4 mm×50 mm),流动相是NaOH,流速为1.00 mL/min,工作电极为Gold(Au)。
1.2.4 重组酶的酶学性质测定
最适反应温度:纯化后的酶液经PB(20 mmol/L,pH 7.4)稀释至适当浓度,分别测定在20~75 ℃的酶活力。以最高酶活力为100%,计算各温度下的相对酶活力。
最适反应pH:分别用HAC-NaAC(pH 4.0~5.5)、Na2HPO4-NaH2PO4(pH 5.5~8.0)和甘氨酸-NaOH(pH 8.0~10.0)缓冲液将pH值调至4.0~10.0后测定酶活力。以最高酶活力为100%,计算各pH值下的相对酶活力。
金属离子对酶活力的影响:向反应体系中添加不同的金属离子,终浓度为0.1、0.5、1.0 mmol/L,测定酶活力,以未添加金属离子的酶活力为100%。
动力学常数测定:选择不同浓度的D-果糖为底物(10~1 600 mmol/L),在测酶活力的条件下测定重组酶活力。使用 Lineweaver-Burk 双倒数法对D-MIase的Km值以及kcat/Km值进行计算。
1.2.5 突变体的构建
以pET-28a-MI质粒为模板,利用PrimerX网站设计突变引物(表1),使用Superpfu酶进行全质粒PCR,然后将PCR产物用DpnⅠ 酶在37 ℃消化1~2 h,取出后置于80 ℃反应2 min,转化至大肠杆菌BL21感受态中,利用菌落PCR、测序验证获得正确的突变子。组合突变体的构建方法同上。

表1 本研究使用的引物Table 1 Primers used in this study
1.2.6 耐热性突变位点的选择与优势突变体的筛选
利用AlphaFold构建D-MIase的蛋白质结构模型,上传至FireProt网站,在耐热多点突变体的计算设计板块进行模拟计算,获得突变位点。突变株经1.2.2节方法诱导表达、超声破碎后,按照Mag-BeadsHis-Tag蛋白纯化磁珠使用说明书进行蛋白纯化操作获得纯酶,测定酶活力及Tm值。
1.2.7 稳定性参数测定
半衰期t1/2:将纯酶稀释至1 mg/mL,按照每管200 μL分装至1.5 mL EP管中,置于50 ℃水浴锅中孵育,不同时间取出,冰敷后测定纯酶活力,以保温时间为X轴,比活力为Y轴作图,即可得到纯酶失活曲线,其活力损失一半时所需的时间即为半衰期t1/2。
热熔融温度(Tm)值:采用差示扫描荧光法测定Tm,将纯酶用20 mmol/L PB(pH 7.4)稀释至每40 μL含有30 μg蛋白,加入2 μL 100×SYPRO Orange protein gel stain,然后将混合物通过实时荧光定量PCR,测量其在温度从20 ℃升至90 ℃时微电流变化,通过软件模拟得到其较为准确的Tm值。
1.2.8 分子动力学模拟
利用AlphaFold构建野生型(wide type,WT)和突变体的三维结构,使用AMBER软件中pdb4amber去除氢键,然后用ff14SB力场获取动力学模拟的参数。将蛋白质放在一个缓冲距离为12×10-10m的TIP3P水盒子中,并且加入抗衡离子(Na+/Cl-)以中和体系电荷,再利用最陡下降法和共轭梯度法对结构进行优化。蛋白质在10 kcal/(mol·Å2)弱约束下,系统从0 K加热到323 K,体系内所有涉及氢原子的化学键用SHAKE算法来约束,整个过程持续50 ns,使用cpptraj.MPI程序计算重原子的均方根偏差(root-mean-square deviation,RMSD)和氨基酸残基的均方根涨落(root-mean-square fluctuation,RMSF)。模拟结果数据的可视化及分析采用Discovery Studio 2019 Client和PyMOL软件。
2 结果与分析
2.1 重组菌的构建、验证与诱导表达及纯化
按照1.2.1节构建重组菌E.coliBL21/pET-28a-MI,菌落PCR验证结果如图1-a所示,PCR产物在1 569 bp左右有明显条带,与基因大小相一致,表明重组菌构建成功。重组D-MIase的粗酶液和纯酶液的SDS-PAGE鉴定结果如图1-b所示,重组蛋白在48 kDa左右出现单一的清晰条带,表明成功纯化重组D-MIase。

a-重组菌E.coli BL21/pET-28a-MI菌落PCR鉴定电泳图 (M-Markers,1、2、3-均为重组菌E.coli BL21/pET-28a-MI); b-重组D-MIase的SDS-PAGE图(M-标准蛋白Markers, 1-空白对照,2-D-MIase粗酶液,3-D-MIase纯酶液)图1 菌落PCR验证核酸和重组D-MIase的 SDS-PAGE电泳图Fig.1 Agarose gel electrophoresis of colony PCR and SDS-PAGE of recombination D-MIase
2.2 D-MIase的酶学性质
2.2.1 最适反应温度、最适反应pH及金属离子对重组酶的影响
温度对D-MIase的影响如图2-a所示,D-MIase的最适反应温度为30 ℃,且该酶不适合在50 ℃以上反应,50 ℃时相对酶活力仅有50%。与目前其他来源的D-MIase酶学性质(表2)相比,本研究中D-MIase的最适反应温度低,耐热性差。D-MIase在不同缓冲液中的酶活力情况如图2-b所示。D-MIase的最适反应pH值为6.0~7.0,当pH>8.0时,相对酶活力降低迅速,而在酸性条件下仍有较高的相对酶活力。在相同pH的不同缓冲液中,D-MIase的酶活力也有所不同,当pH值为8.0时,D-MIase在PB中显示出更高的酶活力。如图2-c所示,金属离子对D-MIase几乎无促进作用,1.0 mmol/L的Fe3+对其酶活力有少许提高,与其他来源的D-MIase一致。D-MIase在添加Cu2+和Zn2+时酶活力损失明显,推测是Cu2+和Zn2+这两种金属离子破坏了蛋白质的二硫键,使蛋白质变性,从而失活。另外,根据表2及本研究,虽然大肠杆菌来源的酶在氨基酸序列上具有较高的同源性,但其酶学性质仍因来源于不同种而存在差异。

a-温度对D-MIase活力的影响;b-pH对D-MIase活力的影响;c-金属离子对D-MIase活力的影响图2 温度、pH和金属离子对D-MIase活力的影响Fig.2 Effects of temperature, pH, and ion on activity of D-MIase

表2 不同来源的D-MIase的酶学性质比较Table 2 Comparison of the enzymatic properties of various D-MIases
2.2.2 重组酶的动力学参数
在不同底物浓度下,测定重组酶的酶活力,以1/V为纵坐标1/[S]为横坐标得到Linewaeaver-Burk双倒数图,通过计算得到D-MIase的米氏常数Km为963.4 mmol/L,反应最大速率Vmax为12.66 mmol/(L·min),催化常数kcat为1.38 s-1,催化效率指数kcat/Km为1.4×10-3L/(mmol·s)。
2.3 耐热性突变位点的选择与优势突变体的筛选
按照1.2.6节获得以下18个突变位点:N5F、S8P、N83F、A106P、G171A、A236W、A262L、N283Y、D296P、T330Y、N411Y、Q379P、A241P、G253A、Q152G、H189G、A116V和C267G。此外,李影等[10]对Pseudomonasgeniculate来源的D-MIase进行热稳定性改造,根据序列比对,确定突变位点S122A和I390W。构建并测定50 ℃时上述20个突变体的酶活力和Tm值,其中Q152G突变体表达量低,N5F、I390W和A262L突变体为包涵体,其余突变体与WT在50 ℃时的相对酶活力如图3-a所示,Tm值和ΔTm值见表3。A116V、Q379P、A241P、G253A突变体在50 ℃时的酶活力均提高了20%以上,其中A241P突变体提高得最为明显,为WT的2.5倍,其Tm值也提升了1 ℃。Tm值是热力学稳定性的特征参数之一,是蛋白质从折叠状态变成展开状态的温度[17],由表3可知,N283Y、N411Y、A106P、Q379P、A116V、D296P、A241P的Tm值均提升了1 ℃及以上,且N283Y提升到了58.1 ℃。
根据各突变体在50 ℃的相对酶活力和Tm值,选择以下5个突变体进行半衰期测定:A116V、Q379P、A241P、G253A和N283Y。半衰期拟合曲线如图3-b所示,WT在50 ℃的半衰期为18.9 min,N283Y突变体的半衰期最长,达到了87.7 min,为WT的4.6倍,其次是A241P突变体,为43.4 min。由于A241P突变体在50 ℃时酶活力提高显著且半衰期也有所提高,因此选择A241P突变体作为迭代组合突变的模板M1。

a-突变体50 ℃时相对酶活力;b-突变体50 ℃时半衰期拟合曲线图图3 突变体50 ℃时相对酶活力和半衰期拟合曲线图Fig.3 Relative enzyme activity and fitting curve of half-life value of mutants at 50 ℃

表3 突变体的热熔融温度(Tm)和ΔTm值Table 3 The melting temperature (Tm) and ΔTmof mutants
2.4 最优突变体的确定及其酶学性质探究
以M1为模板,按照1.2.5节构建突变体A241P/A116V、A241P/G253A、A241P/Q379P、A241P/N283Y,测定各突变体的Tm值、50 ℃半衰期和50 ℃的相对酶活力,结果如图4和表4所示,M2(A241P/A116V)的半衰期由43.4 min提高到了198.4 min,为A241P的4.5倍,WT的10倍,Tm值提高了0.7 ℃。进一步构建A241P/A116V/G253A、A241P/A116V/Q379P和A241P/A116V/N283Y,M3(A241P/A116V/G253A)表现出比M2更高的酶活力,且半衰期提高到了281.7 min,Tm值提高了1 ℃。突变体A241P/A116V/G253A/N283Y和A241P/A116V/G253A/Q379P的Tm值和50 ℃相对酶活力结果显示,两者在50 ℃的相对酶活力均比M3低,而M4(A241P/A116V/G253A/Q379P)半衰期显著提升,为628.4 min,Tm值也达到了59.5 ℃。当以M4继续构建M5(A241P/A116V/G253A/Q379P/N283Y)时,50 ℃的相对酶活力明显降低,结合半衰期绘制迭代突变阶梯图5-e,确定最优突变体为M4。对M4进行酶学性质探究,结果如图4-f、图4-g所示,M4的最适反应温度为45 ℃,最适反应pH值为6.5。与WT相比,最适反应温度提高了15 ℃,最适反应pH无明显变化。
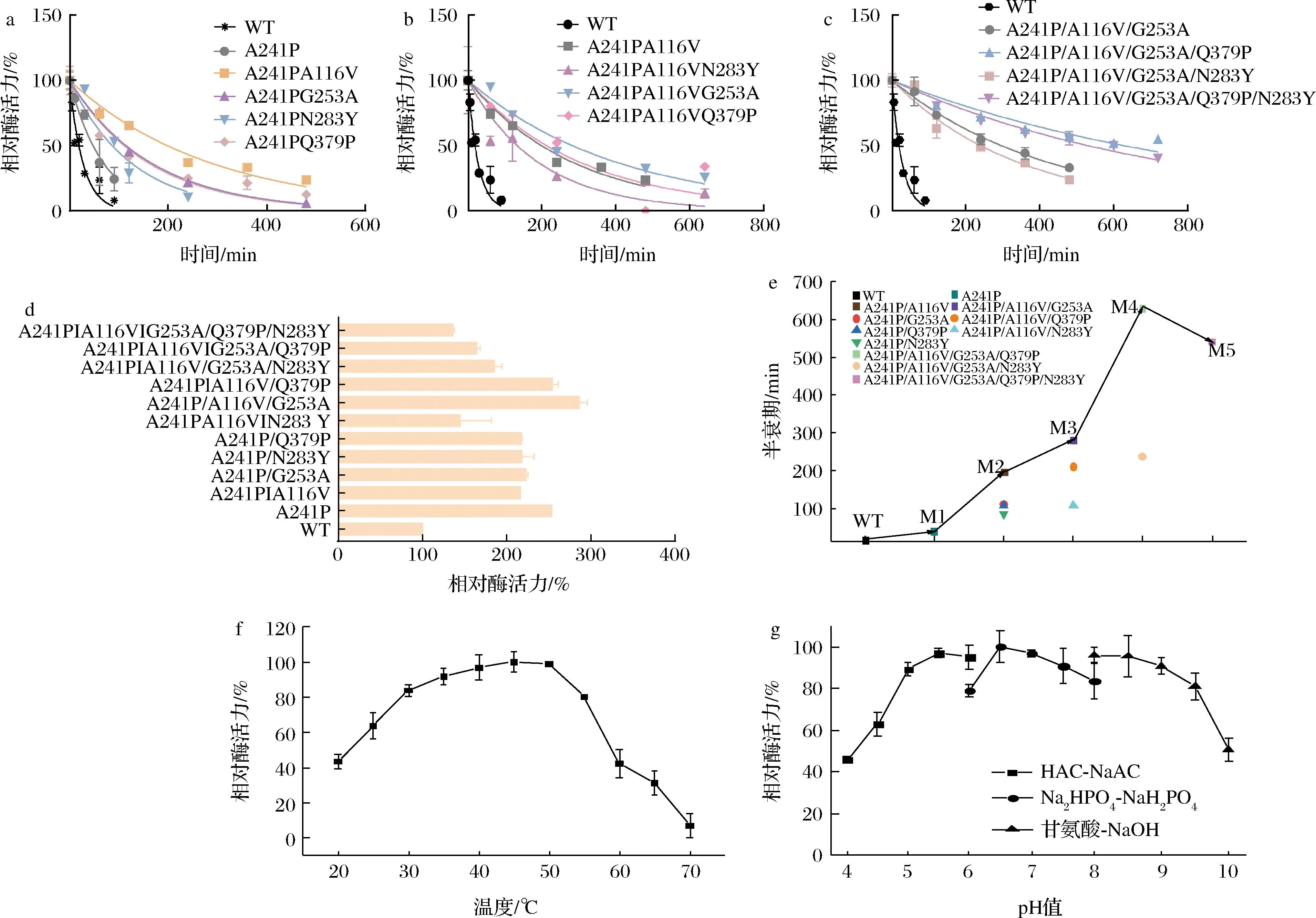
a-两点组合突变体半衰期拟合曲线图;b-三点组合突变体半衰期拟合曲线图;c-四点组合突变体和五点组合突变体时半衰期拟合曲线图; d-突变体相对酶活力;e-迭代突变阶梯图;f-温度对M4酶活力的影响;g-pH对M4酶活力的影响图4 突变体50 ℃时相对酶活力、半衰期拟合曲线图和温度、pH对M4酶活力的影响Fig.4 Relative enzyme activity and half-life fitting curve of mutants at 50 ℃ and effects of temperature, pH on activity of M4

表4 突变体的热熔融温度(Tm)和ΔTm值Table 4 The melting temperature (Tm) and ΔTm of mutants
2.5 突变体热稳定性提高的机制分析
RMSD值表示分子结构变化的程度,值越小说明蛋白结构越稳定[18],如图5-a所示,在323 K的条件下M4的RMSD值明显低于WT,由此说明,M4突变体的蛋白质构象位移较小,酶整体柔性有所降低。为进一步分析热稳定性提高机制,计算WT和M4的RMSF值,如图5-a所示。将241位的ALA突变为PRO、379位的GLN突变为PRO之后,折叠自由能分别降低1.79、2.06 kcal/mol,残基227~246区域和残基377~394区域的RMSF值明显降低,表明该区域引入突变后,增大了局部构象的稳定性。由图5-b可知,PRO-241和PRO-379位于loop区域,HUANG等[19]研究证明在loop区域引入脯氨酸可以降低蛋白质去折叠的骨架熵,增加蛋白质的刚性,显著提高蛋白质的热稳定性。
如图5-b所示,VAL-116和ALA-253分别位于α4和α8螺旋上。当116位的氨基酸由ALA变为VAL之后,其与TRP-94的相互作用力发生了改变,与WT相比,M4中增加了一个π—α疏水作用力,折叠自由能降低1.24 kcal/mol。253位的氨基酸从GLY变为ALA之后,虽然其与周围氨基酸的作用力中少了一个氢键,但是与α9螺旋上ALA-278和LEU-281分别形成了π—烷基疏水作用力,折叠自由能降低1.67 kcal/mol。因此,M4中116位VAL和253位ALA与周围氨基酸之间的疏水作用增强,使得蛋白质热稳定性提高。
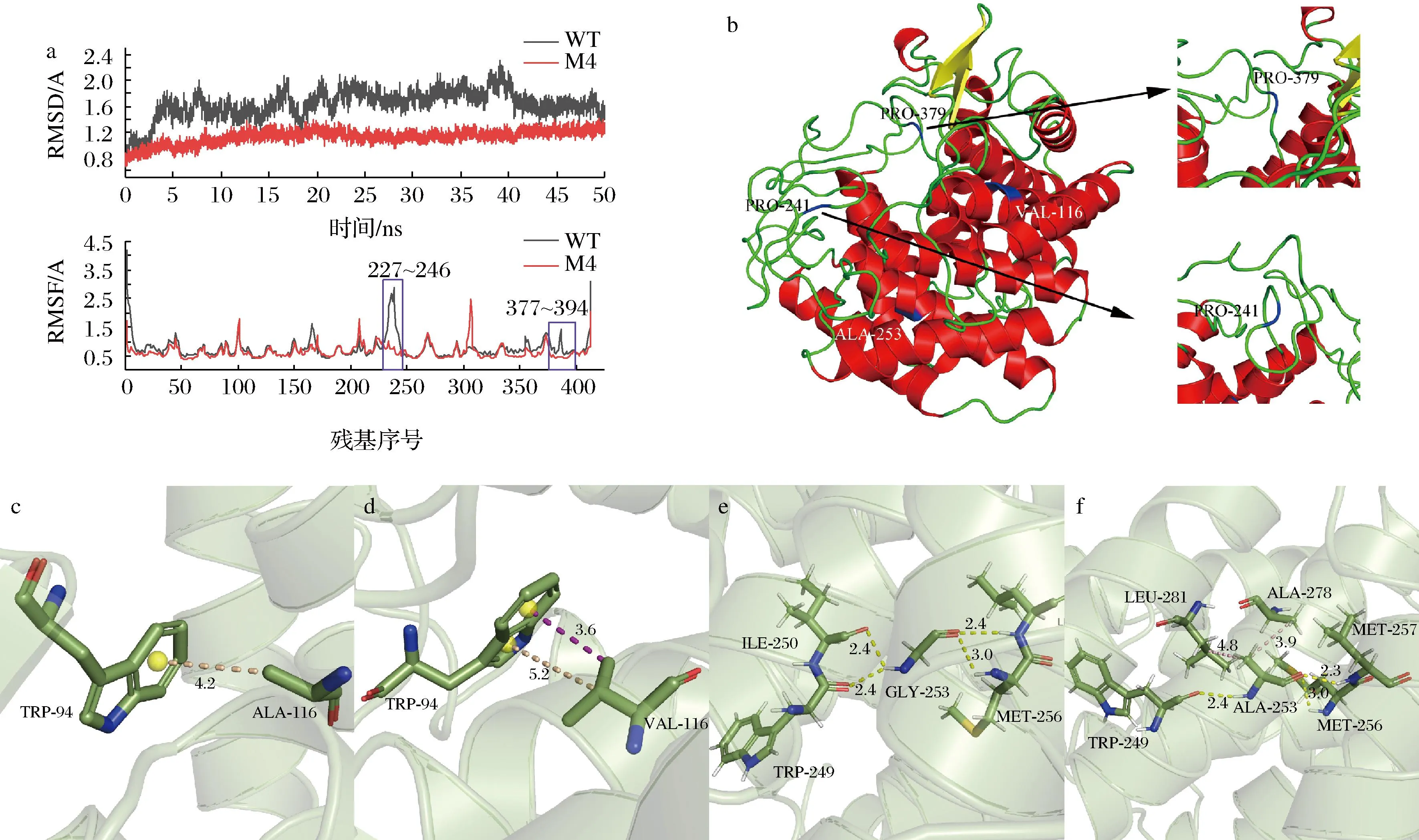
a-WT与M4的RMSD值和RMSF值;b-突变位点在D-MIase三维结构中的位置(蓝色标出);c-WT中ALA-116与TRP-94的相互作用力; d-M4中VAL-116与TRP-94的相互作用力;e-WT中GLY-253与周围氨基酸之间的作用力;f-M4中ALA-253与周围氨基酸之间的作用力图5 WT与M4的RMSD、RMSF值和突变位点与周围氨基酸的相互作用力示意图Fig.5 The RMSD and RMSF value of WT and M4 and interactions between mutations and surrounding amino acids注:黄色虚线为氢键,粉色虚线为π—烷基疏水作用力,紫色虚线为π—σ疏水作用力。
3 结论与讨论
本研究对大肠杆菌Dh5α来源的D-MIase酶进行了异源表达,蛋白经纯化后对其酶学性质进行研究分析,其酶学性质探究结果显示,D-MIase的最适温度为30 ℃,最适pH值为6.0~7.0,当以D-果糖为底物时,Km为963.4 mmol/L,反应最大速率Vmax为12.66 mmol/(L·min)。通过FireProt网站和序列比对的方法对其进行热稳定性改造,经过筛选后获得5个优势突变体,并进行迭代突变,最终获得了热稳定性提高显著且在50 ℃条件下酶活力提高了60%的M4突变体A241P/A116V/G253A/Q379P,其在50 ℃的半衰期比WT提高了32倍,最适反应温度也提高了15 ℃。
在热稳定性改造过程中,热稳定性改善的突变体其活性通常会降低,这是酶设计中常见的活性-稳定性平衡,如杜建辉等[20]研究获得的谷氨酰胺转氨酶突变体,其t1/2(60 ℃)提升2.06倍,比酶活力下降13.2%。因此,如何降低或避免活性-稳定性平衡是研究者们迫切希望解决的问题。SIDDIQUI[21]对活性-稳定性平衡进行研究并得出结论:活性-稳定性平衡是可以克服的,并提出水置换、表面改性等建议。酶活性与稳定性的关系复杂,但是两者同时得到提升对于酶的工业化应用具有重要意义。本研究获得的突变体M4其热稳定性提升的同时,酶活力也提高了60%,使得生物酶法应用于工业化生产D-甘露糖的可能性增加。
近年来,随着生物信息学及结构生物学的发展,半理性/理性设计逐步发展起来,如FRESCO、FireProt、PROSS等多重计算策略,为蛋白质热稳定性的改造提供了更多的思路及途径[22]。同时,分子动力学基于经典力学进行计算模拟,是研究结构与功能关系、酶与配体相互作用的有利的辅助计算工具。本研究通过AMBER进行模拟并计算RMSD值,发现M4突变体的整体柔性降低,进一步计算RMSF值并分析发现,loop区域的ALA-241和GLN-379突变为脯氨酸后,该区域的构象稳定性提升明显,而大量研究表明引入脯氨酸可以增加蛋白质的刚性[19]。此外,蛋白质热稳定性的提高或降低受氢键、疏水相互作用等众多因素影响[22],在本研究中,ALA-116和GLY-253在突变后疏水作用增强,蛋白质的热稳定性得到大幅度提升。
本研究表征了大肠杆菌Dh5α来源的D-MIase酶学性质,并且经过理性改造获得了热稳定性大幅度提高的突变体,为生物酶法高效制备D-甘露糖提供了理论依据,也给D-MIase热稳定性改造奠定理论基础。针对本研究中各个突变体的热稳定性特征,后续可对各个突变位点进行饱和突变并利用分子动力学模拟并进行机理分析,进一步分析D-MIase结构与热稳定性和酶活力的相关性。

