脂多糖减量合成对细胞外膜功能的影响
李婧芳,韩梦圆,李铭心,张濛,田康明
(天津科技大学 化工与材料学院,天津,300457)
细胞个体维持相对悬浮状态有利于营养物质、底物和产物的传递。细胞个体实现相对悬浮的物质基础是细胞外膜及其主要结构组成成分。大肠杆菌细胞外膜是由磷脂、脂多糖及外膜蛋白共同构成的高度不对称的脂质双分子层。外膜蛋白(outer membrane proteins,Omps)包括参与营养物质运输的微孔蛋白、维持细胞完整性的脂蛋白以及与细菌生长相关的微量蛋白。其中OmpC、OmpF和PhoE是大肠杆菌最重要的外膜孔蛋白,与脂多糖合成密切相关,并受脂多糖合成的影响[1]。脂多糖(lipopolysaccharide,LPS),包括O-抗原、核心多糖和脂质A[2-3],起到维持细胞膜完整性的作用[4]。其中脂质A结构域是一种独特的氨基葡萄糖基磷脂,作为LPS的疏水锚,是脂多糖中的生物活性中心。脂质A结构在各种细菌中相对保守,但它的结构会随着环境的变化而改变[5-6],结构的变化引起细胞外表面发生改变。现有的研究结果表明,脂质A结构的改造包括去除或修饰脂质A磷酸盐脂酰基链[7],可以通过破坏相关合成酶的结构基因和引入生物合成基因来进行人工修饰[8],实现对脂质A结构的定向改造进而改变大肠杆菌外膜的特性。有研究者提出敲除部分脂多糖合成相关基因,同时定点突变脂多糖转运蛋白编码基因以降低其底物特异性,可减少脂多糖的含量[9-11]。该研究结果为探索脂多糖减量合成对细胞外膜功能的影响奠定了基础。
细胞自凝集作为细胞外膜功能改变后的主要群体表现形式之一,是指同种细菌或不同种细菌之间在自凝集素的介导或自然条件下,相互识别而聚集形成一种絮凝状态[12-13]。在宏观上表现为静态菌悬液中菌体的沉降,在培养容器底端形成菌体沉淀。自凝集素包括作为细胞表面结构的蛋白质[14]和胞外多糖[15]以及非细胞结构的其他物质,如钙离子、镁离子[14]等。自凝集现象发生的机制有两类,一类是由表面静电效应引起的菌体聚集,包括菌体在水溶液中的疏水表面特性或表面带电的细菌细胞在带相反电荷的凝集素存在下发生的聚集;另一类是由菌体表面蛋白之间相互作用介导的聚集,这些蛋白均含有β-螺旋结构,使亲水的氨基酸残基暴露在外侧,增强蛋白质分子间的相互作用。例如细胞外膜蛋白种类或数量改变后介导细菌附着在无机材料表面,可以形成一层生物膜[16-17]。在工业生产中,菌体细胞自凝集对于实现菌体细胞的可控沉降具有显著的指导意义,并作为发酵生产结束后菌体去除的一种方法,提高发酵后期菌体的分离效率,进而降低工业产品的精制成本[18-19]。
在大多数情况下,细菌的自凝集是由表面蛋白质间的相互作用所介导的[14]。细胞外膜中的表面蛋白通常附着于脂多糖的空间间隙中。改变脂多糖的合成水平,有可能影响细胞外膜相关表面蛋白的表达水平、种类和数量,对细菌的自凝集产生一定的影响。基于此,本研究以大肠杆菌为研究对象,利用Red重组系统对部分脂多糖合成相关基因进行删除,选育脂多糖减量合成菌株,进一步探究脂多糖合成量的减少对大肠杆菌细胞结构、生长性能、外膜功能特性和自凝集特性的影响。
1 材料与方法
1.1 菌株
本研究使用的菌株见表1。
1.2 引物序列
本研究所用引物见表2,均合成自上海生工有限公司。

表2 本研究所用到的引物Table 2 Sequence of oligonucleotide primers for the construction of recombinant strains
1.3 试剂与培养基
酵母提取物、蛋白胨,Oxoid公司;苯酚,Solarbio公司;常规化学品非注明均为分析纯,国药集团化学试剂有限公司。
LB培养基[21](g/L):酵母提取物5、蛋白胨10、NaCl 10,固体培养基需另外补加18 g/L的琼脂粉;
微量元素母液(g/L):FeCl3·6H2O 2.4,CoCl2·6H2O 0.3,CuCl2·2H2O 0.15,ZnCl20.3,Na2MO4·2H2O 0.3,H3BO30.075,MnCl2·4H2O 0.495,115 ℃灭菌20 min备用。
M9培养基[21](g/L):NaCl 0.5、NH4Cl 1、KH2PO43、Na2HPO4·12H2O 15.1,接种前加入1 g/L的MgSO4(1 mol/L)和微量元素,按需添加葡萄糖。
1.4 仪器与设备
5 L离位磁力搅拌发酵罐,上海保兴公司;UV-1200紫外分光光度计,上海美普达公司;SBA-40X生物传感分析仪,山东省科学院生物研究所。
1.5 实验方法
1.5.1 重组菌株构建
重组菌株构建按照实验室常规分子操作方法[22]进行。基因删除的顺序如下:msbA、kdsD、lpxL、pagP、lpxP、eptA和lpxM;按照实验理论设计,各突变盒条带对应大小分别为5.2、2.0、2.0、2.1、2.0、2.0、1.8 kb;基因删除前对应野生型条带大小分别为2.0、2.1、1.6、1.3、1.6、1.5、1.0 kb;完成基因删除后,对应突变型条带大小分别为4.2、1.4、1.0、1.0、1.2、1.1、0.8 kb。
1.5.2 细胞干重及脂多糖含量测定
在单位OD600下对菌体干重和脂多糖含量进行测定。其中菌体细胞干重采用烘干法,脂多糖提取方法参照改良后的热酚水解法[23]进行。
1.5.3 细胞外膜渗透性及表面疏水性测定
细胞外膜渗透性及表面疏水性测定参照HELANDER等[24]和DEL等[25]的方法。
外膜渗透性测定:依照初始OD600=0.02转接到LB液体培养基中,37 ℃,200 r/min恒温培养,用10 mmol/L磷酸盐缓冲液将收集到的菌体洗涤、打散混匀后,得到OD600值为0.5的菌悬液。在石英比色皿中加入1 920 μL菌悬液和80 μL浓度为10 μmol/L的N-苯基-1-萘胺(N-phenyl-1-naphthylamine,NPN)溶液,吹吸混匀,设置参数:激发波长350 nm、发射波长428 nm,缝宽5 mm,读取各样本稳定后的数值。每个样本设置3个平行样本。
表面疏水性测定:从固体平板挑取单菌落转接至LB液体培养基(50 mL/250 mL)过夜培养,取菌液控制初始OD600=0.2,转接到新的LB培养基中,37 ℃培养至OD600=2.0。6 000×g离心10 min,用磷酸盐缓冲液(pH 7.4)将收集的菌体洗涤沉淀2次并重悬,得到菌悬液OD600=1.0。取5 mL菌悬液置于试管中,并加入2 mL的二甲苯溶液,充分振荡混匀120 s,常温下垂直静置30 min,取下相液体测定600 nm处吸光度。每个样品设置3个平行。根据二甲苯添加前后的菌液吸光度差异,计算细胞疏水性,如公式(1)所示:
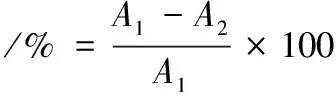
(1)
式中:A1为添加二甲苯前OD600值,A2为添加二甲苯后下层液体OD600值。
1.5.4 细菌自凝集特性测定
菌体细胞自凝集率测定参照ROUX等[26]的方法。按照初始OD600=0.02,将菌液转接至LB培养基中,37 ℃, 200 r/min培养12 h。2 656×g离心10 min收集菌体,用磷酸盐缓冲液洗菌体两次,并重悬菌体控制OD600=2.5。取5 mL重悬液于玻璃试管中,在4 ℃静置48 h,测定液面下1 cm处的菌液浓度,每个样品设3个平行,计算如公式(2)所示:

(2)
式中:A3为自凝集前OD600值,A4为自凝集后上层菌液OD600值。
2 结果与分析
2.1 脂多糖减量合成菌株的构建
以实验室保藏菌株E.coliLG101为出发菌株,按照1.5.1节方法,对脂多糖转运蛋白MsbA的148位碱基C定点突变为T,在此基础上完成脂多糖合成及结构修饰的相关基因的叠加删除,并完成重组菌株的构建,依次命名为LGL4A01~LGL4A06。
在筛选得到已完成脂多糖转运蛋白编码基因msbA的定点表达菌株的基础上,根据图1所示的电泳结果可知,突变型和野生型条带大小与1.5.1节中理论条带大小一致,可以得出已成功删除1.5.1节中全部的脂多糖合成关键基因并构建重组菌株,命名为LGL4A06,用于后续研究。
2.2 菌体及脂多糖合成量评价
由2.1节结果可知,菌株LGL4A06关于脂多糖合成及结构修饰的基因型已发生变化。进一步在摇瓶培养条件下,测定出发菌株和重组菌株LGL4A06菌株脂多糖含量和菌体细胞干重(图2)。结果显示,与出发菌株LG101相比,菌株LGL4A06的脂多糖含量和细胞干重均有所下降,单位OD600菌体干重下降了32.46%(12 018.72 μg / 8 116.78 μg),脂多糖含量下降了39.34%(1 389.73 μg/842.97 μg),根据脂多糖的减少量可以得出影响脂多糖合成的关键基因是lpxM,且随着部分脂多糖合成关键基因叠加删除,单位OD600菌体干重和脂多糖含量整体呈递减的趋势,进一步证实上述重组菌的选育过程实现了脂多糖的减量合成。
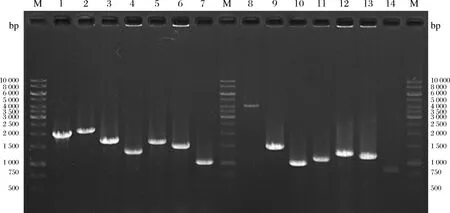
1~7-lldD、kdsD、lpxL、pagP、lpxP、eptA,lpxM野生型对照;8~14-lldD、kdsD、lpxL、pagP、lpxP、eptA,lpxM突变型大小;M-1 kb gene ladder图1 出发菌株和重组菌分子鉴定电泳图谱Fig.1 Identification of mutant strains through colony PCR

a-单位OD600菌体干重;b-单位OD600脂多糖含量图2 细胞单位OD600对应菌体干重及脂多糖含量Fig.2 Dry cell weight and lipopolysaccharide content of strains
2.3 细胞外膜渗透性及表面疏水性评价
有研究表明,脂多糖及外膜蛋白OmpF和OmpC影响细胞外膜渗透性[27],截短脂多糖结构或外膜蛋白缺失均可引起外膜渗透性变化;以此为依据,本研究评价脂多糖的减量合成对细胞外膜渗透性和表面疏水性的影响,进而通过二者前后的变化评价脂多糖的减量合成对细胞外膜功能的影响。
与出发菌株LG101相比,脂多糖减量合成菌株LGL4A06的外膜渗透性如图3结果显示,提高了55.05%(721.93/465.60)。菌株LGL4A06的细胞表面疏水性相较于菌株LG101提高了5.81倍(34.34%/5.04%)。

a-外膜渗透性测定;b-细胞表面疏水性测定图3 细胞外膜相关功能特性测定Fig.3 Determination of relevant function of the outer membrane
2.4 脂多糖减量合成对细胞自凝集效率的影响
2.4.1 菌体自凝集特性测定
在研究中发现,菌体改造后自凝速率相对于出发菌株有着明显的变化,按1.5.4节方法测定二者自凝集性能差异性,结果如图4所示,出发菌株LGL101和突变菌株LGL4A06在静置72 h后,菌体自凝集率均达到80.00%以上,但是突变菌株耗时更短;改造后的菌株LGL4A06在静置12 h时,菌体自凝集率为83.20%,此时,出发菌株自凝集率仅为6.00%;细胞表面疏水性增强可提高细胞间的相互作用力[12],由2.2节结果显示脂多糖减量合成导致菌株LGL4A06疏水性较出发菌株提高了5.81倍,因此进一步提高了菌株自凝集率。
在本研究中发现,菌体改造后自凝速率相对于出发菌株有着明显的变化,按1.5.4节方法测定二者自凝集差异性。结果如图5所示,出发菌株LGL101自凝集率均低于突变菌株LGL4A06,LG101自凝集率约为5.00%,LGL4A06自凝集率在80.00%以上;同一菌株自凝集率不受环境因素的影响,这一结果与王洲等[17,23]的研究结果一致。
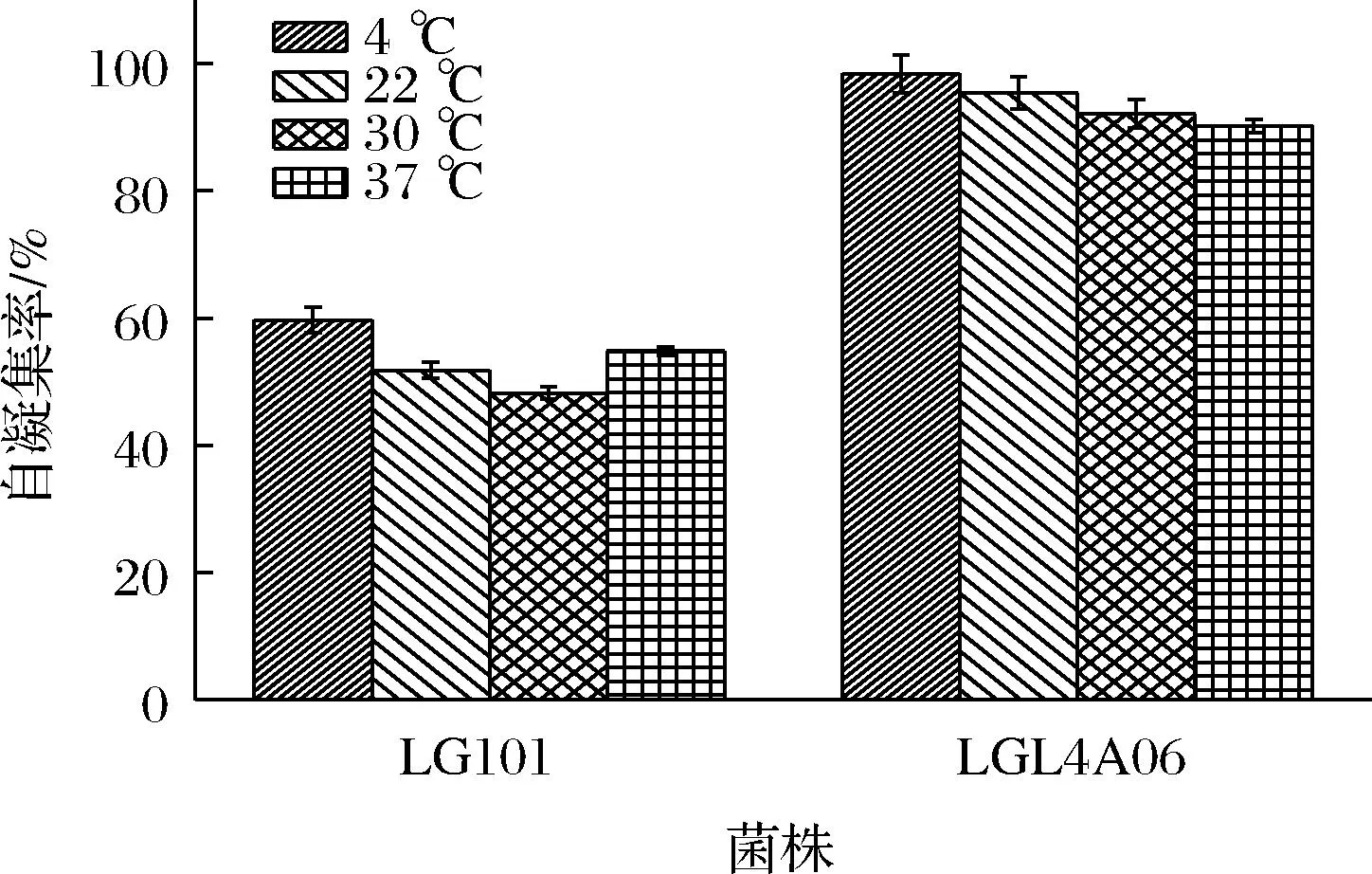
图5 不同温度对LGL4A06菌株和出发菌株菌体 细胞自凝集性能的影响Fig.5 The auto-aggregation ratio of LG101 and LGL4A06 at different temperature
2.4.2 钙离子、镁离子对菌体自凝集特性的影响
如图6所示,添加钙离子、镁离子对出发菌株LG101自凝集特性无影响,但可有效提高突变菌株LGL4A06自凝集速率。重组菌株LGL4A06添加10 mmol/L钙离子后静置4 h,自凝集率即达到95.00%,添加10 mmol/L镁离子的重组菌株自凝集率为83.00%,未额外添加金属离子的突变菌株自凝集率为22.00%,出发菌株自凝集率仅为(6.50±0.50)%;添加钙离子、镁离子的突变菌株在静置5 h后,自凝集率均达到最大(钙离子:97.00%;镁离子:88.00%)。出现这一结果的可能原因是脂多糖减量合成导致镶嵌于外膜的蛋白质含量减少,增加了糖脂磷酸基团与二价阳离子的结合,形成静电吸引,加速菌体沉降[14]。

a-钙镁离子对菌株自凝集性能影响折线图; b-钙镁离子添加后各菌株静置4 h状态图图6 钙镁离子对菌株LGL4A06和出发菌株LG101菌体 细胞自凝集性能的影响Fig.6 Effect of divalent cation on auto aggregation of LG101 and LGL4A06
3 结论与讨论
脂多糖结构变化可影响菌体自凝集特性,具体表现为脂多糖结构简化提高菌株自凝集率,12 h内脂多糖减量合成菌株自凝集率较出发菌株提高了13.9倍;菌株的自凝集速率不受环境温度的影响;外加钙离子、镁离子可显著提高菌株自凝集率,可将自凝集进程缩短至5 h。同时,简化脂多糖结构可降低脂多糖含量,在发酵生产过程中,能够将用于形成细胞结构的碳源更多地流向产物形成,进一步提高底物到产物的转化率,降低生产成本。自凝集在工业上的应用价值主要是发酵后期菌体与产物的分离,提高菌体自凝集效率可简化产品精制步骤,有效降低生产成本。

