CT、MRI检查对肝癌患者经动脉化疗栓塞术后残留或复发病灶的诊断价值
徐 海 王 信
(中山大学附属第一医院医学影像科,广东 广州 510080)
近年来,我国肝癌发病率呈递增趋势,其死亡率在各类肿瘤中跃升至第三位,仅次于肺癌、胃癌[1]。肝癌临床症状多不明显,在早期一般无特异性症状,导致患者往往会在发现时就已是中晚期,错失手术黄金治疗期,此时需借助介入治疗,而经动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)在肝癌介入治疗中应用广泛。有研究显示[2],TACE治疗后肝癌患者1年内生存率可达85%,但因肝脏肿瘤具有多重血供和侧支循环,难以完全灭活病灶,术后易发生复发转移。因此,及时准确评估治疗效果,早期发现TACE术后残余或复发病灶,对于进一步确定治疗措施至关重要。DSA是临床公认的诊断肝动脉解剖疾病的金标准,可清晰显示术后残余病变和血供,但其作为一种侵入性检查,易增加患者二次伤害,加上重复性差、检查费用较高等特点使其在临床应用中相对受限,故需寻找其他合适的影像学检查方式[3]。在影像技术不断发展下,定位、定性的肝脏成像被广泛应用于临床肝癌疗效评估,其中尤以MRI、CT检查最为常用。但对于应用二者评估肝癌患者TACE术后残留或复发病灶的对比研究报道还较少。基于此,本研究选取中山大学附属第一医院2020年6月至2023年5月期间收治的106例肝癌TACE术后患者进行MRI和CT的诊断价值对比,以期为后期临床诊断选取提供参考依据。
1 对象与方法
1.1 研究对象 选择中山大学附属第一医院2020年6月至2023年5月期间106例接受TACE手术的肝癌患者作为研究对象,本研究经患者、家属签署知情同意书及医院伦理委员会批准。
纳入标准:①符合肝癌的诊断标准[4];②均首次接受TACE术;③影像学资料完整;④凝血功能正常。排除标准:①近3个月内接受重大腹部手术;②近期有消化道出血史;③对碘对比剂过敏;④图像质量差;⑤严重全身感染。
1.2 方法 每位患者均接受CT、MRI及数字减影血管造影(DSA)检查。
CT检查:使用螺旋CT扫描仪检查(日本东芝,Aquilion ONE,320排),参数为:管电压、电流各130 kV、180 mA,层厚、螺距各6 mm、1.2 mm,准直0.6~1.2 mm,层间距8 mm,患者仰卧位,依次平扫上腹部横膈膜顶部至肾脏上极,平扫后,应用高压注射器在肘静脉处注入1.5 ml/kg碘克沙醇对比剂(速度2.5~3.0 ml/s),并在对比剂注射20~30 s、60~70 s和120 s间,分别进行动脉期、门脉期和延迟期全肝扫描,根据需要进行多层重建,厚度为1.25 mm,无间距,使用最大肿瘤直径作为标准来描绘感兴趣区(位于显著强化区),测量病灶肝实质。
MRI检查:使用德国西门子超导MRI扫描仪(Skyra 3.0T)及8通道体相控阵线圈,检查前对患者进行呼吸训练,患者掌握后以仰卧位头先进作为扫描位进行冠状位、横断面扫描,于患者体内注入对比剂钆喷酸葡胺0.2 mmol/kg(速率2 ml/s),T1WI扫描重复110 ms,回波2.4 ms;T2WI重复4.8 ms,回波2.3 ms;二者视野260 mm×350 mm,层厚6 mm,带宽380 Hz,矩阵348×512,层间距7.8 mm。在注射对比剂20 s、40 s和60 s时,增强扫描依次为动脉早/晚期、门静脉期,尽可能保证双肾脏下极与肝脏膈顶的覆盖,全肝扫描在动脉期(30 s)、门脉期(60 s)和延迟期(120 s)进行,完成后,原始数据上传到图像工作站进行图像重建。
DSA检查:使用德国西门子Artis Zeego Ⅲ血管造影机,平卧位,并通过股动脉一侧进行导管插入术,依次检查肝总、肝固有动脉及肝左右动脉,以确定肿瘤病变的存在。如果病灶处未发现有染色,而其余相关实验室指标检查出病灶残留/复发,则需对肋间动脉、胃左动脉、肠系膜上动脉等肝外动脉进行检查,以确定病变是否复发。用300 mg/ml碘普罗胺以4~6 ml/s的注射速率收集静脉、动脉和实质期图像。
1.3 观察指标 评价DSA对TACE术后残留或复发病灶的检出情况。评价CT、MRI在病灶中的动脉期、门脉期、和延迟期、影像学表现,复发和残留定义如下,复发:术后6个月,CT、MRI显示肝内再次浸润,局部复发;残留:术后一周内,CT、MRI检查发现癌细胞病灶上有少量阴影。
以DSA的检查结果为诊断金标准,分析两组检查的诊断效能(特异度、敏感度、准确度),与金标准的一致性,以及对残留或复发病灶类型(无包膜、直径≤5 cm的小病灶)的检出率。特异度、敏感度、准确度公式:特异度=真阴性数/真阴性数+假阳性数;敏感度=真阳性数/真阳性数+假阴性数;准确度=检测正确的数量/总检测样本数量×100%。
1.4 统计学方法 数据录入SPSS 22.0软件中分析,一致性分析采用Kappa检验,Kappa<0.40一致性较差,0.40~0.75一般,≥0.75较好;计数资料用率(%)表示,采用χ2检验;计量资料符合正态分布时,用表示,采用t检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 基线资料 共纳入106例患者,其中男67例(63.21%);年龄范围40~68岁,平均(51.62±5.27)岁;美国东部肿瘤协作组制定的ECOG(Eastern Cooperative oncology Grou)体力状况评分(1.34±0.17)分;病程范围2~8年,平均(5.34±1.52)年;BMI(21.57±0.42)kg/m2;Child-Pugh分级A级58例,B级48例;合并冠心病47例,合并高血压21例。
2.2 DSA对TACE术后残留或复发病灶的检出情况 DSA检查显示106例肝癌TACE术后患者有134个病灶,其中有残留或复发病灶(阳性)83个(62例),无病灶残留或复发病灶(阴性)有51个(44例),分别占比61.94%(83/134)、38.06%(51/134)。其中在83个病灶中,无包膜57个,小病灶(直径≤5 cm)26个,分别占比68.67%(57/83)、31.33%(26/83)。
2.3 CT、MRI在检查病灶时的影像学表现对比 CT、MRI在动脉期信号方面对比有差异(P<0.05);在门脉期、延迟期信号方面对比无统计学差异(P>0.05)。见表1。
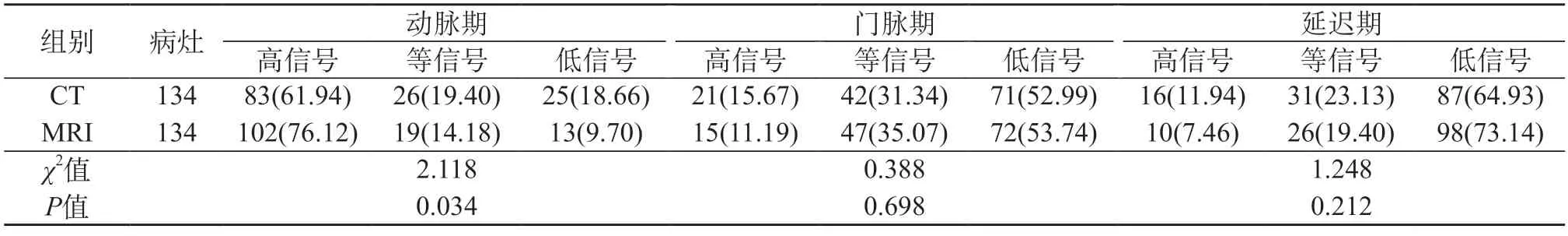
表1 CT、MRI在检查病灶时的影像学表现对比[例(%)]
2.4 两组检查与金标准的一致性对比 金标准检测到的134个病灶中,有残留或复发病灶(阳性)83个,无残留或复发病灶(阴性)51个。CT与金标准一致性较差,Kappa值为0.394,MRI与金标准一致性一般,Kappa值为0.676。见表2。
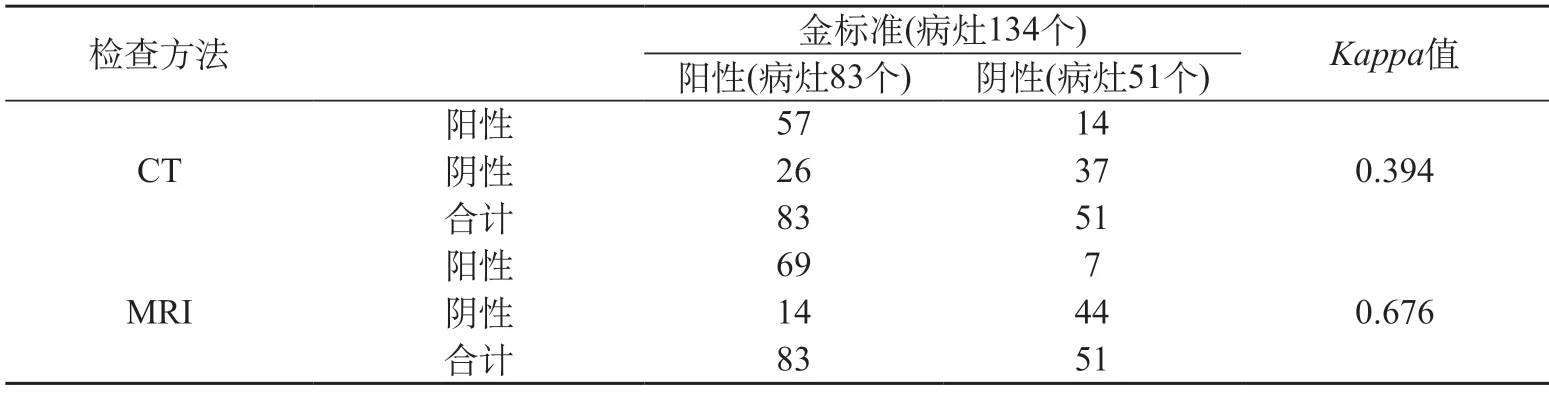
表2 两组检查与金标准的一致性对比
2.5 两组检查的诊断效能对比 MRI对于该类疾病的诊断敏感度、准确度均高于CT(均P<0.05),特异度虽略高于CT,但二者对比无统计学差异(P=0.087)。见表3。

表3 两组检查与金标准的诊断效能对比
2.6 两组检查对残留或复发病灶具体类型的检出率对比 MRI对于无包膜、小病灶(直径≤5 cm)的检出率均高于CT(P<0.05)。见表4。
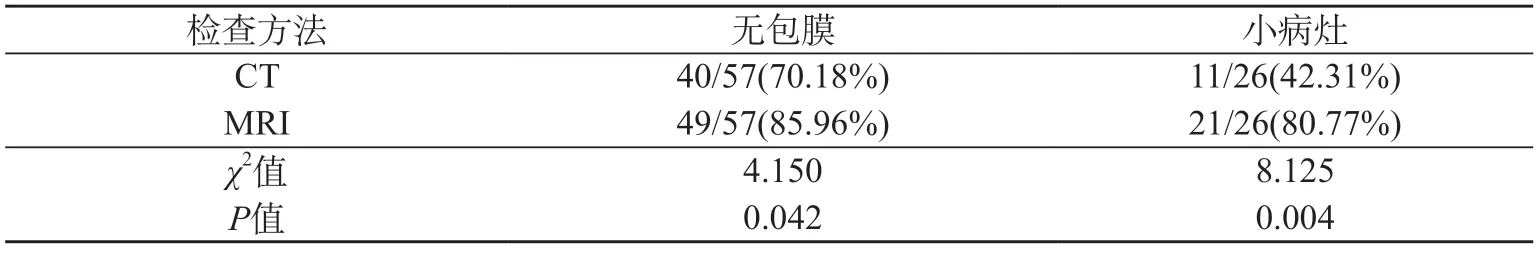
表4 两组检查对残留或复发病灶具体类型的检出效能对比
3 讨论
肝癌最有效的治疗方法是手术根治性切除,但对于体积大、血供复杂的中晚期肝癌患者而言,常需TACE作为介入治疗,主要通过选择性地将肝动脉导管插入肿瘤供应靶动脉,以注入化疗药物和适当栓塞剂来闭塞肿瘤供应靶血管,最终缩小肿瘤组织,改善患者预后[5]。但在对肝癌患者进行介入治疗时,由于肝脏血管的复杂性和该区域血管再生能力较强,坏死后仍会有部分病灶残留在体内,且多在栓塞后出现,可导致病灶出现不完全性坏死,进而引起病灶转移或复发等情况的发生[6]。因此,肝癌患者在接受介入手术后,有必要评估肿瘤活性和特异性数量,以控制疾病进展。
既往肝癌介入术后常采用DSA作为金标准进行检查,其也是观察病灶活性的有效方法,但由于肝细胞具有较强的再生能力,需长期观察检测,而DSA是有创检查,且操作复杂,检查成本高,很难将其作为一种长期的随访检查方法。有研究指出病灶多重供血是导致肝癌患者TACE术后发生复发或转移病灶的主要原因[7]。因此,从上述方面入手进行相应影像学检查方式的选择,以提高检测效果,现阶段,临床上主要以CT、MRI的应用最为广泛,但目前临床对二者在TACE疗效评估中的价值尚未达成一致,基于此,本研究对其二者进行对比探讨具有重要意义。
文献报道,CT、MRI检查能有效肝癌患者的强化特征,表现为动脉期强化,主要为高信号强度,而在正常肝实质中,强化并不显著,部分呈轻度强化表现;门脉期强化值达峰值,病变表现为低或等信号强度;延迟期病变信号则显著降低,以低信号为主[8]。而在本研究中对CT、MRI进行影像学表现的探讨显示,二者在门脉期、延迟期信号方面对比无差异,均以等或低信号为主,具有“快进快出”的强化模式,与上述研究报道相符;而二者在动脉期信号虽均以高信号为主,但MRI表现相对明显,考虑在于MRI造影剂快进快出,T1期低信号占位,T2期稍高信号影,动脉期对比剂进入肝癌组织内速度快,大多数病灶在动脉期、门脉期表现出明显强化,能更好地反映肝周围组织结构[9]。本研究进一步比较二者对TACE术后复发或转移病灶的诊断效能显示,MRI与金标准一致性、敏感度、准确度等均较CT高,这显示MRI可以对术后病变复发和残留状态提供更全面的评估。分析可能是因为内部碘沉积是影像评估TACE术后病变的主要方式,且TACE术中以碘油作为栓塞剂。CT检查主要使用X线进行显影,而X线难以透过碘油,此情况下,扫描上难以出现高密度阴影,也难以对碘油内部情况和沉积位置进行准确扫描,甚至无法准确评估TACE术后碘油沉积不均匀部位的残留或复发病灶,导致漏诊误诊的情况产生,准确度也相应降低[10]。而碘油沉积对MRI扫描影响小,甚至不会产生影响,故能够在自身所形成的多参数成像特性和扫描流空效应下,有效提高诊断准确性,且在使用对比剂增强后可在一定程度上帮助区分诊断残留、复发性病灶与病灶出血或自然坏死,故准确度相对较高[11]。但MRI强化后的残留或复发病灶容易与高密度碘油混淆,这也是本研究中MRI诊断特异度虽略高于CT,但对比却无差异的原因。因此本文建议,在后期的研究中可基于二者优势互补,通过两种检查方式的联合以进一步提高TACE术后残留或复发病灶的鉴别准确率。
病理学研究指出,经TACE治疗后的肝癌患者,在TACE的栓塞作用下,病灶周围会有大量纤维包膜生成,形成防御性网罩,能够对肿瘤生长、迁袭进行抑制,防止其向周围组织结构延伸,避免形成肿瘤侧支循环[12]。可见,肿瘤包膜的形成与否对临床疗效评价具有重要价值。
本研究中,相较于CT检查而言,MRI无包膜病灶的检出准确率更高,可见MRI在病灶包膜的评估上优势更为显著。主要在于MRI具有多参数、多方位扫描成像特点,在肝脏内部组织、胆管血管结构等方面诊断敏感性较高,能够使得包裹于其外的包膜显示得更加明显;然而,由于CT扫描容易出现伪影,无法清楚地显示病变的组织结构,导致包膜检出准确率不佳[13]。此外,周华等[14]等显示,在直径≤5 cm的病灶检出中,MRI检查检出率更高,而CT检查主要用于直径>5 cm的病灶检出。本研究在小病灶(直径≤5 cm)的检出中也显示出MRI更具优势,与上述研究结果相似。这是因为当病灶>5 cm时,内含丰富的血供,故CT诊断准确性相对较高,但因该方法对比剂用量相对较大,难以产生密集的对比剂簇,故对小病灶的诊断有一定的困难[15];而小病灶血液供应相对较弱,MRI由于其成像速度慢和场强特性,对小病灶的诊断准确率相对较高。
综上所述,在诊断肝癌患者TACE术后残留或复发病灶时,与CT检查相比,MRI具有更高的诊断价值,对残留或复发病灶的检出敏感度、特异度和准确度均较高,而且能够更好地显示小病灶和病灶包膜,可作为肝癌TACE术后疗效的一种评估方式。

