握力、骨密度及血清25羟基维生素D与老年2型糖尿病患者跌倒风险的相关性
付晨,陈玲
(锦州医科大学附属第一医院呼吸内科,辽宁 锦州 121000)
我国是世界上糖尿病患者较多的国家,T2DM是一种常见的代谢性疾病,其定义是胰岛素抵抗和胰岛素分泌受损引起的高血糖水平[1]。跌倒是指一个人跌落在地面、地板或其他较低水平的意外事件,是老年人发病、受伤、住院以及死亡的重要原因[2]。老年T2DM患者遭受更多复发性跌倒[3],受伤住院风险增加[4],住院时间更长,因跌倒再入院频率增加[5]。如今,已经有很多学者研究分析出影响老年T2DM患者跌倒风险的危险因素。例如:下肢肌肉无力、步速减低、糖尿病视网膜病变、使用胰岛素[6]。虽然部分影响因素已经被确定会增加老年T2DM患者的跌倒风险,但是仍有很多因素存在争议。因此,必须评估老年T2DM患者跌倒风险的危险因素[7]。
握力检查是评估老年人群活动能力和身体机能快速可靠的方法[8]。握力可预测大多数老年人的发病率和死亡率[9],双能X线吸收法(dual-energy X-ray absorptiometry,DXA)测量骨密度是目前识别骨量低而有高跌倒风险的一种检查方法[10]。法国专家组最近建议对有跌倒史的患者进行骨密度检测,这一建议的理由是:跌倒患者的骨密度测量为骨折风险提供了重要信息[11]。25-OH-VD是评价维生素D状态的最佳指标,与T2DM的发生和疾病控制密切相关[12]。观察性研究表明,维生素D水平与跌倒风险之间存在反比关系,这在老年人群研究中得到了证明[13]。2018年的一项荟萃分析发现,25-OH-VD的补充剂量几乎没有效果[14]。目前,将握力、骨密度、TUGT、化验检查、降糖药物及糖尿病并发症与老年T2DM患者跌倒风险联系起来的研究甚少,并且研究结果均不一致,因此本研究重点分析握力、骨密度及25-OH-VD对老年T2DM患者跌倒风险,选择最佳干预措施预防老年T2DM患者跌倒。
1.资料与方法
1.1 资料来源
选取2022年6月至2022年12月在锦州医科大学附属第一医院内分泌(多学科)门诊就诊的老年人群为研究对象,年龄为60~85岁,经过筛选最终纳入160例,其中T2DM患者110例为糖尿病组,非糖尿病患者50例为对照组。
纳入标准:(1)患者年龄60~85岁;(2)患者T2DM诊断均符合《中国2型糖尿病防治指南(2020年版)》[15]中相关诊断标准;(3)患者能够接受问卷调查并自愿完成各项检查。
排除标准:(1)1型糖尿病、反复发生低血糖及其它特殊类型糖尿病患者;(2)明确诊断3级高血压病、严重的心脑血管及呼吸系统疾病、肝肾功能严重衰竭、恶性肿瘤及长期卧床患者;(3)既往明确诊断骨折病史;(4)既往有截肢史、下肢严重畸形及周围血管疾病患者;(5)既往患有严重视力或听力障碍者;(6)终末期肾病(透析治疗)患者;(7)其他内分泌疾病如:库欣综合征、嗜铬细胞瘤患者;(8)沟通失败、完全不能正常配合完成本研究方案者;(9)非糖尿病患者排除糖尿病及其它系统严重疾病者。
1.2 临床资料的收集
一般资料包括入选患者的年龄、性别、身高、体重、体重指数(BMI),BMI=体重/身高2(kg/m2),详细询问并记录T2DM患者病程、并发症及使用降糖药物情况,根据降糖药物种类分为磺酰脲类(sulfonylurea,SU)、双胍类(biguanide,BG)、二肽基肽酶4(dipeptidyl peptidase-4,DPP-4)抑制剂、胰高血糖素样肽-1(glucagon like peptide-1,GLP-1)、钠-葡萄糖协同转运蛋白-2(Sodium-glucose cotransporter-2,SGLT-2)、α-葡萄糖苷酶抑制剂(α-Glucosidase inhibitor,AGI)以及胰岛素。检验资料包括所有筛选入组的患者,要求空腹大于8 h以上,通过静脉采取血液测定化验指标25-OH-VD、HbA1c、BUN、SCr、UA、CHO、TG、HDL-C、LDL-C。根据《中国2型糖尿病防治指南(2017 版)》[16]糖尿病并发症诊断标准,记录糖尿病患者发生糖尿病视网膜病变(diabetic retinopathy,DR)、糖尿病周围神经病变(diabetic peripheral neuropathy,NPN)、糖尿病肾病(diabetic nephropathy,DN)、周围血管病变(peripheral vascular disease,PVD)、心脑血管疾病(cardiovascular and cerebrovascular,CCVD)情况。
1.3 骨密度检测
采用GE Lunar iDXA TBS旗舰版双能X线骨密度仪测量腰椎L1~L4及左侧股骨的骨密度,扫描部位为腰椎L1~L4和左侧股骨,扫描后结果显示在骨密度报告中,T值表示腰椎L1~L4及左侧股骨骨密度的实测值,骨密度报告均由本院骨密度检查工作室的两位专业技术人员测定。
1.4 计时起立-行走测试
计时起立-行走测试(TUGT)[17]用于评估并检测患者动态平衡功能,具体操作方法如下:参与者被要求从座椅上站起来,走3 m后返回椅子坐下,记录完成测试的时间。完成任务的时间越长,说明参与者的流动性和动态平衡性就越差,如时间≥14 s,则表明其具有跌倒风险。
1.5 握力检测
由两名专业医生进行数据采集,采用Jamar Plus+握力器测量患者握力,握力器手柄的宽度根据每个参与者手部大小进行调整。我们将指导参与者用惯用手的最大力量握住握力器,结果选取检测3次的平均值。选择亚洲肌少症工作组2019年诊断标准[6]119-134男性握力值<28 kg、女性握力值< 18 kg,诊断为肌力减弱。
1.6 跌倒风险评估
入选者由一名专业医生进行约20 min的访问,选用Morse 跌倒风险评估量表[17],评估老年T2DM患者的跌倒风险,该内容包括跌倒记录、医疗诊断情况、步行是否需要辅助等6种条目,根据评分情况进行记录,总分≤24分为无跌倒风险,总分≥25分为跌倒风险。
1.7 统计学方法
采用SPSS 23.0软件对数据进行统计学分析,满足正态分布且方差齐的计量资料采用均数±标准差表示,比较采用两样本独立t检验,计数资料采用n(%)表示,比较采用χ2检验,多元Logistic回归分析影响跌倒风险的危险因素,以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者临床资料及发生跌倒风险情况比较
糖尿病患者跌倒风险组发生率72.72%明显高于对照组发生率60%,两组对比在握力、握力减低、腰椎L1~L4、左侧股骨骨密度、25-OH-VD、TUGT、HbA1c因素中差异均有统计学意义(P<0.05)。两组对比在年龄、性别、BMI、BUN、SCr、UA、CHO、TG、HDL-C、LDL-C因素中差异均无统计学意义(P>0.05),见表1。
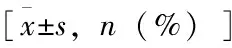
表1 糖尿病组与对照组基本临床资料及发生跌倒风险情况比较
2.2 糖尿病组患者以跌倒风险分组的一般资料及生化指标比较
两组间跌倒风险组25-OH-VD(17.20±3.30)明显低于无跌倒风险组(26.46±2.11)(P<0.001)。两组在年龄、性别、糖尿病病程、BMI、HbA1c、BUN、SCr、UA、CHO、TG、HDL-C、LDL-C因素中均差异无统计学意义(P>0.05),见表2。
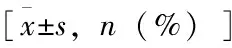
表2 糖尿病组患者以跌倒风险分组的一般资料及生化指标比较
2.3 糖尿病组患者以跌倒风险分组的测量指标比较
糖尿病组患者中跌倒风险组的握力、握力减低、腰椎L1~L4、左侧股骨骨密度、25-OH-VD、TUGT显著低于无跌倒风险组,差异均有统计学意义(P<0.05),见表3。
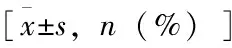
表3 糖尿病组患者以跌倒风险分组的测量指标比较
2.4 糖尿病患者以跌倒风险分组的慢性并发症的比较
跌倒风险组和无跌倒风险组在并发症数量、NPN、DR、DN、PVD、CCVD差异均无统计学意义(P>0.05),见表4。
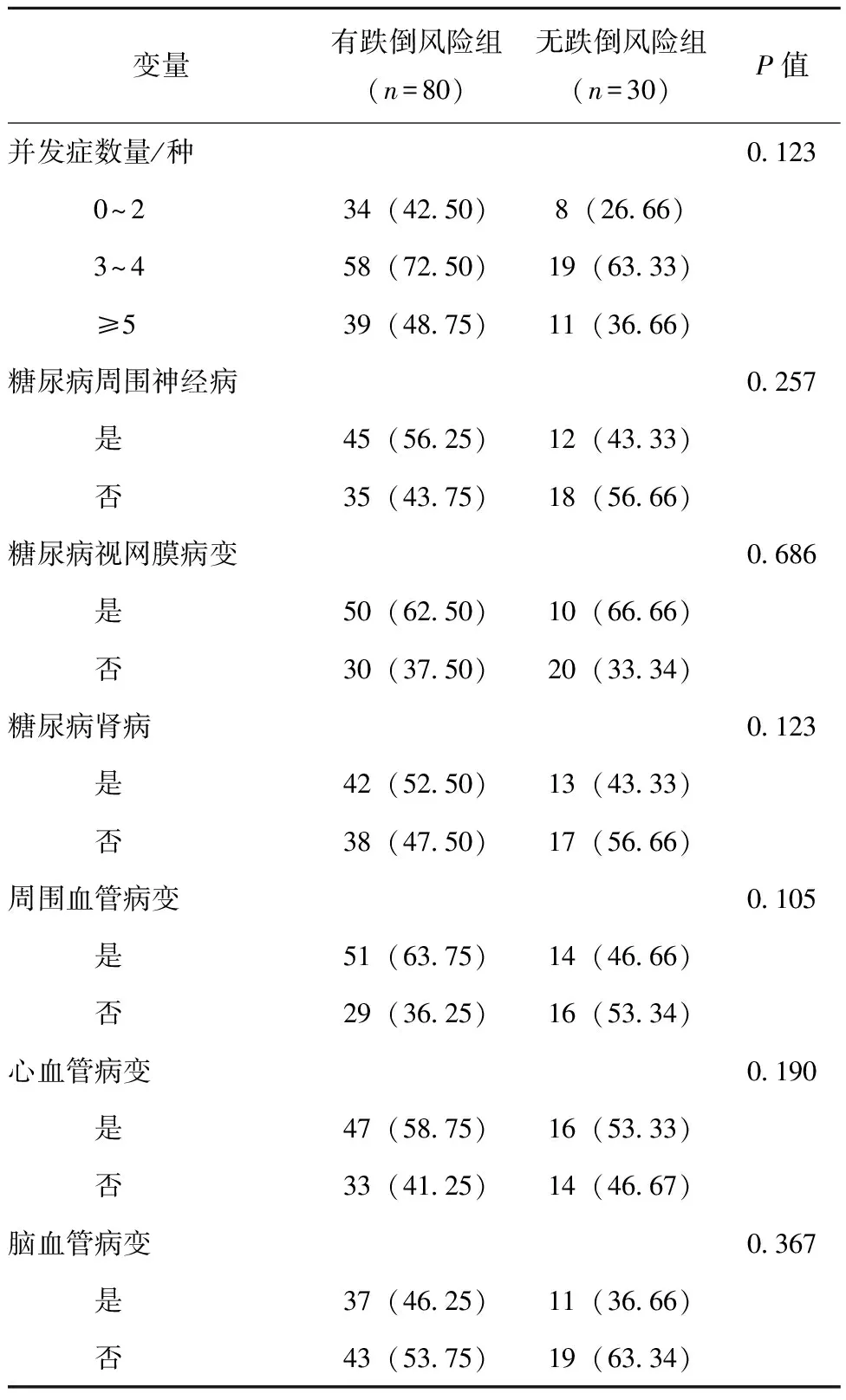
表4 糖尿病患者以跌倒风险分组的慢性并发症的比较[n(%)]
2.5 糖尿病患者以跌倒风险分组的降糖药物比较
两组间使用胰岛素比例跌倒风险组56.25%明显高于无跌倒风险组33.33%,差异有统计学意义(P<0.05),见表5。

表5 糖尿病患者以跌倒风险分组的降糖药物比较[n(%)]
2.6 Logistic回归分析
在T2DM患者中,以是否有跌倒风险为因变量,以年龄、性别、腰椎L1~L4、左侧股骨骨密度、TUGT、握力减低、25-OH-VD、口服降糖药物、使用胰岛素作为自变量,进行多因素Logistic回归分析,结果显示:握力减低是老年T2DM患者发生跌倒风险的独立危险因素,握力减低(OR=3.350,95%CI:1.026~10.290,P<0.05),见表6。
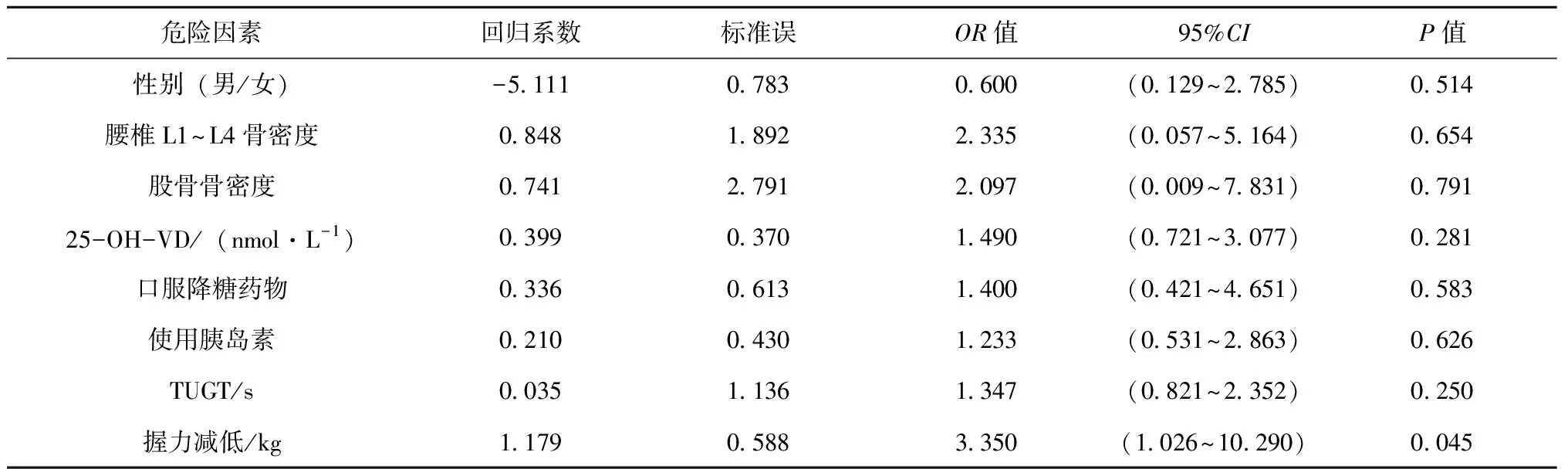
表6 糖尿病组患者跌倒风险多因素Logistic回归分析
3 讨 论
这是一项同时考虑骨密度、握力、身体平衡能力等多种因素来确定影响老年T2DM患者跌倒风险的研究,本研究的结果可用于设计干预措施,为预防老年T2DM患者跌倒提供有用的帮助。
握力是肌肉力量的简单衡量标准,虽然仍有争议,但测量握力是检测全身肌力的常见替代标志物之一[18]。本研究显示,握力减低在糖尿病组的发生率68.18%明显高于对照组34.00%,且糖尿病组患者握力普遍更低。糖尿病组患者握力减低在跌倒风险组的发生率明显高于无跌倒风险组(P<0.001),通过多因素Logistic回归分析显示握力减低是老年T2DM患者跌倒风险的一个独立危险因素。考虑可能的原因是老年T2DM患者肌肉力量下降导致行动能力减弱、体能减弱、自理能力降低,进一步导致老年T2DM患者出现步态不稳,平衡能力严重受损增加跌倒风险。另外在日常生活中,大多数老年T2DM患者在行走时会使用辅助器械,辅助器械的使用需要肌肉力量协助,一旦肌肉力量减低,很容易出现四肢功能急剧下降及力量不稳,增加跌倒风险[19]。糖尿病加速了老年人肌肉力量的下降,跌倒和受伤风险显著增加。国外研究显示握力≤18.65 kg使老年女性T2DM患者跌倒的概率增加了3.48倍[20]。
TUGT被认为是评估身体平衡能力的指标,该实验可通过记录时间直接评估跌倒风险,老年T2DM患者经过多因素Logistic回归分析发现TUGT在与跌倒风险影响方面的重要性不如握力重要。这可能是因为在进行TUGT检测时选取老年T2DM患者样本量过少,同时该人群能够独立完成TUGT检测表明患者有较好的动态平衡能力,这些因素可能是导致TUGT不是老年T2DM患者跌倒风险的独立危险因素。但是,TUGT测试仍在评估跌倒风险中起重要的作用,老年T2DM患者跌倒风险组测试所用时间明显高于无跌倒风险组,因此仍需要更多的研究来证实TUGT与老年T2DM患者跌倒风险的相关性。
本研究结果显示T2DM患者跌倒风险组腰椎L1~L4及左侧股骨骨密度较对照组明显下降并与跌倒风险密切相关。考虑可能原因是老年T2DM患者骨质量受损,由于骨结构特性的衰退,在骨量减少的情况下,导致骨密度降低,进而增加跌倒风险[21]。另一方面,胰岛素抵抗是T2DM最重要的特征,它以两种方式直接影响骨骼质量。首先,循环中的高血糖诱导成骨细胞对胰岛素样生长因子-1的作用产生抵抗。其次,高浓度的晚期糖基化终末产物会损害胰岛素样生长因子-1对成骨细胞的刺激作用。在该人群中,胞质分裂作用因子7的缺失和胸腺细胞分化抗原-1表达的沉默诱导更高的骨吸收和脂肪生成增加,这导致骨形成受损,进而导致骨量减低[22]。尽管在大多数研究中,DXA测量的骨密度是正常的,甚至升高,但是本研究显示腰椎L1~L4及左侧股骨骨密度均有所降低。既往研究结果显示,T2DM患者腰椎及股骨骨密度明显低于健康者。但本研究经过多因素Logistic回归分析结果并未提示腰椎L1~L4、左侧股骨骨密度是老年T2DM患者的影响因素,可能是因为该实验样本量有限或部分骨密度低的患者并未发生跌倒甚至行走步态正常,影响跌倒风险评估。在今后的研究中可以增加研究人群及范围,增大样本量,排除混杂因素得出更具体研究数据及结果,进一步分析骨密度对老年T2DM患者跌倒风险的研究。
本研究显示糖尿病组及非糖尿病组患者中跌倒风险组25-OH-VD水平明显低于无跌倒风险组,但对于因果关系未知。进一步Logistic多因素回归分析显示25-OH-VD与老年T2DM患者跌倒风险无关,考虑可能的因素是本研究选取样本量不足,或者当25-OH-VD更低时才会明显影响老年T2DM跌倒风险。25-OH-VD是维生素D的主要存在形式,是皮肤合成或饮食摄入的极好生物标志物。有大量文献支持维生素D状态不佳与跌倒风险增加之间的联系,一项国外研究分析结果显示,维生素D的补充可以显著降低老年T2DM患者的跌倒风险,改善肌肉力量。另一项研究表明,25-OH-VD缺乏症(<20 ng/mL)被认为是跌倒的危险因素,一旦25-OH-VD降至20 ng/mL以下,跌倒的频率就会显著增加[23]。总之,老年T2DM患者跌倒风险的发生率显著增加,但25-OH-VD与老年T2DM患者的跌倒风险的相关性仍需进一步研究。
对于本研究来说,并未发现口服降糖药物与老年T2DM患者跌倒风险有显著相关性,考虑可能因素为该实验选组人数较少有关,两组患者使用口服降糖药的频率相似,每种患者并未单一服用一种口服药也对该实验的结果有影响。本研究结果显示胰岛素治疗与老年T2DM患者跌倒风险有关,但并未显示胰岛素治疗是老年T2DM患者跌倒风险的独立危险因素。既往国外研究表明降糖药物对老年T2DM患者是否有跌倒风险存在争议,胰岛素治疗已被证明是跌倒的独立危险因素,KANG L[24]等文献研究表明磺脲类药物与低血糖风险的增加有关,低血糖会增加跌倒的风险,但磺脲类药物与跌倒风险之间关系的研究很少,因此得出的结果不一致。国内有关跌倒风险的文章并未显示降糖药物与老年T2DM患者跌倒风险有关。本研究并未发现口服降糖药治疗与老年T2DM患者跌倒风险有显著相关性,考虑可能因素为该实验选组人数较少有关,以及药物使用重复性,并非单一种药物治疗糖尿病所影响。因此,降糖药物与老年T2DM患者的跌倒风险的相关性仍需进一步研究。
本研究结果并未显示DPN及其它并发症与老年T2DM患者跌倒风险有相关性,考虑一个可能会影响结果的原因就是样本量过小。一项国外研究表明DPN的存在与跌倒的发生率之间没有显著的相关性,本研究与该研究结果相一致,但是本研究与其他研究有些差异,考虑可能的原因是本实验女性患者样本量过多以及总体人数选择过少。CHIBAY[25]等研究发现患有T2DM的老年人因DPN、DR而发生跌倒的风险增加。国内一篇报道显示DR与老年T2DM患者跌倒风险有关,并且说明是独立危险因素。本研究结果并未显示DR是老年T2DM患者跌倒风险的独立危险因素,考虑可能的原因是本研究DR患者过少,筛选的入组人数过少,因此并未得出相同结果。总之,糖尿病并发症与老年T2DM患者的跌倒风险的相关性仍需进一步研究。
综上所述,本研究提示跌倒风险评估对预防老年T2DM患者跌倒具有重要作用,但仍需要更多的研究来证实影响老年T2DM患者跌倒风险的因素。

