基于氮掺杂硅量子点检测Cr(Ⅵ)的荧光传感新方法
吴一微,董 淼,曹 杰
(1.稀有金属湖北省协同创新中心,污染物分析与资源化技术湖北省重点实验室,湖北 黄石 435000;2.湖北师范大学 化学化工学院,湖北 黄石 435002)
0 引言
Cr(Ⅵ)具有强氧化性,是毒性很大的一级致癌物[1],能够导致人体皮肤损伤、肺癌以及肾脏功能损害,对人体健康造成极大危害。因此建立一种简单、灵敏、快速检测Cr(Ⅵ)的方法具有重要意义。目前,常见的Cr(Ⅵ)检测方法主要有原子吸收光谱法[2]、荧光光谱法[3]和比色法[4]等,其中荧光法因其具有操作简单、灵敏度高、选择性好等优点受到了广泛关注。
基于以上调研,本文利用氮掺杂硅量子点(N-SiQDs)作为荧光探针,尝试建立快速检测不同基体样品中Cr(Ⅵ)的荧光传感新方法。该方法具有操作简单、灵敏度高、速度快、成本低廉等优点。已经成功用于环境水样和食物样品中Cr(Ⅵ)的含量检测,结果令人满意。
1 实验部分
1.1 主要试剂及仪器
1.1.1 试剂 N-SiQDs(本课题组自行研制);K2Cr2O7(分析纯天津博迪化工股份有限公司);其他金属离子(分析纯天津市科密欧化学试剂有限公司)。
1.1.2 仪器 紫外可见分光光度计(日本, U-3010);荧光分光光度计(日本, F-4700);微波化学反应器(中国, MCR-3);荧光寿命光谱仪(英国, FLS 980)。
1.2 实验方法
1.2.1 N-SiQDs用于Cr(Ⅵ)的检测 将0.77 mM N-SiQDs和625 μL 100 mM PBS缓冲溶液(pH 7.0)在室温下混合10 min,随后,在上述混合溶液中分别加入不同浓度的K2Cr2O7标准溶液,用二次去离子水定容至5.0 mL,室温下超声30 s,在360 nm激发波长下,用荧光分光光度计记录所得溶液的荧光光谱。
1.2.2 样品预处理 水样:取自湖北师范大学青山湖、三角荷塘以及本实验室自来水,分别以10 000 rpm离心10 min,所得溶液用0.45 μm滤膜过滤。 红酒:从学校超市购入,分别以10 000 rpm离心10 min,所得溶液用0.45 μm滤膜过滤。 菊花茶:将菊花茶茶包(从黄石超市购买)浸泡在50 mL的二次去离子水中,煮沸10 min,所得溶液用0.45 μm滤膜过滤。 牛奶:取1 mL牛奶(从黄石超市购买),以12 000 rpm高速离心15 min,弃去上层脂肪,取用下层液体。
1.2.3 实际样品中Cr(Ⅵ)的检测 将0.77 mM N-SiQDs,625 μL 100 mM PBS缓冲溶液(pH 7.0)在室温下混合均匀,然后分别加入一定体积的水样、葡萄酒、菊花茶、牛奶样品,用二次去离子水定容至5 mL,超声30 s,在360 nm激发波长下,用荧光分光光度计记录所得溶液的荧光光谱。
2 结果与讨论
2.1 N-SiQDs荧光探针检测Cr(Ⅵ)的原理
图1列出了水溶性N-SiQDs的微波合成路线及其用于检测Cr(Ⅵ)的荧光猝灭原理。我们以3-氨丙基三乙氧基硅烷(APTES)和乙二胺四乙酸二钠盐为原料,在180℃下微波加热10 min,快速合成了水溶性的N-SiQDs,其荧光量子产率为18.3%,由于Cr(Ⅵ)与N-SiQDs之间的内滤效应,N-SiQDs的荧光被显著猝灭,基于此现象,建立了一种灵敏检测Cr(Ⅵ)的荧光传感新方法。

图1 N-SiQDs的形成过程和Cr(Ⅵ)的检测原理
2.2 N-SiQDs荧光探针的荧光光谱和紫外可见吸收光谱表征
图2是N-SiQDs的荧光光谱和紫外可见吸收光谱,λex=360 nm,λem= 445 nm,最大紫外吸收波长为295 nm,紫外灯照射下溶液颜色为蓝色。
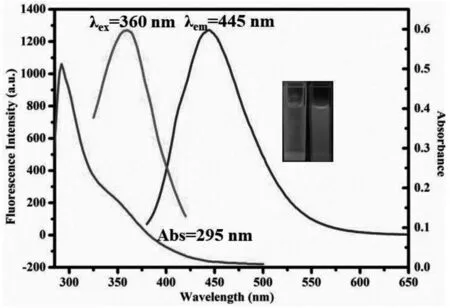
图2 N-SiQDs的荧光光谱和紫外-可见吸收光谱
2.3 N-SiQDs荧光探针的选择性

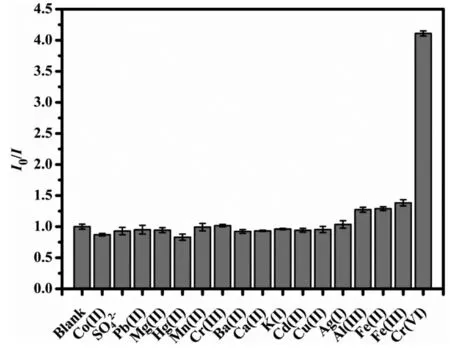
图3 N-SiQDs对各种金属离子的选择性(N-SiQDs: 0.77 mM,[Mn+]: 15 μg mL-1, I0/I表示初始荧光强度/最终荧光强度)
为了探究N-SiQDs荧光探针的猝灭机理,我们研究了Cr(Ⅵ)和N-SiQDs的紫外吸收光谱及荧光光谱。如图4(a)可见,Cr(Ⅵ)在313~450 nm处有较宽的紫外吸收,N-SiQDs在350 nm处也有一条较宽的激发带,其最大发射波长为440 nm.Cr(Ⅵ)的紫外吸收谱图与N-SiQDs的激发谱图重叠,因此我们推测N-SiQDs荧光猝灭的机理可能是:Cr(Ⅵ)与N-SiQDs之间存在内滤效应,导致N-SiQDs荧光猝灭。如图4(b)为Cr(Ⅵ)与N-SiQDs及N-SiQDs+ Cr(Ⅵ)的紫外吸收谱图,可见并未产生新峰,即并未产生新物质,因此说明Cr(Ⅵ)与N-SiQDs之间存在内滤效应,导致N-SiQDs荧光猝灭。说明在Cr(Ⅵ) 猝灭N-SiQDs荧光的过程中内滤效应起主导作用。为了进一步探究N-SiQDs荧光探针的猝灭机理,我们测量了N-SiQDs在与Cr(Ⅵ)混合前后的荧光寿命(τ0,τ1)。结果如图4(c)所示,其荧光寿命未发生明显变化(τ0=13.14 ns,τ1=12.69 ns),证明了这是一个静态猝灭过程。

图4 (a) Cr(VI)的紫外-可见吸收光谱和N-SiQDs的荧光激发和发射光谱,(b) Cr(VI)、N-SiQDs和N-SiQDs+Cr(VI)的紫外-可见吸收光谱,(c)在360 nm激发下加入Cr(Ⅵ)前后的N-SiQDs的荧光寿命衰减曲线
2.4 N-SiQDs荧光探针检测Cr(Ⅵ)新方法的条件优化
2.4.1 pH值优化 在固定Cr(Ⅵ)的浓度为7 μg·mL-1,N-SiQDs浓度为0.77 mM时,考察了pH对N-SiQDs荧光猝灭程度的影响。结果如图5(a)所示,在pH 4~7时随着酸性减弱N-SiQDs的荧光猝灭效率逐渐增加,在pH 7~12时N-SiQDs的荧光猝灭效率达到最大并保持稳定,考虑到该方法未来可能运用到生物样品的检测。因此,选择pH 7的PBS缓冲溶液为最佳条件。
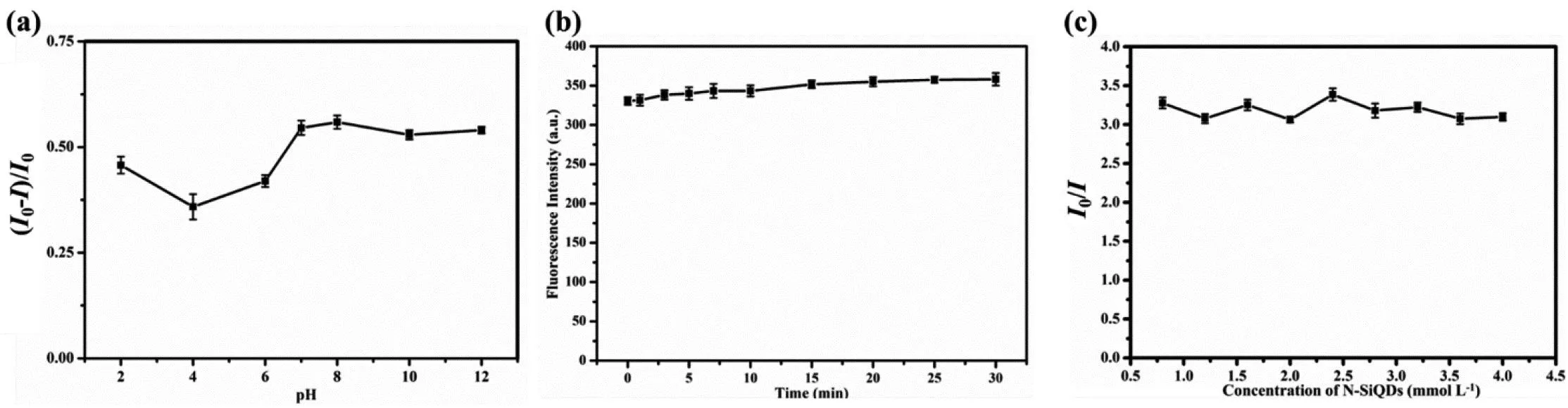
图5 (a) pH对N-SiQDs荧光猝灭效率的影响(N-SiQDs: 0.77 mM, Cr(VI): 7 μg·mL-1 ),(b) N-SiQDs对Cr(VI)响应时间的优化(N-SiQDs: 0.77 mM, Cr(VI): 10 μg·mL-1),(c) N-SiQDs用量对荧光传感平台测Cr(VI)的影响(Cr(VI): 10 μg·mL-1).
2.4.2 反应时间优化 图5(b)反映了在Cr(Ⅵ)存在下,反应时间(0.5~30 min)对N-SiQDs荧光强度的影响。从图中可以看出,Cr(Ⅵ)存在时,N-SiQDs荧光探针的荧光强度在(0.5~30 min)内保持不变,说明N-SiQDs对Cr(Ⅵ)的响应较快。因此,综合考虑选择0.5 min为最佳条件。
2.4.3 N-SiQDs用量优化 为了获得最佳的灵敏度,对N-SiQDs的用量进行了优化。将Cr(Ⅵ)浓度固定在10 μg·mL-1,在pH 7的12.5 mM PBS缓冲溶液中,考察N-SiQDs的用量对荧光强度比值的影响,结果如图5(c)所示,N-SiQDs的浓度在(0.77~4 mM)范围内,该荧光探针荧光强度的比值基本不变。因此,综合考虑N-SiQDs最佳用量为0.77 mM.
2.5 N-SiQDs荧光探针检测Cr(Ⅵ)的分析性能
在最优条件下,进一步探究了N-SiQDs荧光探针检测Cr(Ⅵ)的分析性能。将不同浓度的Cr(Ⅵ)标准溶液分别加入0.77 mM的N-SiQDs溶液中。结果如图6所示,从图6(a)中可见,N-SiQDs荧光强度随Cr(Ⅵ)浓度(0.5~5.0 μg·mL-1和5~12 μg·mL-1)的增加呈线性下降。图6(b)表示N-SiQDs荧光强度的比值(I0/I)与Cr(Ⅵ)浓度的线性关系,发现I0/I分别在0.5~5.0 μg·mL-1和5.0~12.0 μg mL-1这两个浓度范围呈线性关系,其线性方程分别为I0/I=0.144 06C+0.953 7 (R2=0.992 7)和I0/I=0.0.288 48C+0.215 9 (R2=0.994 0),RSD=0.56%,检出限(LOD)为0.16 μg·mL-1.

图6 (a)N-SiQDs荧光探针在不同浓度Cr(Ⅵ)存在下的荧光发射光谱(0.5~12 μg mL-1),(b) I0/I与之相应的Cr(Ⅵ)浓度关系图(N-SiQDs: 0.77 mM, λex=360 nm).
将建立的N-SiQDs荧光检测Cr(Ⅵ)的方法与其他方法做了比较,结果如表1所示,从表1中可以看出与原子火焰吸收光谱法、电化学法等非荧光方法相比[5,6],本方法的LOD低于Ye等[5,6]工作,高于Li等[7,8]研究,且具有操作简单、选择性好、灵敏度高的优势,和其它荧光传感方法相比[7,8],本方法的量子产率高于Zhang[8]的工作,低于Li[7]的研究,也具有一定的优势,同时反应时间较绝大多数方法快[5~8]。

表1 本方法与其它Cr(Ⅵ)传感平台性能比较
2.6 实际样品检测
为了探索N-SiQDs荧光探针检测Cr(Ⅵ)的可行性和现实应用,我们在最佳条件下,对环境水样、菊花茶、红酒和牛奶中的Cr(Ⅵ)进行分析。结果如表2所示,我们成功测出不同加标浓度的Cr(Ⅵ),回收率为88.1%~106.8%,标准偏差(RSD)小于2% (n=5),说明N-SiQDs荧光探针在检测不同环境水样和食物样品中Cr(Ⅵ)含量方面具有较好的应用潜力,抗干扰能力强。

表2 实际样品中Cr(VI)的测定
3 结论
综上所述,以N-SiQDs为探针,基于Cr(VI)对N-SiQDs的内滤效应,引起N-SiQDs的荧光猝灭,建立了一种灵敏检测Cr(VI)的传感新方法。本方法具有选择性好、样品前处理简单、操作简便、成本低廉、速度快等优点,且已成功用于不同基体样品中Cr(VI)的检测,对于环境水样和食品中Cr(VI)的监测具有应用推广价值。

